Элементы p-блока.
Алюминий

Анод постепенно сгорает. Таким образом, при электролизном получении алюминия расходуется не только оксид алюминия, но и графит. Электролиз сопровождается побочными реакциями, приводящими к образованию CF4, OF2 и др. Поэтому производство алюминия оказывается экологически вредным. Но обходиться без алюминия человечество уже не может. Огромное практическое значение имело бы создание легкоплавкой… Читать ещё >
Элементы p-блока. Алюминий (реферат, курсовая, диплом, контрольная)
Из тридцати элементов p-блока только девять — металлы: Al, Ga, In, Tl, Sn, Pb, Sb, Bi, Po. Наиболее сильные металлические свойства проявляют элементы группы ША, в которой только бор — неметалл. Оксиды и гидроксиды почти всех металлов p-блока являются амфотерными, их катионы в растворах сильно гидролизуются. В сложных веществах эти элементы могут реализовать две положительные степени окисления. Одна из них равна номеру группы, вторая — на две единицы меньше. Переменные степени окисления особенно характерны для таллия, олова, свинца и сурьмы. Металлы шестого периода: таллий, свинец и висмут — в высших степенях окисления проявляют сильные окислительные свойства.
Пример 5.4.
На каких энергетических подуровнях находятся валентные электроны металлов p-блока? Напишите полную и сокращенную электронную формулу алюминия.
У металлов p-блока валентные электроны находятся на внешних sи р-подуровнях. У алюминия это подуровни 35 и 3р: l522s22p63s23p1 или [Ne]3s23p1.
Большинство металлов p-блока в электрохимическом ряду напряжений стоят левее водорода, но близко к нему. Из водных растворов солей они восстанавливаются цинком и другими умеренно активными металлами. Только алюминий весьма активен; он не восстанавливается в водной среде ни металлами, ни электролизом. Металлы р-блока по химическим свойствам почти не проявляют сходства с металлами s-блока. Отмечается лишь диагональное сходство между алюминием и бериллием.
Нахождение в природе алюминия. Среди металлов p-блока особенно важен алюминий. По распространенности в земной коре (8,2%) он уступает только кислороду и кремнию. Он встречается в виде разнообразных кислородных соединений и в виде соединения с фтором Na3[AlF6], называемого криолитом. В качестве сырья для получения металлического алюминия обычно используют боксит А10(0Н)-А1(0Н)3 и нефелин KNa3[AlSi04]4. Природный оксид алюминия ос-А1203 (корунд) — основа ряда драгоценных камней: сапфира, рубина, восточного топаза и др. Глина (каолин) представляет собой аморфное соединение Al203-2Si02-2H20.
Физические свойства и применение алюминия. Алюминий как простое вещество — белый, блестящий, мягкий и легкий металл с хорошей электрической проводимостью. Чистый алюминий широко применяют для изготовления электропроводов. Изучено огромное количество сплавов на основе алюминия. Широко известны сплавы дуралюмины, содержащие до 13% меди, а также добавки ряда других металлов, обладающие высокой твердостью. Сплавы алюминия с магнием характеризуются коррозионной стойкостью. Алюминий и его сплавы занимают в современной технике второе место после сплавов железа. Мировое производство алюминия превышает 15 млн т в год.
Получение алюминия. Впервые алюминий был получен из комплексного соединения Na[AlCl4] восстановлением натрием:

Этот алюминий был очень дорог, так как сначала надо было получить натрий электролизом. Он считался драгоценным металлом и в 1825 г.
стоил в 1500 раз дороже железа. Современная эпоха широкого использования алюминия началась с изобретения в 1886 г. Ч. Холлом (ему было всего 21 год!) электролизного способа получения алюминия.
Электролизу подвергают расплавленную смесь криолита и оксида алюминия. В расплав добавляют также фторид кальция для понижения температуры плавления. Катод и анод изготавливают из графитовых блоков. Процесс идет при температуре -950 °С. На катоде образуется расплавленный алюминий:
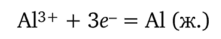
На аноде окисляется кислород до 02, а также происходит окисление материала анода:
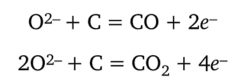
Анод постепенно сгорает. Таким образом, при электролизном получении алюминия расходуется не только оксид алюминия, но и графит. Электролиз сопровождается побочными реакциями, приводящими к образованию CF4, OF2 и др. Поэтому производство алюминия оказывается экологически вредным. Но обходиться без алюминия человечество уже не может. Огромное практическое значение имело бы создание легкоплавкой системы для электролизного получения алюминия. В этом направлении успехи пока не достигнуты.
Химические свойства алюминия. На воздухе алюминий покрывается тончайшей, но прочной пленкой оксида алюминия. Поэтому он ведет себя как металл с достаточно высокой устойчивостью к внешним воздействиям. При нагревании алюминий начинает реагировать с кислородом с выделением большого количества теплоты:
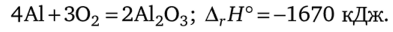
С углем алюминий реагирует при температуре 2000 °C, образуя карбид А14С3 оранжевого цвета.
Алюминиевый порошок восстанавливает многие металлы (железо, марганец, хром и др.) из оксидов. Эти реакции сопровождаются выделением большого количества теплоты, и металлы получаются в расплавленном состоянии. В остывшей смеси после реакции находят металлические шарики. На этих реакциях основана алюминотермия — способ получения небольших количеств металлов, а также сварка металлов. Для проведения реакции порошки алюминия и оксида металла хорошо перемешивают и поджигают горящей полоской магния. Смесь раскаляется добела.
Алюминий не реагирует с чистой водой, но окисляется водой в растворах щелочей, которые очищают его поверхность, растворяя защитный слой оксида:
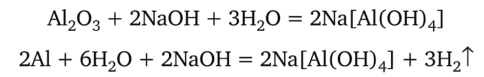
Если бы на поверхности алюминия не было защитного слоя, то из него нельзя было бы изготавливать посуду.
Алюминий быстро реагирует с разбавленными кислотами с выделением водорода. Сильно разбавленная азотная кислота реагирует с алюминием без выделения газа, так как азот восстанавливается до NH4:
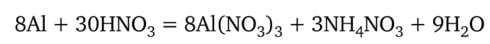
Концентрированная азотная кислота пассивирует поверхность алюминия, и реакция не идет.
В солях алюминий замещает менее активные металлы:
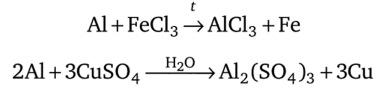
Соединения алюминия. Алюминий образует очень прочные связи с кислородом. Они реализуются и в оксиде алюминия, и в солях кислородсодержащих кислот, и в кристаллогидратах бинарных солей. Соединения алюминия со связями А1—Cl, А1—S, А1—С подвергаются полному гидролизу. В этом можно убедиться на примере хлорида алюминия А1С13. С водой он реагирует, образуя кристаллогидрат, фактически являющийся комплексным соединением:
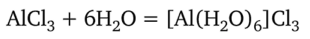
В этом кристаллогидрате отсутствуют химические связи между алюминием и хлором. При сильном прокаливании вместо безводного А1С13 образуется оксид:
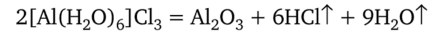
Более прочные связи, чем с кислородом, алюминий образует только с фтором. Поэтому фторид алюминия не растворим в воде и не гидролизуется.
Оксид алюминия (корунд) А1203 — тугоплавкое и химически стойкое вещество. Он не реагирует с растворами кислот и щелочей. При сплавлении с твердой щелочью или карбонатом оксид А1203 образует алюминаты:
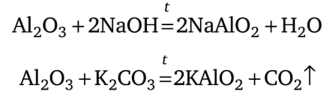
Алюминаты, получаемые в отсутствие воды, содержат ионы А102, в водной среде — ионы [А1(ОН)4]_.
Гидроксид алюминия А1(0Н)3 представляет собой типичное амфотерное вещество. При его осаждении из раствора соли действием щелочи образование осадка можно даже не заметить, так как минимальный избыток щелочи вызывает растворение. Поэтому гидроксид алюминия получают по реакции соли алюминия со слабым основанием:
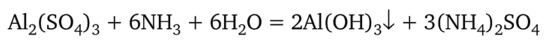
Растворы солей алюминия с анионами сильных кислот имеют кислую реакцию вследствие гидролиза иона алюминия.
Гидролиз ионов А13+ приводит к тому, что обменные реакции в растворах редко приводят к образованию осадков нерастворимых солей, вместо которых выпадает гидроксид алюминия:
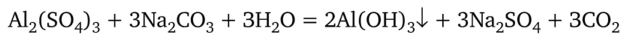
Алюминий образует двойные соли, относящиеся к семейству квасцов. Это двойные сульфаты, содержащие одновременно равное число однозарядных и трехзарядных катионов. Наиболее широко известны калийалюминиевые квасцы KA1(S04)2'12H20. Эта соль обладает дубящим действием. В безводном состоянии KA1(S04)2 (жженые квасцы) применяют как присыпку, потому что в кристаллогидрат она превращается медленно и во влажной среде долго сохраняет свои свойства.
Вопросы и задания
- 1. Как классифицируют химические элементы р-блока?
- 2. Какие степени окисления реализуются у металлов р-блока?
- 3. Перечислите способы получения алюминия.
- 4. В чем заключается процесс алюминотермии?
- 5. Напишите реакцию гидролиза иона алюминия.
- 6. Сколько граммов марганца образуется при реакции смеси 68,7 г хаусманита Мп304 и 25,0 г алюминия?
- 7. Напишите сокращенную электронную формулу олова.