Круговорот легко подвижных продуктов почвообразования в природе

Чтобы доказать, что такое условие существует на самом деле, Шлезинг приводит следующий расчет: если принять, что море равномерно разлито по всему земному шару, то глубина его будет около 1000 метров. Количество углекислоты в прямоугольной призме, имеющей 1000 м высоты и 1 кв. м в основании, будет 98,3 кило. Из этого количества половина связывается основаниями, а другой половиной можно располагать… Читать ещё >
Круговорот легко подвижных продуктов почвообразования в природе (реферат, курсовая, диплом, контрольная)
Говоря о круговороте подвижных продуктов почвообразования, мы будем иметь в виду круговорот солей и отчасти газов (преимущественно углекислоты), образующихся при распаде органических веществ и при выветривании минералов (соли). Мы не можем здесь, конечно, охватить полностью весь происходящий в природе круговорот веществ, так как это завело бы нас слишком далеко, а потому мы сознательно суживаем свою задачу. Несомненно, что целый ряд солеобразных продуктов и газов попадает в атмосферу из вулканов, фумаролл, из глубоких источников и трещин земной коры, но на этих явлениях мы останавливаться не будем, отметив лишь, что среди тех веществ, которые вносятся в почву с атмосферными осадками, находятся не только продукты почвообразования, но и продукты земных глубин, так или иначе попадающие в атмосферу.
Для полного количественного учета веществ в круговороте данных недостаточно, и нам придется больше останавливаться на качестве явлений, отмечая количественную сторону там, где это возможно.
Из главы о гумусе мы уже знаем, что микробиологические процессы приводят к образованию целого ряда кислот, из коих только углекислота образуется (отчасти и при содействии высших растений) в таких количествах, для усреднения которых в почве не хватает оснований. Остальные кислоты, как серная[1], фосфорная, азотная, нейтрализуются частью теми основаниями, которые находятся среди зольных элементов, частью основаниями, отщепляющимися от силикатов. Хлор также находят в золе растений, а потому и хлористые соли могут получаться при распаде органических остатков в почве.
Остановимся первоначально на круговороте углекислоты. По теории Шлезинга, регулятором содержания углекислоты в атмосфере, помимо ветров, служит море. Определяя повторно содержание в морской воде углекислоты и карбонатов, он нашел, что в литре такой воды растворено 98,3 миллигр. углекислоты и такое количество карбонатов, которое эквивалентно 98,3 мг. серного ангидрида. Отношение эквивалентов углекислоты и оснований = 4,47: 24 8; откуда следует, что углекислота связана в значительной степени в виде бикарбонатов. Шлезинг указывает, что чистая вода, находясь в соприкосновении с карбонатами щелочных земель и атмосферой, содержащей углекислоту, растворяет некоторое количество карбонатов, которое возрастает с увеличением парциального давления углекислоты в атмосфере. Следует ожидать, что между морем и атмосферой существует постоянный обмен: если количество углекислоты в воздухе уменьшается, море отдает в воздух часть своей углекислоты, в силу чего выпадает из раствора некоторое количество карбонатов, в виде средней соли, если же содержание углекислоты воздуха возрастает, море поглощает избыток, на счет которого образуется некоторое количество бикарбонатов. Регулирующее действие моря допустимо, однако, лишь тогда, если содержание в нем углекислоты значительно больше того количества, на которое может измениться состав воздуха.
Чтобы доказать, что такое условие существует на самом деле, Шлезинг приводит следующий расчет: если принять, что море равномерно разлито по всему земному шару, то глубина его будет около 1000 метров. Количество углекислоты в прямоугольной призме, имеющей 1000 м высоты и 1 кв. м в основании, будет 98,3 кило. Из этого количества половина связывается основаниями, а другой половиной можно располагать для регулирования содержания углекислоты воздуха. Если принять, что атмосфера имеет равномерный состав и содержит 0,0003 об. углекислоты, то вертикальная призма атмосферы с основанием в 1 кв. метр заключает только 4,7 кило углекислоты. Следовательно, море содержит в 10 раз большее количество углекислоты, чем вся атмосфера, и, конечно, во много раз больше того количества, которым выражается колебание в составе атмосферы.
Переходим теперь к круговороту азота. Азотнокислые соли, часть которых используется растениями, накопляются в почвах лишь в очень исключительных случаях, чаще всего в местностях с особенно сухим климатом. В большинстве же случаев остаток нитратов, не пошедший на питание растений и ускользнувший от процессов денитрификации, вымывается в грунтовые воды, откуда попадает в ручьи, реки и, наконец, моря. По наблюдениям Вельбеля, в литре лизиметрической воды под неудобренной почвой содержится в различные года и в различные периоды года от 0,178 до 0,664 г на глубине 25—50 см (данные относятся к черноземной зоне). В ключах и колодцах того же района Вельбель находил содержание от 5 до 35 миллигр. на литр, а в воде р. Днестра — всего 1,5 миллигр. на литр.
Несмотря на то, что в морские бассейны приносится довольно большое количество азотнокислых солей, в морской воде эти соли отсутствуют. Напротив, присутствие в ней аммиака может считаться твердо установленным (Marchand и Буссенго), и Шлезинг определяет его содержание средним числом в 0,4 мг на литр воды1. Очевидно, попадая в море, азотнокислые соли разлагаются, при чем происходит их превращение в аммиак и его соли (углекислый аммоний)[2][3], но как: протекают эти процессы, достоверно еще неизвестно; можно думать, что в море азотнокислые соли проделывают новый круговорот при посредстве питающихся ими морских растений и разлагающих остатки последних микроорганизмов.
По мере уменьшения в атмосфере парциального давления аммиака (углекислого аммония), из моря выделяется часть аммиачных: соединений в атмосферу. Потери аммиачных соединений из атмосферы происходят при содействии атмосферных осадков. Азотнокислый аммоний, находящийся в атмосфере в виде мельчайшей пыли (Буссенго), всегда увлекается атмосферными осадками; что же касается углекислого аммония, присутствующего в виде паров, то он также может увлекаться дождями, но может и увеличивать свое содержание в воздухе после дождя. Все зависит от состава и температуры облаков и плотности слоев воздуха, проходимых дождем. Аммиак в воздухе был открыт Шеелэ, а определение его количества было произведено Грегером[4]. Различные авторы дают для аммиака неодинаковые числа (в куб. метре воздуха от 0,02 до 0,04 мг; есть и большие числа). Летом и осенью атмосфера богаче аммиаком, зимой — беднее. Ночью воздух содержит больше аммиака, чем днем. Для иллюстрации этих положений могут служить нижеследующие определения Фодора:
Осень 1876 г. | 0,0558. | МГ. | |
Зима 1877 г. | 0,0251. | ". | |
Весна 1877 г. | 0,0303. | ". | |
Лето 1877 г. | 0,0488. | ". | |
Осень 1877 г. | 0,0344. | ". | |
День! Ночь]. | с 20/1Х 1877. | 0,4 609. | ". |
по 1/VI1878. | 0,4 745. | ". | |
Барраль вместе с Бино обратили внимание на то, что содержание аммиака в дождевой воде больше, чем азотной кислоты, и высказали предположение, что соединения азота находятся не только в грозовых, дождях, но и в дождях вообще, а также в росе и тумане. Все эти наблюдения подтверждены были впоследствии Буссенго, который производил свои исследования над составом атмосферных осадков вдали от жилищ, в лесной местности. Его определения дали следующие результаты:
NH3 | HN03 | |
В миллиграммах на литр | ||
Дождь. | 0,6. | 0,2. |
Снег. | 0,55. | 0,42. |
Туман. | —. | 0,39—1,83. |
Роса. | —. | 0,07—0,68. |
По исследованиям опытной станции в Gembloux (Бельгия), наибольшее количество азота содержится в инее. По данным Вельбеля, относящимся к Плотянской опытной станции, в различного рода осадках содержатся следующие количества аммиака:
Снег. | 0,915. | МГ. |
Дождь. | 0,964. | ". |
Грозовой дождь. | 1,229. | ". |
Изморозь. | 2,7. | ". |
Град. | 2,75. | ". |
Иней. | 4,2. | ". |
Роса. | 5,0. | ". |
Туман. | 5,57. | ". |
В сухое время года осадки содержат больше азота, чем во влажное, и с непродолжительными дождями выпадает большее количество азота, чем с продолжительными. Этот вывод Буссенго был подтвержден затем исследованиям Кнопа, Вольфа и Эйглинга.
Соединения азота далеко не на всем земном шар выпадают на земную поверхность в одинаковых количествах. В этом отношении особенно выделяются тропические области, где, по наблюдениям Miintz и Магсапо, выпадают и азот вообще, и азотная кислота в больших количествах, чем в умеренных областях. Наблюдения упомянутых исследователей относятся к Венецуэле (Каракас) и дают следующие цифры: среднее годовое количество свыше 2 мг на литр, максимальное, определенное в одной пробе дождя, было 16,25 мг, минимальное 0,2 мг. На остр. Соединения, по Raimbault, среднее содержание азотной кислоты — 2,67 мг на литр. В год на гектар для Каракаса получается 3,78 кило, для о. Соединения 0,93. Для сравнения приводам, цифры некоторых исследователей, относящиеся к умеренной зоне земного шара: 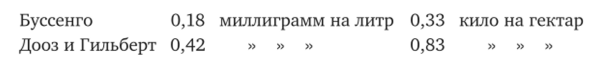
К сожалению, не всегда можно сравнивать цифры старых определений с более новыми, так как не все исследователи пользовались одинаковыми методами, что, по данным Warrington’a, дает значительную разницу в результатах[5].
Не так ясен вопрос относительно различия в количествах аммиака тропических и внетропическик широт. Miintz и Магсапо оределили это содержание для Каракаса в 1,55 мм на литр атмосферных осадков, что по сравнению с цифрой Буссенго для Liebfrauenberg’a (0,52 мг) и цифрой Лооза и Гильберта для Ротгэмстедта (0,97 мг) представляет довольно значительную разницу. Однако, заключения Miintz и Магсапо были оспариваемы Леви, который указывал на ряд данных для Франции, Англии, Италии и Германии, доставивших цифры для аммиака даже большие, чем нашли Miintz и Магсапо в тропиках. Правда, Мюнц ссылался на то, что европейские определения относятся преимущественно к большим городам, тем не менее он не вполне опроверг возражения Леви, и вопрос продолжает оставаться спорным.
Чтобы закончить с аммиаком, приведем здесь ряд определений, преимущественно европейских:
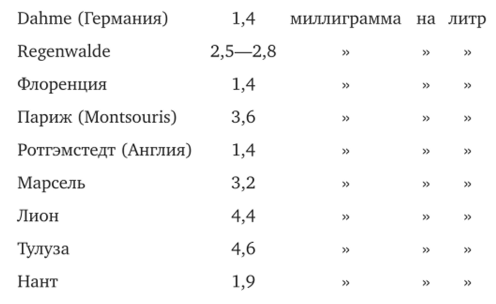
По данным Miintz и Laine, и у южного полюса количество аммиака в атмосферных осадках не отличается от тех величин, которые определялись для умеренных климатов.
Во всяком случае ясно, что аммиака содержится в атмосфере и атмосферных осадках умеренных областей земного шара больше, чем азотной кислоты. По данным Бретшнейдера, наиболее бедны аммиаком осенние осадки, а наиболее богаты весенние.
Общее количество азота, доставляемого таким образом верхним горизонтам земной коры, достигает ощутительных величин, что видно из следующих цифр:

Кроме углекислоты и соединений азота, в круговорот вступают соединения серы и хлора, которые также получаются при процессах почвообразования, хотя, как мы отметили выше, и не исключительно.
Вымывание всех вообще солей, получающихся в процессах почвообразования, из почвы в грунтовые воды, в ручьи и реки находится прежде всего в зависимости от климатических условий. Чем больше влаги, тем меньше в почве остается солей. Но для объяснения дальнейшего (передвижения солей и концентрации лишь определенных солей в мэрских бассейнах недостаточно знать распределение влаги по земной поверхности и степень растворимости отдельных солей. Здесь необходимо еще считаться с поглотительной способностью верхних слоев земной коры. Мы намеренно употребляем выражение «верхние слои земной коры», так как указанной выше способностью отличаются не только почвы, но и всякие поверхностные иловатые наносы, в том числе иловатые осадки речного дна и прибрежный ил морей. Отсылая читателя за подробностями к главе о поглотительной способности почв, мы укажем пока, что и основание, и кислоты поглощаются почвами не одинаково. В то время как калий поглощается весьма энергично, натрий поглощается более слабо; соли извести отличаются меньшей растворимостью, чем соли магнезии, и потому сильнее удерживаются почвой. Из кислот совершенно не поглощаются соляная и азотная, может поглощаться иногда серная (в присутствии извести) и энергично поглощается фосфорная. Если прибавить к сказанному, что в морских бассейнах углекислая известь идет на построение раковин животных, и припомнить, какие превращения испытывают в морских бассейнах азотнокислые соли, то можно наперед предсказать, какие основания и кислоты должны концентрироваться в океанических водах. Очевидно, там должно быть больше всего хлористых солей; второе место должно принадлежать сернокислым. Из оснований больше всего должно быть натрия, а затем магнезии. Имеющиеся анализы морских вод подтверждают вышесказанные предположения.
Установить количества, в которых из почвы поступают в грунтовые воды хлористые и сернокислые соли, пока нет возможности, за отсутствием достаточного количества данных. Можно только утверждать, что[6]
эти количества должны различаться в различных климатических зонах; даже в одной и той же зоне эти количества неодинаковы в сухие и влажные годы, как это было установлено наблюдениями на Ротгэмпстедской опытной станции. Такая же закономерность существует и по отношению к содержанию хлоридов и сульфатов в грунтовых и речных водах, что видно из нижеследующих данных, собранных Коосовичем:
С1. | so3 | |
В миллиграммах на литр | ||
Подзолистая зона | ||
Прудовые и грунтовые воды из парка Лесного Инст. | 12,4—39,7. | 10,4—31,8. |
Р. Череха Псковской губ. | 33,0. | —. |
Дренажные воды в Ротгэмстедте. | 10,7. | 24,7. |
Черноземная зона | ||
Колодезь Великоанад. леснич. | 124,0. | 1031,0. |
То же. | 283,0. | 1812,0. |
Колодезь с. Благодатного бывш. Мариуп. у. | 146,0. | 32,0. |
Область древних красноземов | ||
Из родника Чаквин. удель. имен. | 3,4. | 0,3. |
Из р. Чаквы Батумск. окр. | 6,8. | 1,3. |
Приносясь реками в морские бассейны и концентрируясь там, хлористые и сернокислые соли могут попадать из морей и океанов в атмосферу при распылении ветрами морской воды и испарении водяной пыли в атмосфере. С другой стороны, соли, остающиеся на земной поверхности, также попадают в атмосферу. Весь этот материал, разносясь атмосферными течениями, вместе с осадками вновь попадает на земную поверхность, и количество доставляемых таким образом солей не может считаться ничтожным.
По данным, собранным Миллером и Коссовичем1, в различных пунктах земного шара выпадают на земную поверхность следующие количества хлора и серной кислоты:
Годы. | Колич. осад; ков. (мм). | Миллигр. на литр | Килограммы на гектар в год. | |||
С1. | so3 | С1. | S03 | |||
Ленингр. Лесной Институт. | 1909—1911. | 625,6. | 2,54. | 12,66. | 16,85. | 78,90. |
Охтенское леснич. | ". | 671,3. | 2,12. | 11,81. | 14,18. | 78,97. |
Павловск, метеор, обсерв. | 1909—1910. | 545,8. | 1,46. | 3,11. | 7,95. | 16,90. |
1 См., работы Knox, W. К. (Chem. News, 1915, Т. 109) и Artis В. (Ibidem 1916, Т. 113), где приведены данные для штата Айоса.
Окончание таблицы
Годы. | Колич. осадков. (мм). | Миллигр. на литр | Килограммы на гектар в год. | |||
С1. | so3 | С1. | so3 | |||
Заполье Лужск. у. | ". | 484,0. | 3,03. | 2,24. | 14,61. | 10,80. |
Шатиловск. оп. стан, тульск. г. | ". | 476,4. | 2,23. | 1,93. | 9,16. | 0,87. |
Мариуп. оп. чеснич. быв. Екатериносл. губ. | ". | 401,6. | 3,28. | 14,17. | 13,12. | 56,67. |
Боровое опытн. лесн. Самарск. г. | 1909—1911. | 385,3. | 4,00. | 2,06. | 15,76. | 7,61. |
Ротгэмстедт. |
| 731,0. | 2,28. | 2,57*. | 16,67. | 19,51*. |
Новая Зеландия. | 1884—1888. | 754,4. | 8,83. | 2,22. | 66,63. | 16,75. |
Британская Гвиана. | 1890—1900. | 2601,2. | 5,04. | —. | 131,10. | —. |
Цейлон. | 1898—1899. | 2086,1. | 9,72. | —. | 202,48. | —. |
* Примечание: 1881—87.
Просматривая таблицу, нетрудно заметить, что максимальные количества хлора падают на местности, расположенные вблизи океанов (Нов. Зеландия, Британская Гвиана, Цейлон), максимальные же количества серной кислоты приурочены к фабрично-заводским районам (Лесной Институт, Охтенское лесничество, Мариупольское лесничество). Влияние океанов на распределение хлора было прослежено Джексоном (D. Jackson) в С. Америке на составе вод источников. Соединив кривыми пункты, где источники содержали одинаковое количество хлора, автор получил изохлоры, которые направлялись параллельно берегу Атлантического океана, при чем содержание хлора менялось обратно пропорционально расстоянию от берега.
- [1] Иногда в природе констатируется свободная серная кислота как результат окисления серы (см. мат. для изуч. ест.-произв. сил СССР № 59. Сера. — Сборник статейВлодавца, Волкова, Ферсмана и Щербакова. Ленингр. 1926).
- [2] Didilafait дает несколько иные цифры, а именно от 0,13 мг в Бенгальском заливедо 0,36 (у берегов Кохинхины); см. также Тирлиц. N. Jahrb. f. Mineral-1854.
- [3] Н. J. Brown определил в 100.000 метр, воздуха от 0,6601 до 0,7826 гр. (NH4)2C03.
- [4] Эрисман. Гигиена, 1901 г.
- [5] В большинстве случаев исследователи не отделяли азотистую кислоту от азотной. В последнее время Anderson U. G. (Chem. News, Т. ПО, 1914) отмечает, что азотнойк-ты maximum наблюдается летом, a minimum—зимой. Для азотистой кислоты отношения обратные.
- [6] V. Feilitzen, Hand Lugner, J.; об азотистых соединениях в атмосферных осадках, см. Miller, N. Н. J. Journ. Agr. Science, vol. I, p. 280—303; Wilson, B. D. Soil Science, vol. XI, № 2. 1921; Crowther and Buston, Hudig (Гронинген, Голландия), Juritz (Ю. Америка), Shutt and Dorrand (Ottava), Knight (Jowa), литература у Wilson.