Окислительно-восстановительные и обменные реакции

Если в реакции происходит изменение степени окисления хотя бы одного из элементов, то такие реакции относятся к окислительно-восстановительным, в противном случае их относят к обменным взаимодействиям. В ковалентном соединении электронные пары связи полностью относят к более электроотрицательному элементу и степенью окисления считают образующиеся при этом заряды. В процессе передачи электронов… Читать ещё >
Окислительно-восстановительные и обменные реакции (реферат, курсовая, диплом, контрольная)
Перераспределение химических связей сопровождается изменением электронного состояния атомов, молекул, ионов, участвующих в реакции. Во многих случаях оно является результатом передачи электронов от одних реагирующих частиц другим: 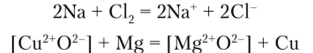
• Реакции, сопровождающиеся переносом электронов от одной частицы к другой, называются окислительно-восстановительными.
Передача электрона может быть и неполной — меняется лишь полярность связей. Например, в реакции
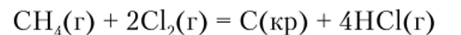
вместо малополярных связей С—Н появляются сильно полярные связи Н—С1.
Для удобства описания окислительно-восстановительных реакций в химии используется понятие степени окисления.
%/
• Степень окисления есть положительное или отрицательное число, которое по определенным правилам может быть приписано любому элементу в любом соединении и формально представляет собой гипотетический заряд на атоме этого элемента при допущении, что все гетероатомные химические связи чисто ионные.
Степень окисления определяется по следующим правилам.
- 1. Степень окисления элемента в простом веществе равна нулю.
- 2. Степень окисления элемента в форме одноатомного иона в веществе, имеющем ионное строение, равна заряду этого иона.
- 3. В ковалентном соединении электронные пары связи полностью относят к более электроотрицательному элементу и степенью окисления считают образующиеся при этом заряды.
- 4. Алгебраическая сумма всех степеней окисления элементов в нейтральной молекуле равна нулю, а в сложном ионе — заряду иона.
В дополнение к этим правилам полезно запомнить степени окисления некоторых наиболее часто встречающихся элементов.
Фтор как наиболее электроотрицательный элемент во всех своих соединениях имеет степень окисления -1. Кислород обычно имеет степень окисления -2, за исключением: а) фторидов, в которых его степень окисления положительна и б) пероксида водорода и его производных, в которых степень окисления кислорода равна -1. Водород в соединениях с неметаллами имеет степень окисления +1, а в соединениях с типичными металлами -1. Щелочные металлы во всех соединениях имеют степень окисления +1; щелочноземельные — практически всегда +2. Хлор только в соединениях с более электроотрицательными фтором и кислородом имеет положительные степени окисления, в соединениях с остальными элементами хлор присутствует в степени окисления -1.
Рассмотрим некоторые примеры:
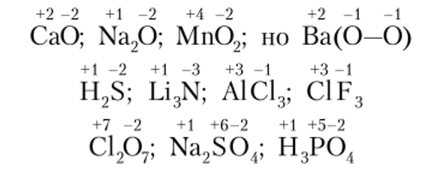
Следует еще раз подчеркнуть формальность понятия «степень окисления». Если элементы близки по электроотрицательное™, часто бывает трудно.
определить, какой из них должен иметь положительную, а какой — отрица-
-4+1 +3−1 +4−2
тельную степень окисления. Например, в соединениях SiH4, Asl3, CS2, во многих органических соединениях знак степени окисления того или иного элемента определяется скорее традициями и аналогиями, чем действительной разницей электроотрицательностей (см. табл. 2.2). И конечно, ни в коем случае нельзя отождествлять степень окисления с действительным зарядом на атоме.
• Если в реакции происходит изменение степени окисления хотя бы одного из элементов, то такие реакции относятся к окислительно-восстановительным, в противном случае их относят к обменным взаимодействиям.
В процессе передачи электронов в окислительно-восстановительной реакции участвует два партнера: два вещества, или две частицы, или два атома внутри одной частицы.
• Вещество (частица, атом, элемент), отдающее электроны, называется восстановителем; вещество (частица, атом, элемент), принимающее электроны, называется окислителем.
Вот два простейших примера:
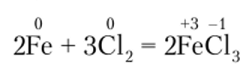
здесь железо — восстановитель, хлор — окислитель;
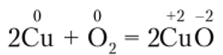
здесь медь — восстановитель, кислород — окислитель.
В этих реакциях металлы — это восстановители, их атомы отдают электроны, а неметаллы — окислители, их атомы принимают электроны.
В реакции 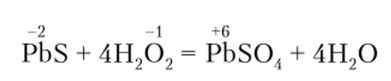
окислитель — пероксид водорода, а восстановитель — сульфид свинца. Хотя можно сказать и так: окислитель — кислород в пероксиде водорода, а восстановитель — сульфидный анион в сульфиде свинца, или сера в степени окисления -2.
В результате реакции восстановитель окисляется, а окислитель восстанавливается.
Восстановитель и окислитель могут входить в состав одной молекулы. Например, при нагревании диоксида азота азот в степени окисления +4.
окисляет кислород в степени окисления -2 до свободного, а сам восстанав;
+2.
ливается до N:

Восстановителем и окислителем может быть один и тот же элемент, если только он находится в промежуточной (не самой высокой и не самой низкой) степени окисления. Например, при растворении хлора в воде происходит реакция.
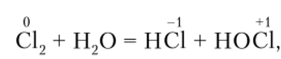
в которой один атом хлора выступает в роли окислителя, а другой — в роли восстановителя. Реакции такого типа называются реакциями диспропорционирования.
Как окислительно-восстановительные, так и все прочие реакции удобно объединить в несколько типов, основываясь на особенностях протекания реакций: образовании сложных веществ из более простых, разложении сложных веществ на простые и т. д. Во многих случаях они имеют специфические групповые названия. Наиболее важные из них вместе с характерными примерами приведены в табл. 9.1.
Таблица 9.1
Названия реакций.
Тип реакции. | Обменные. | Окислительно; восстановительные. |
Реакции соединения (присоединения). | СаО + Si09 = CaSiO, SO, + Н20 = H2S04 3NaF + A1F3 = Na3AlF6 | Mg + S = MgS AP + 502 = 2P2Or, Na202 + S02 = Na2S04 |
Реакции разложения. | CaC03 = CaO + C02 Cu (OH)2 = CuO + 1I20. | 2КСЮ, = 2 KCl + 302 H2S = H2 + S. |
Реакции замещения (вытеснения, обмена). | KCl + AgN03 = AgCl + KN03 NaOH + HBr = NaBr + H2(). | 2NaI + Cl2 = 2NaCl + I2 CuS04 + Zn = ZnS04 + Cu. |
В растворах окислительно-восстановительные реакции протекают, как правило, с участием растворителя и будут рассмотрены позже (см. гл. 16).
Окислительно-восстановительные реакции играют чрезвычайно важную роль в процессах жизнедеятельности — при фотосинтезе растений и при дыхании и питании животных; в технологических процессах — при сжигании топлива, при получении металлов, в подавляющем большинстве синтезов фармацевтических препаратов; при осуществлении любых электрохимических процессов; при приготовлении пищи и хранении продуктов и во многих других случаях.