Энергетика дыхания.
Физиология растений в 2 т. Том 1

Как известно, окислительно-восстановительный потенциал (редокспотенциал) Eq характеризует сродство молекулы переносчика к электронам. В начале цепи расположен ЫАДН, гак как его редокс-потенциал -0,32 В, что указывает на его сильно выраженную способность отдавать электроны. Окислительно-восстановительный потенциал кислорода воздуха +0,82 В, что означает тенденцию к принятию электронов, поэтому… Читать ещё >
Энергетика дыхания. Физиология растений в 2 т. Том 1 (реферат, курсовая, диплом, контрольная)
Дыхательная цепь
В процессе распада органических веществ происходит синтез АТФ (субстратное фосфорилирование) и восстановление коферментов: НАД, ФАД и НАДФ (табл. 5.1). Сам распад дыхательного субстрата происходит без участия кислорода воздуха, хотя циклы Кребса, пеитозофосфатный и глиоксилатный осуществляются только в условиях достаточного снабжения клеток кислородом. Часть энергии, освободившейся при распаде дыхательного субстрата, запасается в макроэргических связях АТФ, но большая ее часть содержится в восстановленных коферментах. Восстановленные коферменты могут: 1) окисляться с образованием воды и одновременным синтезом АТФ или 2) служить донорами водорода для восстановительных процессов, протекающих в клетках.
Таблица 5.1
Количество молекул АТФ и восстановленных коферментов, возникших при распаде дыхательного субстрата в разных циклах.
Процесс окисления дыхательного субстрата | АТФ | НАДН | фадн2 | НАДФН |
Гликолиз | ||||
ЦТК | ||||
ПФЦ окислительный | — | |||
Глиоксилатный цикл |
Для окисления восстановленных коферментов используется атмосферный кислород. Окисление восстановленных коферментов с помощью кислорода воздуха — это последний этап дыхания. Он происходит в результате потери водорода (дегидрирования) восстановленными коферментами, причем атомы водорода, прежде всего, расщепляются на электроны и протоны: Н —> Н+ + ё; протон Н+ переходит в межмембранное пространство митохондрии, а электрон передается с помощью специальных переносчиков кислороду воздуха, который вместе с протоном из матрикса митохондрии образует молекулу воды:
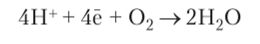
Переносчиками являются ферменты — пиридиновые и флавиновые дегидрогеназы, коферментами которых соответственно служат НАД или НАДО, ФАД или ФМН, а также железо-серные белки, убихинон (коэнзим Q) и цитохромы.
Переносчики могут находиться в восстановленном или окисленном состоянии, они попеременно являются то донорами, то акцепторами электронов. Кислород — конечный акцептор электронов. В этом и состоит его роль в дыхании.
НАД (Н) и НАДФ (Н) являются коферментами НАД (Ф)-зависимых дегидрогеназ, которые катализируют реакции, связанные с отнятием или присоединением двух атомов водорода, при этом коферменгы переносят гидрид-ион (Н: = 2ё + Н+), а недостающий протон захватывают из водной фазы или отдают в водную фазу. Большая часть НАД (Н) и НАДФ (Н) растворена в водной фазе, так как их связи с ферментами непрочные и возникают только в момент ферментативной реакции.
Флавопротеиды — белки, содержащие в качестве простатической группы ФМН и ФАД. Их окисление или восстановление связано с переносом двух атомов водорода.
Убихинон, или кофермент Q, — самый простой переносчик электронов. Это небольшая гидрофобная молекула, растворенная в липидном бислое мембраны. Убихинон состоит из ароматического кольца с двумя присоединенными к нему атомами кислорода и боковой липофильной цепи, в составе которой может содержаться 10 изоиреноидных остатков. Она может находиться в трех состояниях: окисленном, полувосстановленном и восстановленном (рис. 5.6). В окисленном состоянии оба атома кислорода соединены с кольцом двойными связями. В полностью восстановленном состоянии к каждому атому кислорода присоединяется атом водорода (гидрохиноновая форма), в полувосстановленном — атом водорода присоединяется только к одному атому кислорода (иолухиноновая, или семихиноновая, форма).
Итак, убихинон может принять или отдать как один, так и два электрона и временно захватить из окружающей водной среды протон при переносе каждого электрона. Когда он отдает электрон другому переносчику, протон освобождается. Свободно передвигаясь в мембране, убихиноны соединяют белковые комплексы и могут переносить два протона через мембрану при работе ЭТЦ.
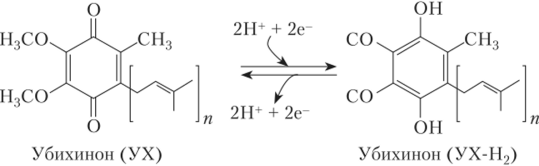
Рис. 5.6. Структура окисленной и восстановленной форм убихинона:
п = 9 или 10 у высших растений.
Цитохромы — одноэлектронные переносчики (см. подпараграф 4.4.1). В дыхании участвует несколько цитохромов, различающихся по природе гема и обозначаемых как цитохром а, цитохром а3, цитохром Ь, цитохром с, цитохром Су Атом железа, присоединяя электрон, переходит из окисной формы (Fe3+) в закисную (Fe2+), а теряя его, опять окисляется. Непосредственно с кислородом воздуха взаимодействует только цитохромоксидаза.
Цитохромоксидазой, или терминальной оксидазой, называется комплекс цитохромов а/а3. Стандартные Eq цитохромов варьируют от 0,0 до +0,6 В.
Убихинон и цитохром с, быстро перемещаясь в результате диффузии в межмембранном пространстве, могут, как челноки, переносить электроны от одного ферментного комплекса к другому.
Еще одну важную группу переносчиков образуют железо-серные белки, в молекулах которых два или четыре атома железа связаны с таким же числом атомов серы и с радикалами цистеина, образуя железо-серный центр белка (см. рис. 4.8). Каждый из центров способен передавать только один электрон. Значение Ео колеблется от -0,42 В до +0,35 В.
Переносчики образуют электронтранспортную, или дыхательную, цепь (ЭТЦ) (рис. 5.7). ЭТЦ дыхания, как и фотосинтеза, — это белковые комплексы, в состав которых, кроме белков-переносчиков, входят также трансмембранные белки, закрепляющие весь комплекс во внутренней мембране митохондрий.
Последовательность расположения переносчиков в цепи впервые была определена Б. Чансом в 50-х гг. XX в. Она зависит от величины их окислительно-восстановительных потенциалов и показана в следующей схеме:

В дыхательной цепи перенос электронов от НАДН (Eq = -0,32 В) на 02(Ец= +0,82 В) идет по цепи переносчиков, т. е. от соединений с более отрицательным редокс-потенциалом к соединениям с более положительным.
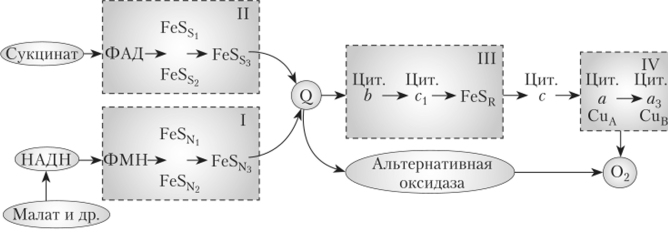
Рис. 5.7. Электронгрансноргная (дыхательная) цепь1.
Как известно, окислительно-восстановительный потенциал (редокспотенциал) Eq характеризует сродство молекулы переносчика к электронам. В начале цепи расположен ЫАДН, гак как его редокс-потенциал -0,32 В, что указывает на его сильно выраженную способность отдавать электроны. Окислительно-восстановительный потенциал кислорода воздуха +0,82 В, что означает тенденцию к принятию электронов, поэтому он является их конечным акцептором. Остальные переносчики располагаются между НАДН и кислородом в порядке последовательного повышения положительного потенциала. Итак, величина редокс-потенциала увеличивается в дыхательной цепи от одного переносчика к другому.
Каждый компонент должен располагаться в цепи гак, чтобы он мог принять электрон и передать его следующему. Следовательно, необходимы упорядоченность и плотная упаковка молекул в мембране. Нарушение в любой точке электронтранснортной цепи полностью блокирует весь транспорт электронов. Движущей силой транспорта электронов является разность окислительно-восстановительных потенциалов между НАДН и кислородом воздуха.
Дыхательная цепь образует четыре трансмембранных белковых комплекса. Каждый комплекс состоит из многих субъединиц белка, часть которых кодируется митохондриальной ДНК, а часть — ядерным геномом. Их простетические группы формируют цепь переноса электронов. Связь между комплексами осуществляют подвижные переносчики — убихинон и цитохром с. Компоненты цепи могут функционировать как двухэлектронные (флавопротеиды и убихинон) и одноэлектронные (цитохромы и Fe-S-белки) переносчики (см. рис. 5.7). В одной митохондрии могут располагаться до 20 тыс. таких электронтранспортных цепей.
Комплекс I — НАДН-дегидрогеназный комплекс, самый большой, содержит более 22 полипептидных цепей, а также флавинмононуклеотид (ФМН) и 6—7 железо-серных центров (FeSN) .). Комплекс имеет форму латинской буквы L. Одна часть комплекса погружена в мембрану (мембранная часть), а другая выступает в матрикс (периферическая часть). Периферическая часть содержит сайт связывания НАДН, а мембранная часть — сайт связывания убихииона. В этом комплексе НАДН, образованный в цикле.
1 Цит. по: Полевой В. В. Физиология растений. М.: Высшая школа, 1989. С. 155.
трикарбоновых кислот в матриксе митохондрии, окисляется. Окисление НАДН сопровождается переносом 2ё на убихииои. Принимая 2ё, убихинон Q захватывает 2Н+ из матрикса и переходит в восстановленную форму QH2. На каждый окисленный НАДН и восстановленный убихинон через мембрану из матрикса в межмембранное пространство переносится как минимум четыре протона, а на внутренней мембране генерируется Дрн+.
Наряду с комплексом I, дыхательная цепь содержит еще четыре дополнительных НАД (Ф) Н-дегидрогеназы. Они расположены во внутренней митохондриальной мембране так, что могут окислять НАДН и НАДФН, но обе стороны мембраны, сбрасывая электроны на пул убихинона в обход комплекса I. Они могут окислять также и цитозольный НАД (Ф) Н, проникающий в межмембранное пространство из цитозоля через поры в наружной мембране митохондрии (рис. 5.8).
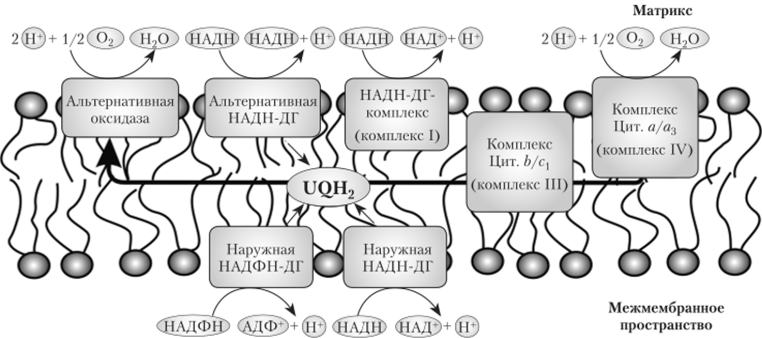
Рис. 5.8. Расположение на внутренней мембране митохондрии дегидрогеназ,.
передающих электроны на убихинон без сопряжения с транспортом протонов1
Комплекс II (молекулярная масса 125 кДа) содержит ФАД-зависимую сукцинат-убихинон-оксидоредуктазу и три железо-серных белка (FeSSj 3). Этот комплекс катализирует окисление сукцината и восстановление убихинона. Как известно из параграфа 5.1, входящая в комплекс сукцинатдегидрогеназа участвует в цикле трикарбоновых кислот; с ее помощью сукцинат (Eq = -0,025 В) превращается в фумарат, при этом электроны переносятся сначала на ФАД, потом через FeS-центры — на убихинон (Eq= +0,09 В), который восстанавливается. Образующиеся при окислении сукцината 2Н+ остаются в матриксе, поэтому генерации Дрн+ не происходит.
Убихинон восстанавливается НАДН-дегидрогеназой или сукцинатдегидрогеиазой и окисляется цитохром-бс!-комплексом, т. е. убихинон передает электроны от первого и второго комплексов третьему.
Электроны с ФАДН2 прямо включаются в дыхательную цепь. Таким образом, сукцинатдегидрогеназа — это общий компонент цикла трикарбоновых кислот и дыхательной цепи.
Комплекс III {цитохромб/Ci-комплекс) состоит из восьми разных полипептидных цепей и является димером. В состав комплекса входят цито;
1 Цит. с изм.: Хелдт Г.-В. Биохимия растений. С. 139.
хромы b, сх и железо-серный белок. Этот комплекс переносит электроны от восстановленного убихинона к цитохрому с (Eq= +0,25 В).
Цитохром с — небольшой водорастворимый белок. Он не входит в состав мембраны и располагается на обращенной к межмембранному пространству стороне внутренней мембраны митохондрии между комплексами III и IV. После получения электрона восстановленный цитохром с приобретает отрицательный заряд и, перемещаясь вдоль поверхности положительно заряженной внутренней мембраны диффузии, переносит электрон к комплексу IV. В присутствии убихинона он переносит через мембрану и протоны.
Комплекс IV (цитохромоксидазный комплекс) наиболее изучен. Это димер, состоящий из восьми полипептидных цепей. Каждый мономер содержит два цитохрома а и аЛ и два атома меди. Атом меди работает как одноэлектронный переносчик, изменяя свою валентность Cu2+ —" Си+. Этот комплекс получает электроны от цитохрома с и передает их кислороду воздуха, который восстанавливается до воды. Транспорт электронов через этот комплекс сопряжен с транспортом протонов через внутреннюю мембрану митохондрии в межмембранное пространство. Этот процесс ингибируется цианидом, азидом и СО.
Комплексы I, III и IV пересекают мембрану (рис. 5.9). Электроны переносятся последовательно от одного комплекса к другому и потом на кислород воздуха, имеющий наибольшее сродство к электронам. При переходе электрона от одного переносчика к другому освобождается энергия, количество которой прямо пропорционально разности между их редокс-потенциалами. Ферментные комплексы используют эту энергию для перекачивания протонов через внутреннюю мембрану митохондрии в межмембранное пространство. Следовательно, три комплекса цепи — I, III и IV — функционируют как протонные помпы.
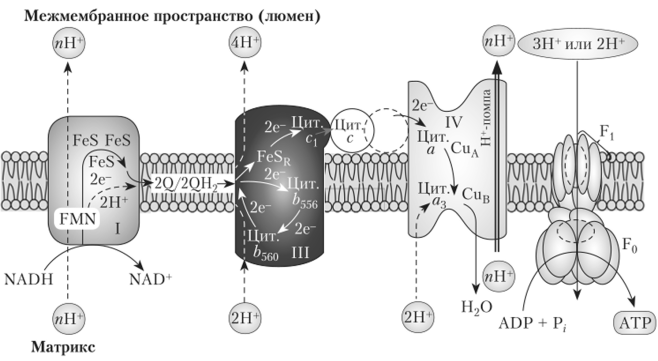
Рис. 5.9. Расположение дыхательной цепи во внутренней мембране митохондрии1.
1 Цит. с изм. по: Полевой В. В. Физиология растений. С. 156.
Трансмембранные белки, прочно закрепляющие комплекс во внутренней мембране митохондрии, ориентированы так, чтобы все протоны перемещались в одном направлении — из матрикса в межмембранное пространство. Специфическая ориентация в бислое свойственна всем мембранным белкам и очень важна для выполнения их функций.
Дальнейшие исследования дыхательной цепи показали, что комплексы I, III, IV, а также АТФаза и связанные с ними белки, соединяясь между собой, могут образовывать во внутренней мембране митохондрии несколько типов супенкомплексов, или респирасом (от лат. respirare и греч. soma — тело). Сами респирасомы формируют еще более крупные комплексы — мегакомплексы. В образовании и стабилизации респирасом участвуют специальные белки, например кардиолипид.
Значение образования суперкомплексов в настоящее время изучается. Предполагают, что респирасомы влияют на строение внутренней мембраны митохондрии (плотность упаковки молекул), ограничивают образование активных форм кислорода, регулируют пути транспорта электронов и синтез АТФ, в том числе и в неблагоприятных условиях (засуха, засоление).
Как работает дыхательная цепь? Образовавшийся в матриксе митохондрии в цикле Кребса НАДН диффундирует к внутренней мембране митохондрии и там окисляется в дыхательной цепи. Электроны передаются на 02, освобождаемая энергия используется для образования протонного градиента, который, в свою очередь, является движущей силой для синтеза АТФ.
НАДН — главный источник электронов, переносимых дыхательной цепью. Он входит в состав НАДН-дегидразного комплекса и располагается на внутренней стороне мембраны. Каждая молекула НАДН несет не просто атом водорода, а водородный атом плюс добавочный электрон (Н:, гидрид-ион). Из-за того что в матриксе митохондрии всегда есть свободные протоны, перенос гидрид-иона от НАДН эквивалентен (равносилен) переносу двух атомов водорода (Hr + Н+ —" Н2). Перенос электронов по дыхательной цепи начинается с отнятия гидрид-иона от НАДН. При этом образуется НАД+, а гидрид-ион превращается в протон и два электрона (Hr —> Н+ + 2ё). Два электрона и два протона (один от НАДН и один из матрикса митохондрии) передаются на ФМН первого комплекса. Протоны переносятся через мембрану в межмембранное пространство, а электроны передаются на железосерные центры, а затем — на две молекулы окисленного убихинона, последние присоединяют по одному протону, образуя семихиноны.
Семихинопы диффундируют к комплексу III. К этим семихинонам поступает еще пара электронов от цитохрома b комплекса III. Теперь семихиноны могут присоединить еще 2Н+ из матрикса митохондрии, и образуются две молекулы полностью восстановленного убихинона. Полностью восстановленный убихинон отдает 2ё цитохрому h и 2ё цитохрому с,. В результате освобождаются 4Н+, которые выходят в межмембранное пространство митохондрии. Окисленные молекулы убихинона диффундируют к комплексу I и могут опять принимать от него электроны и протоны. Эти превращения убихинона получили название Q-цикла (см. подпараграф 4.4.3).
Цитохром с, получив 2ё от цитохрома с у, передает их на цитохром а комплекса IV. Цитохром я3, связывая кислород, переносит на него эти электроны, в результате присоединяются 2Н+, и образуется вода. Цигохромоксидазный комплекс тоже способен переносить Н+ через мембрану.
Таким образом, во время транспорта каждой пары электронов от НАДН к ½ 02 в трех участках дыхательной цепи (комплекс I, III, IV) через внутреннюю мембрану митохондрии переносятся по крайней мере три пары протонов. Следовательно, дыхательная цепь работает как протонная помпа.
Поскольку редокс-потенциал ФАДН2 близок к О В, перенос двух электронов от него на убихинон в комплексе II не сопровождается переносом протонов. Поэтому во время транспорта электронов от ФАДН2 до кислорода через мембрану переносится только две пары протонов.
В растительных митохондриях есть НАДФ-зависимая дегидрогеназа. Если в дыхательную цепь включается НАДФН, то он окисляется, передавая водород на НАД+. Дальше транспорт электронов идет так же, как при окислении НАДН.
Цитохромы, железо-серные белки и атомы меди способны переносить одновременно только один электрон. Между гем каждая молекула НАДН отдает два электрона, а каждая молекула кислорода должна присоединить четыре электрона, чтобы образовалось две молекулы воды. Поэтому в дыхательной цепи имеется несколько электронсобирающих и электронраспределяющих участков, где согласовывается разница в числе электронов.
Итак, дыхательный субстрат и кислород воздуха не взаимодействуют непосредственно, между ними лежит дыхательная цепь, встроенная во внутреннюю мембрану митохондрии. Полная цепь состоит из 80 белковых молекул, две трети которых выполняют структурную роль и функцию сопряжения. Остальные являются переносчиками электронов и протонов. Реакции в ЭТЦ идут со скоростью 10~4—10^9 с.
Образующийся в цикле Кребса НАДН не только окисляется в дыхательной цепи, но и выносится в цитозоль, где используется как восстановитель в разных реакциях, например при восстановлении нитрата (см. параграф 6.4). Специального переносчика для НАДН не обнаружено, поэтому НАДН переносится из митохондрии в цитозоль с помощью челночного переносчика. В митохондриях, где содержится много НАДН, оксалоацетат за счет НАДН восстанавливается до малата; в мембране есть белок-переносчик, обменивающий малат на оксалоацетат. Оказавшись в цитозоле, малат может быть вновь окислен в обратной реакции с образованием НАДН. С помощью этого механизма из митохондрии выносится 25—50% НАДН, образованного в матриксе митохондрии.
В результате присоединения к кислороду электронов, передаваемых по дыхательной цепи, и протонов из матрикса митохондрии образуется вода.
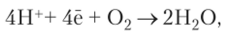
называемая метаболической. У таких растений, как суккуленты, выдерживающих засуху благодаря накоплению воды в тканях листьев, стеблей или корней, она играет важную роль в водном балансе организма. Сам механизм образования воды при взаимодействии связанной молекулы кислорода с четырьмя протонами в точности неизвестен.
Описанный путь транспорта электронов — главный, он получил название цитохромпого. Кроме него, в растениях существует еще другой путь.
переноса электронов — альтернативный, когда электроны от убихинона передаются на кислород воздуха с помощью альтернативной оксидазы; цитохромы не участвуют (см. рис. 5.5).
Альтернативная оксидаза (убихинон-кислород-оксидорсдуктаза) находится во внутренней мембране митохондрии и передает электроны с убихинона на кислород. Следовательно, она непосредственно восстанавливает 02 до Н20 за счет отнятия четырех электронов от двух молекул восстановленного убихинона:
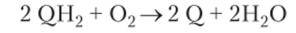
Таким образом, альтернативная оксидаза является второй терминальной оксидазой в дыхательной цепи.
Альтернативная оксидаза (АО) представляет собой полипептид с молекулярной массой 32 кДа. В структуре ее белка есть два остатка цистеина, при окислении которых образуется дисульфидный (серный) мостик, ковалентно связывающий две молекулы. При восстановлении фермента по дисульфидной связи его активность увеличивается в несколько раз.
Электронный транспорт с участием альтернативной оксидазы является сокращенным путем, он используется, когда пул убихинонов сильно восстановлен. Альтернативный путь дыхания имеет только один пункт сопряжения (комплекс I), поэтому большая часть энергии выделяется в виде тепла и не используется для синтеза АТФ.
Итак, с пула ()Н2 электроны могут транспортироваться по двум путям — цитохромному через комплексы III и IV или альтернативному.
Соотношение цитохромного и альтернативного дыхания зависит от физиологического состояния растения, этапа онтогенеза (см. гл. 8). Альтернативный путь транспорта электронов можно наблюдать при прорастании семян, старении листьев и цветков, формировании пыльцы. Климактерический подъем дыхания, например при созревании плодов, тоже связан с увеличением активности альтернативной оксидазы. В разных тканях она имеет разную активность.
В результате функционирования АО при цветении некоторых видов растений температура цветка резко повышается. Особенно высока ее активность у ароидных. Например, у аронника итальянского температура соцветия может достигать 51 °C при температуре воздуха 15 °C. Повышение температуры необходимо для испарения пахучих соединений, привлекающих насекомых-опылителей, и может поддерживаться от нескольких часов до нескольких дней. Повышение температуры сопровождается вспышкой дыхания.
Изучение именно этого явления привело к открытию альтернативной оксидазы, которая, как оказалось, имеется только в растительных митохондриях; у животных ее нет. Активность альтернативной оксидазы не подавляется цианидом, поэтому дыхание с се участием назвали цианидустойчивым.
Повышение температуры тканей, вызванное активацией АО, наблюдается у горных растений при пониженных ночных температурах. Временное увеличение альтернативного дыхания с выделением большого количества тепла вызывает таяние снега днем вокруг растений подснежников, благодаря чему создаются условия для быстрого цветения, опыления и оплодотворения цветков. Стрессы разной природы — засоление, засуха, ранение, внедрение патогена — также сопровождаются увеличением активности АО.
Вторая важная функция АО — препятствование накоплению супероксид-радикала и перекиси водорода (АФК) путем превращения их в воду.
Итак, функция дыхательной цепи — транспорт электронов от восстановленных коферментов к кислороду воздуха, сопровождающийся переносом протонов через внутреннюю мембрану митохондрии в межмембранное пространство.