Химическое равновесие в гетерогенных системах

К насыщенному раствору как к равновесной системе применим закон действующих масс. Если скорость растворения хг показывает число ионов Ва2+ и SO^-, уходящих за определенное время с поверхности твердой фазы в раствор, то скорость должна быть прямо пропорциональна числу этих ионов на единице поверхности. Однако при уменьшении общего количества твердой фазы (в процессе растворения) расположение ионов… Читать ещё >
Химическое равновесие в гетерогенных системах (реферат, курсовая, диплом, контрольная)
В аналитической химии реакции образования малорастворимых соединений широко применяются как в качественном, так и в количественном анализе.
Аналитическая классификация катионов основана на различной растворимости их сульфидов, фосфатов, гидроксидов. Более половины качественных реакций на обнаружение катионов и анионов сопровождается образованием труднорастворимых соединений. Реакции осаждения используют для разделения многокомпонентных смесей, удаления мешающих ионов.
В количественном анализе один из классических методов — гравиметрия — основан на выделении определяемого компонента в виде малорастворимого соединения. Реакции осаждения лежат в основе и другого метода — осадительного титрования.
Чтобы обеспечить минимальную погрешность анализа, необходимо хорошо знать условия образования и растворения осадков, применимость закона действующих масс к равновесиям в гетерогенных системах.
Произведение растворимости малорастворимого сильного электролита
В предыдущей главе закон действующих масс применен к гомогенным, т. е. однородным, системам. Рассмотрим гетерогенные (неоднородные) системы, например насыщенные растворы, соприкасающиеся с осадком того или иного вещества. Насыщенный раствор и осадок отделены друг от друга поверхностью раздела и являются фазами гетерогенной системы.
Выполняя такие важные аналитические операции, как осаждение или отделение ионов, промывание и растворение осадков, мы имеем дело с гетерогенными системами.
Возьмем малорастворимый электролит, например сульфат бария BaS04, и приведем его в соприкосновение с водой. Кристаллическая решетка BaS04 образована ионами Ва2+ и S04~, которые в процессе растворения под действием диполей воды переходят с поверхности кристаллов в раствор. Одновременно начинается и обратный процесс — осаждение BaS04:
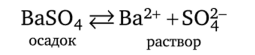
Постепенно скорость растворения вещества уменьшается, а скорость противоположного процесса — осаждения — увеличивается, что и приводит к состоянию динамического равновесия, при котором число ионов Ва2+ и SO^, уходящих в единицу времени с поверхности твердой фазы, равно числу ионов, возвращающихся на эту поверхность. Таким образом, получается насыщенный раствор сульфата бария.
Концентрация насыщенного раствора данного вещества при определенной температуре определяет растворимость этого вещества. Используют различные способы выражения растворимости, но наиболее широко — молярную растворимость вещества. Молярная растворимость s вещества — это количество растворенного вещества, содержащееся в одном литре его насыщенного раствора:

где т — масса растворенного вещества, г; М — молярная масса растворенного вещества, г/моль; V — объем насыщенного раствора, л.
Молярная растворимость вещества выражается в моль/л.
К насыщенному раствору как к равновесной системе применим закон действующих масс. Если скорость растворения хг показывает число ионов Ва2+ и SO^-, уходящих за определенное время с поверхности твердой фазы в раствор, то скорость должна быть прямо пропорциональна числу этих ионов на единице поверхности. Однако при уменьшении общего количества твердой фазы (в процессе растворения) расположение ионов на ее поверхности остается неизменным. Поэтому можно допустить, что скорость растворения твердой фазы остается постоянной и равной некоторой величине Кр

Скорость v2 противоположного процесса — осаждения — определяется числом столкновений ионов Ва2+ и SO^ с единицей поверхности кристаллов BaS04 за то же время. Очевидно, она будет тем больше, чем выше концентрация ионов Ва2+ и SO^_ в растворе. Согласно закону действующих масс.

где К2 — величина постоянная при неизменной температуре.
В насыщенном растворе скорости обоих процессов равны (vx = v2). Поэтому, объединяя уравнения (7.2) и (7.3), можно написать:
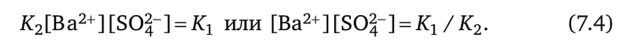
Отношение двух постоянных величин Кг / К2 — величина постоянная, которую принято обозначать ПР (или К°). Из уравнения (7.4) следует:
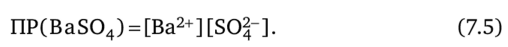
Величина ПР количественно характеризует растворимость малорастворимого электролита и называется произведением растворимости.
Произведение растворимости малорастворимого сильного электролита — величина, равная произведению равновесных концентраций ионов данного электролита в его насыщенном растворе в степенях, равных соответствующим стехиометрическим коэффициентам.
В общем случае малорастворимый электролит типа K"Am диссоциирует по уравнению.
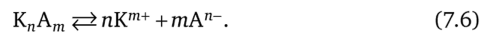
Произведение растворимости при этом можно выразить так:
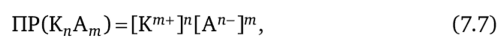
где [Кт+] и [Ап_] — равновесные концентрации катионов и анионов, образующихся при диссоциации электролита KnAm; пит — показатели степени, в которую необходимо возвести концентрации соответствующих ионов. Например: ПР (Са3(Р04)2) =[Са2+]3[РО^"]2.
Как бы ни изменялись концентрации отдельных ионов в насыщенном растворе малорастворимого электролита, произведение их (при неизменной температуре) остается постоянной величиной.
Произведение растворимости — константа фазового равновесия малорастворимого электролита в его насыщенном растворе (символ ПР, единица — моль^п +т) • л_(4 +п4).
Численные величины ПР некоторых малорастворимых электролитов приводятся в приложении А, 6А. Для точного вычисления произведений растворимости следует пользоваться показателями не равновесных концентраций ионов малорастворимого электролита, а их активности, так как в растворах электролитов действуют межионные силы взаимодействия. Если учитывать эти силы, то выражение ПР для того же сульфата бария приобретает иной вид:
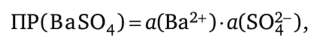
или с применением коэффициентов активности ионов: 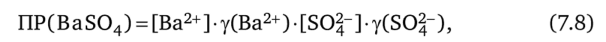
где а (Ва2+) и aCSO^-) — значения активности ионов Ва2+ и SO|~; у (Ва2+) и y (SOj-) — коэффициенты активности этих ионов.
Для малорастворимого электролита KnAm произведение растворимости, выраженное через активности ионов, имеет вид.

где ап — активность катионов, моль/л; ат — активность анионов, моль/л.
В насыщенных растворах малорастворимых электролитов концентрации ионов весьма незначительны, поэтому и силы межионного взаимодействия в них настолько слабы, что обычно ими можно пренебречь. На практике произведение растворимости электролита вычисляют, пользуясь только равновесными концентрациями ионов. Исключения составляют величины ПР относительно хорошо растворимых электролитов.
Зная растворимость электролита, легко вычислить его ПР, и наоборот.
Пример 1.
Растворимость сульфата бария при 25 °C равна 0,245 г/л. Вычислите nP (BaS04).
Решение. Молярная масса BaS04 составляет 233,4 г/моль. Молярная растворимость 5(BaS04) = 0,245 / 233,4 = 0,105 = 1,05 • 105 моль/л. Диссоциируя, 1 моль BaS04 образует 1 моль ионов Ва2+ и 1 моль ионов SO|-, следовательно, концентрации этих ионов в насыщенном растворе должны быть одинаковыми, т. е. [Ва2+] = [SO2-] = 1,05−10-5 моль/л.
По уравнению (7.5) находим значение произведения растворимости сульфата бария: nP (BaS04) = 1,05−10-5 1,05Ю-5 =1,1-Ю-10 моль2 -л-2.
При вычислении произведения растворимости сравнительно хорошо растворимых электролитов нельзя пренебрегать силами межионного взаимодействия, необходимо учитывать коэффициенты активности ионов. Вычисляя произведение растворимости достаточно хорошо растворимого электролита, обязательно учитывают ионную силу раствора.
Пример 2.
Растворимость сульфата кальция при 20 °C равна 2 г/л. Вычислите nP (CaS04).
Решение. Сначала вычисляем молярную растворимость 5 (концентрацию насыщенного раствора) CaS04; зная, что молярная масса сульфата кальция равна 136 г/ моль, используем уравнение (5.1): s (CaS04) = 2 /136 = 1,5 • 102 моль/л.
Поскольку при диссоциации каждый моль CaS04 образует 1 моль ионов Са2+ и 1 моль ионов SO|~, то [Са2+]= [SO^] = 1,510″2 моль/л. Зная концентрацию ионов, вычисляем ионную силу раствора см. (4.10): 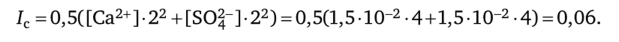
Находим значения коэффициентов активности (см. приложение А, 4А) для двухзарядных ионов в растворе с ионной силой 0,06: у (Са2+) = 0,42, y (S04-) = 0,42. Зная концентрацию ионов и их коэффициенты активности, вычисляют произведение растворимости сульфата кальция: 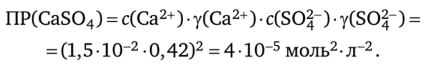
Вычисленное значение nP (CaS04) отличается от найденного опытным путем, которое равно 6,1 • 10~5, так как действительные величины коэффициентов активности Са2+ и SO^ немного отличаются от средних значений, приведенных в приложении.
Пример 3.
Вычислите растворимость гидроксида магния при 25 °C, если nP (Mg (OH)2) = = 2 • 10″и моль3 • л-3.
Решение. В насыщенном растворе гидроксида магния устанавливается равновесие:
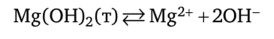
Произведение растворимости гидроксида магния имеет вид: nP (Mg (OH)2) = = [Mg2+] • [ОН-]2.
Равновесная концентрация ионов магния равна растворимости s: [Mg2+] = s; равновесная концентрация ионов [ОН-] в 2 раза больше: [ОН-] = 2s. Следовательно, выражение произведения растворимости можно выразить в виде: nP (Mg (OH)2) = [s][2s]2 = 4s3.
Из этого выражения вычисляем растворимость:
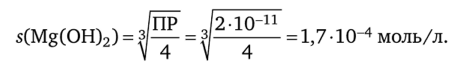
Проверяем полученное значение растворимости гидроксида магния, вычислив произведение растворимости.
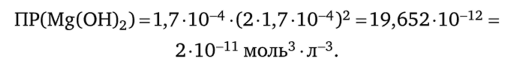
Расчет совпадает с фактическим значением ПР.
Произведение растворимости, выраженное через молярные концентрации ионов, — размерная величина, поскольку размерна молярная концентрация. Однако обычно, приводя числовые значения произведения растворимости, единицы измерения для краткости записи не указывают.
Произведение растворимости зависит от тех же факторов, что и растворимость: от природы электролита, температуры, природы растворителя, присутствия других электролитов в растворе.