Крахмал как индикатор иодометрического титрования

Стандартизация раствора иода по тиосульфату натрия. Чистую бюретку ополаскивают раствором тиосульфата и готовят ее к титрованию. Пипетку промывают раствором иода, переносят в коническую колбу 10,00 мл раствора иода и титруют его раствором тиосульфата натрия. Когда бурая окраска жидкости сменится соломенно-желтой, прибавляют 2 мл крахмала и продолжают титровать. Появившееся синее окрашивание… Читать ещё >
Крахмал как индикатор иодометрического титрования (реферат, курсовая, диплом, контрольная)
Крахмал не растворяется в воде. Однако нагреванием его суспензии до кипения удается получить коллоидную систему, которую и используют в иодометрии. Чувствительность крахмала к водному раствору иода довольно велика, но она еще более увеличивается в присутствии иодида калия. Поэтому считают, что крахмал образует адсорбционное соединение синего цвета в присутствии полииодид-иона [I3]-. С повышением температуры чувствительность иод-крахмальной реакции сильно снижается. Как отмечалось ранее, крахмал добавляют к раствору в конце титрования, когда почти весь иод оттитрован. Объясняется это тем, что крахмал медленно отдает адсорбированный иод и частично сам восстанавливает некоторые окислители. При титровании же восстановителей, например хлорида железа (II), раствором иода крахмал приливают с самого начала.
Приготовление вторичного стандартного раствора тиосульфата натрия
Получить стандартный раствор Na2S203-5H20 растворением точной навески невозможно, так как кристаллы его выветриваются на воздухе. Поэтому сначала готовят раствор с приблизительной концентрацией, а затем стандартизируют его по выбранному окислителю.
Приготовление 100 мл приблизительно 0,05 н. раствора тиосульфата натрия. Молярную массу эквивалентов Na2S203-5H20 определяют с учетом его реакции с иодом (см. п. 20.9.1), в которой каждая молекула тиосульфата теряет один электрон. Следовательно, молярная масса эквивалентов Na2S203-5H20 равна его молярной массе, т. е. 248,21 г/ моль. Для приготовления 0,1 л приблизительно 0,05 н. раствора требуется 248,21 • 0,05 • 0,1 = 1,241 г тиосульфата натрия. На технохимических весах берут навеску тиосульфата натрия (около 1,2—1,3 г) и переносят ее в мерную колбу вместимостью 100 мл. В водных растворах тиосульфат разлагается под действием кислорода воздуха и угольной кислоты:
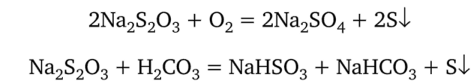
Особенно интенсивно идет разложение его на солнечном свету и в присутствии микроорганизмов, поэтому растворяют навеску в свежепрокипяченной и охлажденной дистиллированной воде. Для большей устойчивости титра добавляют к раствору 0,1 г карбоната натрия. Колбу с раствором закрывают пробкой и оборачивают черной бумагой для защиты от света. Чтобы титр тиосульфата натрия стабилизировался, оставляют раствор на несколько дней.
Стандартизация раствора тиосульфата натрия по перманганату калия. В коническую колбу переносят сначала 15 мл 10%-ного раствора иодида калия, затем 15 мл 20%-ного раствора серной кислоты и, наконец, точно (с помощью пипетки или бюретки) 10,00 мл стандартного раствора перманганата калия. В результате реакции выделяется свободный иод:
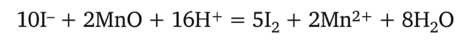
Накрыв колбу стеклом и защитив от прямых солнечных лучей, оставляют ее на 5 мин для завершения реакции. После этого разбавляют смесь 100 мл воды и медленно, при перемешивании, приливают из бюретки раствор тиосульфата натрия до перехода темно-бурой окраски жидкости в соломенно-желтую. Добившись этого, прибавляют 3 мл крахмала и продолжают титровать раствором тиосульфата. Когда окраска жидкости станет чисто-синей, осторожно прибавляют тиосульфат натрия, взбалтывая содержимое колбы после каждой прибавленной капли. Окраска крахмала должна обесцветиться от одной избыточной капли тиосульфата. Повторив титрование 2—3 раза, находят среднее из сходящихся отсчетов.
Приступая к вычислению, необходимо учитывать, что 1 моль эквивалентов КМп04 выделяет при реакции 1 моль эквивалентов 12 и на титрование последнего расходуется также 1 моль эквивалентов Na2S203. Таким образом, количества КМп04 и Na2S203 оказываются эквивалентными, хотя эти вещества непосредственно не реагируют друг с другом. Это позволяет сделать вычисление по уравнению сгУ2 = c2V2.
Пример На титрование 10,00 мл 0,5 181 и. раствора перманганата калия после выделения эквивалентного количества иода пошло в среднем 10,66 мл раствора тиосульфата натрия. Концентрация тиосульфата натрия равна: c3K(Na2S203) = = (10,00 • 0,5 181): 10,66 = 0,4 881 моль/л.
Приготовление вторичного стандартного раствора иода
Для иодометрического титрования восстановителей необходим стандартный раствор иода. Стандартизируют его по тиосульфату натрия.
Приготовление 100 мл приблизительно 0,05 н. раствора иода.
Взаимодействуя с Na2S203-5H20, каждая молекула 12 присоединяет два электрона, поэтому молярная масса эквивалентов иода составляет ½ молярной массы, т. е. 253,82: 2 = 126,91 г/моль. Для приготовления 0,1 л 0,05 н. раствора нужно взять 126,91 • 0,05 • 0,1 = 0,6346 г иода. Взвешивают на технохимических весах 0,65 г иода, переносят навеску в мерную колбу вместимостью 100 мл, приливают в нее 10 мл 25%-ного раствора иодида калия (в котором иод растворяется лучше, чем в воде) и доводят объем жидкости водой до метки. Тщательно перемешивают раствор.
Стандартизация раствора иода по тиосульфату натрия. Чистую бюретку ополаскивают раствором тиосульфата и готовят ее к титрованию. Пипетку промывают раствором иода, переносят в коническую колбу 10,00 мл раствора иода и титруют его раствором тиосульфата натрия. Когда бурая окраска жидкости сменится соломенно-желтой, прибавляют 2 мл крахмала и продолжают титровать. Появившееся синее окрашивание должно обесцветиться от одной избыточной капли тиосульфата. Повторяют титрование несколько раз, находят среднее из сходящихся отсчетов и вычисляют концентрацию раствора иода по формуле 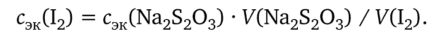
Пример Если на титрование 10,00 мл раствора иода пошло в среднем 9,70 мл 0,4 841 н. раствора тиосульфата натрия, то концентрация иода равна: сэк(12) = = (9,70 • 0,4 841): 10,00 = 0,4 696 моль/л.