Фазовое состояние углеводородов и режим пластов
С приближением температуры и давления к критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает, и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара будет непрерывно… Читать ещё >
Фазовое состояние углеводородов и режим пластов (реферат, курсовая, диплом, контрольная)
В процессе разработки месторождений в пластах непрерывно изменяются давление, температура, количественное соотношение нефти и газа. Это сопровождается непрерывным изменением состава газовой и жидкой фаз и переходом различных углеводородов из одной фазы в другую. Особенно быстро такие превращения происходят при движении нефти по стволу скважины от забоя к устью.
Дальнейшее движение нефти и газа к потребителю также сопровождается непрерывными фазовыми превращениями. Закономерности фазовых переходов и фазовое состояние газонефтяных смесей при различных условиях необходимо знать для решения многих задач.
Интенсивность выделения газовой фазы из нефти зависит от многих факторов, основными из которых являются:
- — темп снижения давления и температуры при движении нефтяного потока;
- — наличие в составе нефти лёгких углеводородов (С2-С6);
- — молекулярная масса нефти;
- — вязкость нефти.
Схема фазовых превращений однокомпонентных систем.
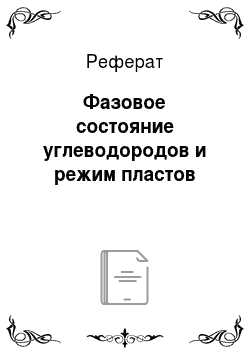
Углеводородные газы, подобно всем индивидуальным веществам, изменяют свой объём при изменении давления и температуры. На рис. 4.1 представлена диаграмма фазового состояния для чистого этана. Каждая из кривых соответствует фазовым изменениям при постоянной температуре и имеет три участка. Слева от пунктирной линии отрезок соответствует газовой фазе, горизонтальный участок — двухфазной газожидкостной области, левый участок — жидкой фазе. Отрезок пунктирной линии вправо от максимума в точке С называется кривой точек конденсации (или точек росы), а влево от максимума — кривой точек парообразования (кипения). В точке С пунктирной линии кривые парообразования и конденсации сливаются. Эта точка называется критической.
С приближением температуры и давления к критическим значениям свойства газовой и жидкой фаз становятся одинаковыми, поверхность раздела между ними исчезает, и плотности их уравниваются. Следовательно, с приближением к критической точке по кривой начала кипения плотность жидкой фазы будет непрерывно убывать. Если же к ней приближаться по линии точек конденсации, то плотность пара будет непрерывно возрастать.
Рис. слева. Диаграмма фазового состояния чистого этана. Для индивидуальных углеводородов граничным давлением между жидкой и газовой фазой является давление упругости паров (при данной температуре), при котором происходит конденсация или испарение. Обе фазы (жидкость и пар) при данной температуре присутствуют в системе только в том случае, если давление равно упругости насыщенного пара над жидкостью.
Фазовые превращения углеводородов можно также представить в координатах давление-температура рис. слева. Для однокомпонентной системы кривая давления насыщенного пара на графике давление-температура является одновременно кривой точек начала кипения и линией точек росы. При всех других давлениях и температурах вещество находится в однофазном состоянии.
Фазовая диаграмма индивидуальных углеводородов ограничивается критической точкой С рис. выше. Для однокомпонентных систем эта точка определяется наивысшими значениями давления и температуры, при которых ещё могут существовать две фазы одновременно.
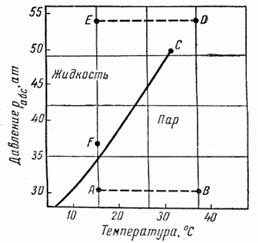
Диаграмма фазового состояния чистого этана в координатах Т-Р.
Из рисунка справа следует, что путём соответствующих изменений давления и температуры углеводороды можно перевести из парообразного состояния в жидкое, минуя двухфазную область. Газ, характеризующийся параметрами точки, А (рис. справа) можно изобарически нагреть до температуры точки В, а затем, повысив давление в системе при постоянной температуре, перевести вещество в область точки D, расположенную выше критической точки С, и далее в область точки Е. Свойства системы при этом изменяются непрерывно, и разделения углеводорода на фазы не произойдёт. При дальнейшем охлаждении системы (от точки D до точки Е), а затем при снижении давления до точки F вещество приобретёт свойства жидкости, минуя область двухфазного состояния.
Значительно сложнее закономерности фазовых переходов двухи многокомпонентных систем.
В смеси углеводородов каждый компонент имеет собственные значения упругости насыщенных паров, поэтому процессы конденсации и испарения не будут проходить при конкретных значениях давления и температуры, а в определённом диапазоне значений давления и температуры. Границы диапазона будут тем больше, чем больше разница между критическими значениями давления и температуры индивидуальных компонентов, входящих в систему. Более подробную информацию по фазовым переходам многокомпонентных систем можно найти в литературе [3, 4].
Фазовые переходы в нефти, воде и газе.
Фазовые переходы подчиняются определённым закономерностям, в основе которых лежит понятие равновесия фаз. Равновесие фаз характеризуется константой равновесия, которая зависит от температуры и давления.
Константа фазового равновесия i-го компонента характеризуется отношением мольной доли компонента в газовой фазе (уi или Nyi) к мольной доле этого компонента в жидкой фазе (хi или Nxi), находящейся в равновесном состоянии с газовой фазой:
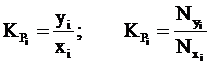
(1).
Для определения равновесного состояния газожидкостных смесей используются законы Дальтона и Рауля.
Согласно закону Дальтона каждый компонент, входящий в газовую фазу имеет своё парциальное давление Pi, а общее давление в газовой системе равно сумме парциальных давлений:
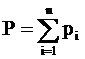
(2).
Согласно закону Рауля, парциальное давление компонента над жидкостью (нефтью) равно давлению насыщенного пара (Р нас. пара) или упругости пара (Qi) и этого компонента, умноженному на его мольную долю в нефти:

или.
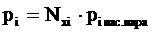
(3).
где Qi — упругость паров компонента;
Nxi — мольная доля компонента.
piнас. пара — давление насыщенного пара i-го компонента.
В момент равновесия парциальное давление i-го компонента в газовой фазе равно парциальному давлению компонента над жидкостью. Отсюда следует закон Дальтона-Рауля для равновесного состояния газовой и нефтяной фазы:
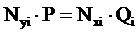
(4).
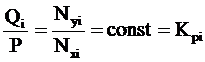
(5).
где Кi — константа равновесия i-го компонента при данной температуре и давлении смеси.
Уравнение материального баланса для одного моля нефтегазовой смеси:
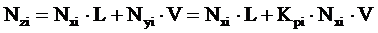
(6).
где L — мольная доля жидкой фазы;
V — мольная доля паровой фазы.
Nzi — мольные доли компонентов в нефтегазовой смеси.
По условию сумма мольной доли жидкой и паровой фаз равна единице. Отсюда:
V=1-L. (7).
Используя уравнения (6) и (7) получим выражение для мольной доли компонент жидкой фазы:
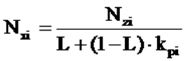
(8).
Или.
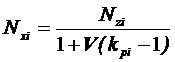
(9).
и для мольной доли компонента газовой фазы:
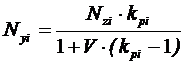
(10).
Фазовое состояние углеводородов и режим пластов. Различные пласты, залегающие сравнительно недалеко друг от друга по вертикали и имеющие сходные геолого-физические свойства, в ряде случаев бывает нецелесообразно объединять в один объект в результате различного фазового состояния пластовых углеводородов и режима пластов. Так, если в одном пласте имеется значительная газовая шапка, а другой разрабатывается при естественном упруговодонапорном режиме, то объединение их в один объект может оказаться нецелесообразным, так как для их разработки потребуются различные схемы расположения и числа скважин, а также различная технология извлечения нефти и газа.