Структура молекулы иммуноглобулина (на примере Ig G)
Ш неполные антитела — содержат один антиген-связывающий центр, функционально дефектны, могут связывать эпитопы антигенов, препятствуя контакту с ними полных антител, поэтому их также называют блокирующими антителами. Ш Идиотипические детерминанты (идиотипы) — структуры, характерные только для определенных Ig одного индивидуума, определяют специфичность взаимодействия данного иммуноглобулина… Читать ещё >
Структура молекулы иммуноглобулина (на примере Ig G) (реферат, курсовая, диплом, контрольная)
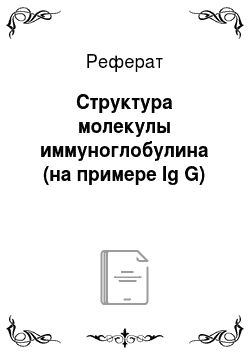
Молекула имеет форму Y или рогатки. Основной структурной единицей является мономер, представляющий собой 4-цепочечный полипептидный комплекс: 2 идентичные «легкие» цепи — L-цепи (Light — легкий) с молекулярной массой 25 000 дальтон (?212−220 аминокислотных остатков каждая) и 2 идентичные «тяжелые» цепи — H-цепи (Heavy — тяжелый) с молекулярной массой 50 000 дальтон (?550−660 аминокислотных остатков). Тяжелые и легкие цепи соединены между собой дисульфидными связями (мостиками), расположенными между их С-концами. Участки полипептидной цепи, обладающие сходной структурой называют доменами (?110 аминокислотных остатков каждый). В мономерной молекуле Ig всего 12 доменов: по 4 на тяжелых и по 2 — на легких цепях. Домены, имеющие постоянную аминокислотную последовательность называют константными (С-домены), домены, имеющие непостоянную последовательность называют вариабельными (V-домены). Первые домены составлены из вариабельных участков легких и тяжелых цепей, остальные — из константных. Молекулы Ig имеют участки, на которые избирательно действуют ферменты (папаин, пепсин), которые делят молекулу Ig в поперечном направлении на 3 фрагмента: 2 фрагмента идентичны и называются Fab-фрагментами (fragments antigen binding) — фрагменты, связывающие антигены. На концах Fab-фрагментов находятся активные центры антител — паратопы. Активные центры взаимодействуют с антигенными детерминантами, антигенсвязывающий центр комплементарен эпитопу антигена (принцип «ключ — замок» ).3-й фрагмент — Fc (fragments crystallizable) — кристаллический фрагмент (связывает и активирует комплемент, связывается с рецепторами на ИКК). В месте соединения Fab — и Fc-фрагментов расположена шарнирная область, позволяющая антигенсвязывающим фрагментам разворачиваться для более тесного контакта с антигеном.
Свойства антител:
- 1. Валентность — количество активных (антигенсвязывающих) центров антител.
- Ш полные антитела — как минимум 2-валентны, вызывают агрегацию антигенов, видимую невооруженным глазом;
- Ш неполные антитела — содержат один антиген-связывающий центр, функционально дефектны, могут связывать эпитопы антигенов, препятствуя контакту с ними полных антител, поэтому их также называют блокирующими антителами.
- 2. Аффинность — сродство антигенной детерминанты с активным центром антитела, определяется физико-химическими свойствами взаимодействующих
молекул и зависит от степени комплементарности структуры антигенсвязывающего центра и антигенной детерминанты.
3. Авидность — скорость и прочность связывания антитела с соответствующим антигеном, зависит от валентности и аффинности.
Иммуноглобулины сами обладают антигенными свойствами, что определяет их разнообразие.
Антигенная специфичность антител (молекулы Ig имеют 3 типа антигенных детерминант, по которым они делятся на изо-, алло — и идиотипы):
- Ш Изотипические детерминанты (изотипы) — структуры характерные для антител индивидуумов одного вида (по изотипам Ig делятся на 5 классов: м-мю, г-гамма, б-альфа, д-дельта, е-эпсилон).
- Ш Аллотипические детерминанты (аллотипы) — структуры, характерные для антител некоторых индивидуумов внутри вида, для других индивидуумов вида эта структура иммуногенна.
- Ш Идиотипические детерминанты (идиотипы) — структуры, характерные только для определенных Ig одного индивидуума, определяют специфичность взаимодействия данного иммуноглобулина с определенным антигеном.
В зависимости от структуры и свойств все Ig разделены на 5 классов. Ig G, E, D, сывороточный Ig A — мономеры, Ig M — пентамер (5 мономеров соединены J-цепью, joining — связанный), секреторный Ig A — димер.
иммуноглобулин антиген антитело антителогенез.