Разработка трепонемного антигенного суспензионного диагностикума для реакции агглютинации латекса

К латексам, используемым для приготовления диагностических препаратов, предъявляют достаточно высокие требования. У них должно отсутствовать неспецифическое связывание с клетками, они должны иметь активные функциональные группы для связывания биологических лиган-дов, быть монодисперсными и стабильными в физиологическом растворе. Кроме того, для расширения областей их биохимического применения… Читать ещё >
Разработка трепонемного антигенного суспензионного диагностикума для реакции агглютинации латекса (реферат, курсовая, диплом, контрольная)
Усиливающаяся в последние годы тенденция использовать в качестве носителей антигенов и антител инертные синтетические материалы привела к оживлению интереса к реакции агглютинации латекса (РАЛ) и широкому изучению возможностей её применения в диагностике. В качестве матриц для приготовления иммунореагентов применяли различные носители: полистироловые, поливинилтолуеновые, полиметакрилатные, полиакролеиновые. На различных моделях бактериальных, грибковых, паразитарных антигенов детально отработаны условия сенсибилизации латекса иммунобиологически активными субстратами, стабилизации суспензий сенсибилизированного латекса и стандартизации латексовых ди-агностикумов (Лукин Ю.В., Бахарев В. Н., Заиченко А. С. и др., 1985; Лукин Ю. В., Трифонов В. Д., Туркин С. И. и др., 1985; Ерохин Е. П., 1991; Юдицкая Н. М., 1991; Воробьева З. Г., Фокина Е. Н., 1992; Ковалева Л. Н., 1992; Базиков И. А., 2000; Касторная М. Н., 2003; Parks D., Braun W., Oi V., 1979; Kaplan M., Galef T, Bercovici T., 1983; Farchy C.T., Hunter T.F., Larsen S.A. et al., 1984; Margel S., Wiesel T., 1984; Cox D.L., Chang P., Mc Dovall A. M et al., 1992; Matsumoto M., Ishikawa F., Matsubayashi T. et al., 1993; Young H., Moyes A. et al., 1998 и др.).
По мнению Ю. В. Лукина (1986), метод латексной агглютинации с использованием окрашенных полиакролеиновых микросфер не уступает по чувствительности и наглядности методу гемагглютинации и иммунофер-ментному анализу. Химические свойства латексных микроносителей относительно постоянны и поддаются более легкой и точной характеристике по сравнению с поверхностными свойствами наружной мембраны эритроцитов, которые широко варьируют в зависимости от источника выделения. Поэтому латексные микроносители обеспечивают более воспроизводимые результаты по сравнению с эритроцитарными и могут с успехом их заменять в этом виде иммуноанализа.
К латексам, используемым для приготовления диагностических препаратов, предъявляют достаточно высокие требования. У них должно отсутствовать неспецифическое связывание с клетками, они должны иметь активные функциональные группы для связывания биологических лиган-дов, быть монодисперсными и стабильными в физиологическом растворе. Кроме того, для расширения областей их биохимического применения в такие латексные системы можно вводить специальные добавки (Rembaum A., Dreuer W., 1980). Преимущество полиакролеиновых систем перед другими микросферами обеспечивается наличием альдегидных групп на поверхности латексных частиц, легкообразующих ковалентную связь с аминогруппами белков, а также низкий уровень неспецифических взаимодействий с клеточными мембранами. В состав полиакролеинового латекса нет необходимости добавлять детергенты, так как однородность суспензии обеспечивается его природой (Воробьева З.Г., Фокина Е. Н., 1992).
В данном разделе работы изложена биотехнология приготовления трепонемного суспензионного латексного антигенного диагностикума для реакции агглютинации и дана оценка его диагностической ценности. Изготовление препарата осуществляли в соответствии с методикой, разработанной И. А. Базиковым (2000), в нашей модификации, используя в качестве полимерной матрицы акролар К, полученный из института биоорганической химии им. Шемякина. Гомогенные частицы латекса правильной сферической формы, окрашенные в розовый цвет, имели средний диаметр (1,2±0,1) мкм.
Лигандом служил комплексный антиген, полученный по разработанной нами биотехнологической схеме, состоящий из коммерческого ультраозвученного трепонемного антигена (УЗТА) для РСК производства ФГУП «Аллерген» (г.Ставрополь), подверженного специальной очистке, и цетавлонового супернатанта, представляющего собой поверхностные антигены трепонем, извлеченные нами по методике M.C.Blake, E.C.Gotschlich (1982), в соотношении 2:1. При производстве УЗТА используют штаммы культуральных бледных трепонем, которые относятся к трем иммунологическим группам по классификации Р. Р. Гельтцера и Л. В. Зебницкой (1950). Для извлечения антигена применяют водно-солевую экстракцию и ультразвуковую дезинтеграцию. Водно-солевые экстракты обладают наиболее сложным макромолекулярным составом, и в них обнаруживаются в тех или иных количествах все выявляемые у того или иного микроба антигены (Бельская Н.А., Митина В. С., Вейнблат В. И., 1970, 1972; Вейнблат В. И., Бельская Н. А., Митина В. С., 1971; Вейнблат В. И., Каминский В. В., Орлова Л. С., 1972; Вейнблат В. И., 1974; Афанасьев Е. Н., 1984, 2000; Тюменцева И. С., 1996 и др.). Механизм разрушения микробной клетки ультразвуковым дезинтегратором заключается в процессе образования и захлопывания кавитационных полостей, сопровождающихся чередованием высоких давлений и разрежений (Эльпинер И.Э., 1955, 1975; Гуревич Г. А. Кудрявцев Н.А., Фихте Б. А. и др., 1972). Под воздействием ультразвуковых волн прежде всего наступает разрушение клеток микробов, а действие ультразвука на химические вещества, находящиеся в клетках, проявляется гораздо медленнее, и это обеспечивает возможность получения различных активных комплексов микробной клетки в наименее измененном виде (Благовещенский В.А., Степанчук-Рудник Г. И., Жулина Л. В. и др., 1961). УЗТА, являясь поливалентным антигеном, состоит из протеинового, полисахаридного и липоидного антигенов (Овчинников, Н. М. Беднова В.М., Делекторский В. В., 1987).
В связи с тем, что УЗТА содержит в своем составе групповые антигены (его используют для удаления из исследуемых сывороток групповых антител, например, при постановке РИФ-абс), для повышения его специфичности мы подвергали этот антиген очистке по схеме, представленной на рисунке 10.
Этап иммуносорбции перекрестно-реагирующих антигенов T. pallidum из УЗТА проводили с помощью твердофазного полиакрила-мидного сорбента, полученного на основе иммуноглобулинов сыворотки донорской крови человека и специфических иммуноглобулинов, выделенных из гипериммунной кроличьей сыворотки против корпускулярного антигена, полученного из биомассы T. phagedenis (штамм Рейтера) (рисунок 11). Указанную сыворотку получали гипериммунизацией кроликов-продуцентов по схеме, представленной в таблице 8. Способ иммунизации заключался в следующем: животным трехкратно с интервалом в 7 дней в увеличивающихся дозах (5×109 м.к., 5×1010м.к., 5×1012 м. к' в 1 мл физиологического раствора) вводили 0,5 мл антигена внутривенно и одновременно в подколенные лимфоузлы, подушечки задних лап, подушечки передних лап (по 0,5 антигена с 0,5 мл полного адъюванта Фрейнда (ПАФ). В эти же сроки кроликам внутримышечно инъецировали по 0,5 мг иммунокоррек-тор — тималин. Через 7 дней после последнего введения антигена проводили тотальное кровопускание Иммуноглобулины из полученных сывороток крови выделяли с помощью ПЭГ-6000 по A. Polson, G.M.Potgieter, J.T.Largier et а1 (1964).
Приготовление твердофазного иммуносорбента и процесс сорбции проводили следующим образом. Иммуноглобулины инсолюбилизировали путем механического включения их в решетку полиакриламидного геля: в (9±0,1) мл Ig (на каждый вид иммуноглобулинов иммуносорбент готовили отдельно) растворяли (600±1) мг акриламида, (200±1) мг N, N1 — метилен-бисакриламида и 0,2 ТЕМЕД. К полученной смеси добавляли (5±0, 1) мг персульфата аммония, растворенного в (1±0, 05) мл Ig. Указанную операцию проводили при температуре (4±1) 0С, тщательно перемешивая.
Таблица 8. Схема иммунизации кроликов.
№№ инъекций. | Интервалы между инъекциями, сут. | Концентрация антигена, м.к. | Способ введения антигена. | Иммуномодуляторы. | ||||
в/в. | подколенные лимфоузлы. | подушечки передних лап. | подушечки задних лап. | Способ введения — в/м. | ||||
ПАФ, мл. | тималин, мг. | |||||||
; | 5х109 | ; | ; | 0,5. | ||||
5х1010 | ; | ; | 0,5. | |||||
5х1012 | ; | ; | 0,5. | |||||
тотальное кровопускание. |
Обозначения: м.к. — микробные клетки; в/в — внутривенно; в/м — внутримышечно ПАФ — полный адъювант Фрейнда полиакриламидного геля, соответствующие каждому Ig, измельчали, продавливая через фильеры, получая мелкие гранулы сорбента одинаковой величины. После этого сорбент промывали 10-кратным объемом раствора калия роданистого в концентрации 0, 3 моль/л путем центрифугирования при 3000−4000 g в течение 5 мин. Для удаления несвязавшегося белка и роданистого калия иммуносорбенты отмывали 10-кратным объемом забуфе-ренного 0, 9% раствора хлорида натрия путем центрифугирования при указанном режиме. Исчезновение ионов CNS определяли качественной реакцией 1% раствором треххлорного железа. Иммуносорбенты, смешанные в равных количествах, добавляли в УЗТА из расчета 10 мл сорбента на 20−40 мл антигена и инкубировали при температуре (37±1) 0С в течение 20 ч и при температуре 22 0С 4 ч. Антиген отделяли центрифугированием. Для повторного использования иммуносорбента проводили его регенерацию 3 М раствором роданистого калия или натрия, обеспечивающую диссоциацию комплекса «иммобилизованный антиген — антитело», с последующим отмыванием физиологическим раствором. Сорбент хранили при температуре плюс 4 0С с добавлением тимеросаля в концентрации 1:10 000. Такой сорбент, регенерируя, можно использовать до 20 раз.
Белковый компонент переосаждали (NH4)2SO4 до 80% насыщения и очищали на колонке с сефадексом G-100 с последующим элюированием 0, 1 М фосфатным буферным раствором. Белковый компонент очищенного антигена выходил одним пиком (рисунок 12). Фракции 8−21 собирали, концентрировали до 5 мг/мл белка с помощью ПЭГ- 6000 в диализной трубке «Visking».
Для извлечения поверхностных антигенов из культуральных бледных трепонем штаммов V, VI, VII, VIII IX и Рейтера применяли цетил-триметиламмонийбромид (цетавлон) — катионное поверхностно-активное вещество, обладающее не только экстрактивными, но и антисептическими свойствами, используя методику M.C.Blake, E.C.Gotschich (1982). Для комплексного трепонемного антигена (см. рисунок 10) использовали супернатант, который в отличие от осадка является наиболее специфическим антигенным полимерным комплексом, включающим липид, полисахарид в сочетании с протеинами и нуклеиновыми кислотами (Rossettim O.L., Arese N.L., Boschiroli M.L. et al., 1996).
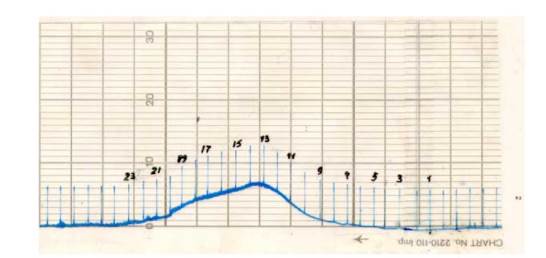
Рисунок 12. Хроматограмма очищенного УЗТА Примечание: колонка h — 650 мм, r — 12, 5 мм, V пробы — 5 мл, элюэнт 0, 1 М ФСБ, рН 7, 2.
Для получения качественного латексного диагностикума по биотехнологической схеме, представленной на рисунке 13, необходимо было подобрать эмпирическим путем оптимальные условия сенсибилизации матрицы.
При отработке концентрации лиганда в работу брали следующие дозы комплексного трепонемного антигена: 0,05 мг; 0,1 мг; 0,15 мг; 0,20 мг;
0,30 мг.
В процессе работы изучена зависимость взаимодействия лиганда с частицами латекса от экспозиции (1 ч, 1,5 ч, 3 ч, 5 ч). Для эффективной сенсибилизации латекса с антигеном необходима экспозиция, равная 3 ч, при постоянном перемешивании на магнитной мешалке. При изучении.
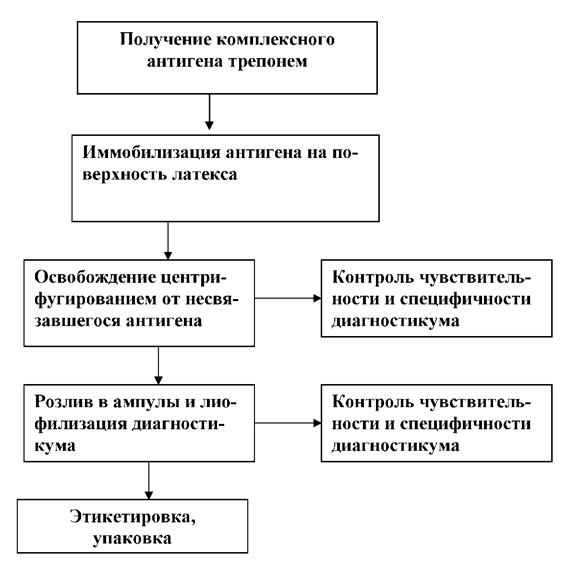
Рисунок 13. Принципиальная технологическая схема изготовления суспензионного трепонемного диагностикума для РАЛ роли температурного фактора, влияющего на связывание лиганда, мы использовали следующие параметры: 22 0, 37 0, 45 0. Установлено, что температура 22 0С является оптимальной для взаимодействия латекса с антигеном.
В процессе выполнения работы апробированы различные диапазоны рН среды: 4,0; 5,0; 6,0; 7,2, 7,4. Прочное связывание лиганда с матрицей происходит при рН 7,2.
Таким образом, нами отработаны оптимальные условия сенсибилизации латексных микросфер комплексным трепонемным антигеном: 0,20 мг лиганда соединяли с 2 мл 2% полимерного носителя. К смеси добавляли 2 мл 0,9% раствора натрия хлорида, рН 7,2. Сенсибилизацию проводили в течение 3 ч при температуре 22 0С на магнитной мешалке. Далее суспензию осаждали центрифугированием при 4000 g в течение 3−4 мин и дважды отмывали от несвязавшегося антигена.
Для стабилизации трепонемного полимерного латексного диагно-стикума мы использовали метод лиофилизации, который широко применяется для практических целей как наиболее надежный (Бланков Б.И., Клебанов Д. Л., 1961; Тинкер А. И., 1971; Голубев Л. Г., Сажин Б. Е., Валашек Е. Р., 1978; Мирошниченко А. И., Лопаткин О. Н., Жарникова И. В. 1987; Жарникова И. В. 2003,2004).
Процесс лиофилизации заключается в следующем: готовый препарат со стабилизирующей жидкостью (защитная среда) замораживается при температуре минус 40−700 С. После чего препарат помещают в сушильную камеру, где создается вакуум при помощи вакуумного насоса, при этом влага испаряется, минуя переход в жидкую фазу, непосредственно изо льда, в результате чего структура препарата не нарушается. При высушивании методом сублимации создаются условия, при которых вещество претерпевает минимальные биохимические изменения. Возможность денатурирования биологически активных веществ этим методом сводится к минимуму, благодаря тому, что замораживание блокирует растворение веществ. При высушивании под вакуумом скорость окислительных процессов значительно снижается в высушиваемом материале, а интенсивность процесса высушивания определяется разностью давлений пара над препаратом.
Примененяют различные среды высушивания, защищающие диагно-стикумы при замораживании и лиофилизации, обеспечивающие их мелкопористую плотную структуру и сохраняющие активность препаратов: са-харозо-декстрановые, сахарозо-поливинилпирролидоновые, лактозные, желатиновые и др. Защитные среды подразделяются на две группы: к первой группе относятся среды, в которых снижается интенсивность обезвоживания в период лиофилизации в связи с увеличением концентрации веществ. В эту группу входят: глутамат натрия, лактоза, сахароза. Ко второй группе относят среды, которые не изменяют скорость отдачи воды при высушивании. Этими свойствами обладает крахмал, декстран, желатин, поливинилпирролидон и другие. Но наилучшими средами считают среды, полученные при комбинировании веществ 1 и 2 групп.
Подготовку препарата к лиофилизации осуществляли следующим образом. Отмытый диагностикум суспендировали в половине первоначального объема стерильной защитной среды, в состав которой входили по 5 г желатины и сахарозы, растворённые в 100 мл дистиллированной воды. Препарат разливали в ампулы ШПВ-6 по 1 мл. Для замораживания использовали лиофильное устройство НС 700/50 «Frigera», ЧССР. Ампулы с ди-агностикумом выдерживали в морозильной камере при температуре минус (40±1)0С (19±1) ч. Лиофилизацию проводили на установке для сублимационной сушки ТГ-5 (ГДР).
Время режима сублимационного высушивания составляло (24 ± 2) часа, при котором температура конденсатора была доведена до минус 400 С. При рабочем давлении в сублимационной камере 35- 40 Па, когда температура препарата достигала 5−100 С, через 14- 16 часов включали подогрев и досушивали препарат до температуры 250 С, выдерживали при этой температуре 4−5 часов для достижения величины остаточной влажности 2- 4% (рисунок 14).
Ампулы запаивали на газокислородной горелке. Контроль качества препарата (растворимость, цветность, потеря в массе при высушивании, герметизация) осуществляли в соответствии с методиками, изложенными в ГФ СССР, XI изд., том 1 и МУК 4.¼.2.588−96.
При изучении чувствительности и специфичности диагностикума использовали два варианта постановки РАЛ: на стекле, как скрининг на сифилис (качественный тест), и титрование сывороток в микропланшетах (количественный тест). Для этого использовали 96-луночные микропланшеты для иммунологических реакций из полистирола отечественного и импортного производства.
Исследуемые сыворотки инактивировали на водяной бане (30±2) мин при температуре (56±1)0С. На обезжиренное стекло наносили сыворотки в следующих дозах — 0,04 мл; 0,02 мл; 0,01 мл и 0,03 мл — контроль сыворотки. К первым трем дозам сыворотки добавляли по одной капле диагностикума. К последней дозе сыворотки добавляли 0,03 мл 0,9% раствора натрия хлорида. Сыворотки осторожно смешивали с диагностикумом стеклянной палочкой, начиная с минимальной дозы сыворотки. Через 5 мин учитывали результаты реакций. При наличии в пробе специфических антител к трепоне-мам антиген взаимодействовал с ними, что приводило к агглютинации, которая становилась видимой, благодаря присутствию окрашенных латексных частиц (положительный результат). Реакция учитывалась невооружённым глазом или с помощью микроскопа (рисунок 15).
Результат выражался числом плюсов от 1 до 4 в зависимости от интенсивности микроагглютинации. Появление крупных агрегатов расценивали как положительный результат (4+; 3+), средней величины и мелкихкак слабоположительный результат (2+; В сомнительных случаях ориентировались на контроль — суспензия оставалась гомогенной — равномерное распределение латексных частиц.
Методика постановки РАЛ в планшетах заключалась в следующем: в каждую лунку вносили по 50 мкл раствора белкового стабилизатора, который специально готовили для постановки РАЛ. Технология его изготовления состояла в следующем: 25 мл белка куриного яйца смешивали на магнитной мешалке с 75 мл 1,6% раствора карбоната натрия до получения гомогенного раствора. Смесь фильтровали через 8 слоев марли, смоченной дистиллированной водой, помещали на водяную баню и выдерживали при периодическом помешивании 10−12 мин с момента закипания воды. Смесь охлаждали и нейтрализовали 1Н соляной кислотой до рН 7,07,2, фильтровали через 8 слоев марли, повторно выдерживали на кипящей водяной бане в течение 10−12 минут, разливали по 1 мл в ампулы и лио-фильно высушивали. Перед употреблением белковый стабилизатор разводили 1:100 забуференным физиологическим раствором, рН 7,2.
Анализируемый образец сыворотки вносили в первую лунку планшета и раститровывали шагом 1:2.В две последние лунки каждого ряда не вносили исследуемый материал. Они служили контролем оседания суспензии в растворе. Далее в каждую лунку планшета вносили по 1 капле диагностикума. Микропланшеты встряхивали до равномерного распределения суспензии и оставляли на столе при температуре 22 0С. Учет проводили через 3−6 часов. В случае положительной реакции суспензия ди-агностикума равномерно устилала дно лунки в виде «зонтика». При отрицательном результате реакции и в опыте, и в контроле — суспензия диаг-ностикума выпадала в виде «пуговки» или узкого кольца с ровным краем (рисунок 16).
По вышеописанной технологии нами изготовлено 10 серий диагно-стикума. Оценка их диагностической ценности проводилась на базе централизованной лаборатории Северо-Осетинского РКВД (акт о внедрении от 23.09.2004 г.). Для исследования были взяты сыворотки крови 416 стационарных больных до лечения и после лечения с различными диагнозами: сифилис первичный серопозитивный (Lues premaria seropositiva), сифилис вторичный свежий (Lues secundaria recens), сифилис вторичный рецидивный (Lues secundaria recidive), сифилис скрытый ранний (Lues latens prae-cox), сифилис скрытый поздний (Lues latens tarda), нейросифилис ранний (Neurosyphilis preacox) в сравнении с КСР (микрореакция преципитации, реакции Вассермана, ИФА, РНГА, РИФ). Контрольной группой служили сыворотки крови 167 лиц, свободных от сифилитической инфекции.
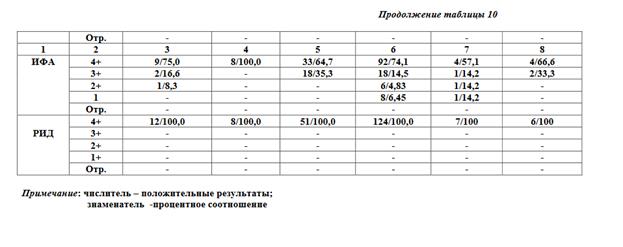
На основании проведенных испытаний установлено, что изготовленный по разработанной нами технологии трепонемный суспензионный антигенный диагностикум позволяет проводить реакцию агглютинации латекса по чувствительности, сопоставимую с такими трепонемными тестами, как РПГА, ИФА, РИФ, в то же время РАЛ превосходит реакции Вассермана и МР по этому показателю (таблицы 9,10). При сравнительном изучении специфичности РАЛ и МР (таблица 11) достоверно установлена его высокая специфичность.
Таким образом, простота постановки, демонстративность реакции, низкая стоимость анализа свидетельствуют о целесообразности его применения в практическом здравоохранении, особенно при проведении массовых обследований больных на сифилис.
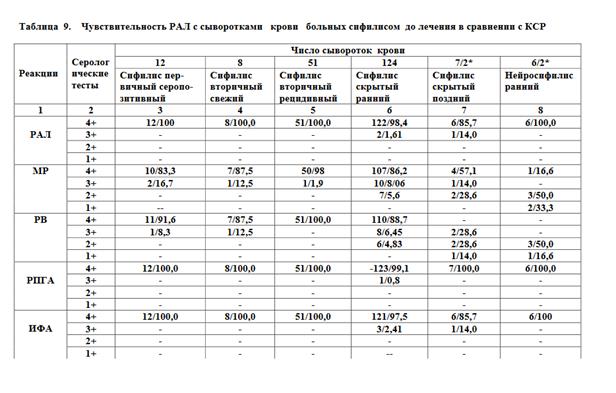

Примечание: числитель — положительные результаты; знаменатель — процентное соотношение; * знаменатель — отрицательные результаты в РВ.
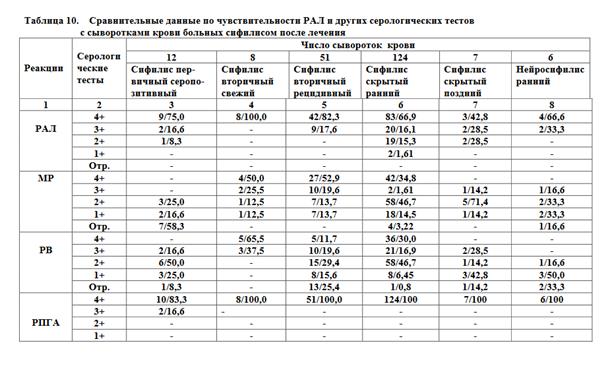
Примечание: числитель — положительные результаты; знаменательпроцентное соотношение.