Уравнение Нернста.
Основные понятия атомно-молекулярного учения

Если имеется электрод сравнения с точно известным потенциалом, то измеренная величина потенциала водородного электрода позволяет непосредственно вычислить величину pH. При 20 °C значение pH находят: Зависимость величины электродного потенциала (Е) от природы металла, активности его ионов в растворе и температуры выражается уравнением Нернста ЕМе = ЕоМе + RTln (aМеn+)/nF,. Например, для цинкового… Читать ещё >
Уравнение Нернста. Основные понятия атомно-молекулярного учения (реферат, курсовая, диплом, контрольная)
Нернст изучал поведение электролитов при пропускании электрического тока и открыл закон (уравнение Нернста). Закон устанавливает зависимость между электродвижущей силой (разностью потенциалов) и ионной концентрацией. Уравнение Нернста позволяет предсказать максимальный рабочий потенциал, который может быть получен в результате электрохимического взаимодействия когда известны давление и температура. Этот закон связывает термодинамику с электрохимической теорией касающихся сильно разбавленных растворов.

R — универсаьная газовая постоянная (8.31 Дж/(моль*К) Т — абсолютная температура.
F — число Фарадея (96 485.35 Кл/моль).
n — число молей электронов, которе участвуют в процессе.
Ox и Red — активности окисленной и восстановленной форм вещества Для потенциометрического определения pH в почвенных вытяжках, суспензиях, растворах, а также в биологических средах и других объектах пригодны любые индикаторные электроды, потенциал которых прямо или косвенно зависит от активности водородных ионов или является функцией величины pH: е = f (pH). Вместе с тем электрод должен быть достаточно селективен, т. е. на его потенциал не должны заметно влиять другие компоненты изучаемой системы. Наибольшее практическое значение имеют в этом отношении водородный, хингидронный и стеклянный электроды. Благодаря развитию потенциометрической техники определение pH со стеклянным электродом стало основным методом в агрохимических и других исследованиях. Хингидронный электрод употребляют лишь при отсутствии ламповых потенциометров. Водородный электрод редко применяется для непосредственных аналитических целей, но он остается основным стандартным электродом.
Водородный электрод (рис. 1, А). Потенциал водородного электрода обусловлен реакцией:
H2? 2Н+ + 2 е;
величина его может быть выражена уравнением е = -2,303RT/nF pH или, при 20 °C, е = -0,0581рН.
Потенциал нормального водородного электрода принимается равным нулю при любых температурах, а его величина лежит в основе шкалы электродных потенциалов.
Если имеется электрод сравнения с точно известным потенциалом, то измеренная величина потенциала водородного электрода позволяет непосредственно вычислить величину pH. При 20 °C значение pH находят:
рН = э.д.с. — еср / 0,0581,.
где э.д.с. — электродвижущая сила элемента, состоящего из электрода сравнения с потенциалом еср, и водородного электрода.
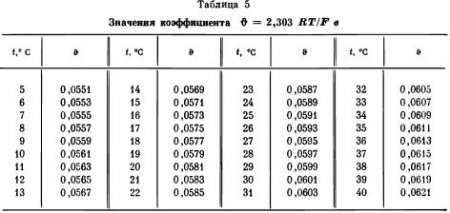
Коэффициент 2,303 RT/nF, входящий в вышеприведенное уравнение, является коэффициентом уравнения Нернста и используется во всех аналогичных формулах. Его величина при различных температурах приведена в табл. 5.
Для приготовления водородного электрода берут гладкую платиновую проволоку или пластинку, впаянные в стеклянные трубки. Поверхность платины тщательно очищают и промывают горячим раствором хромовой смеси, а затем дистиллированной водой. Промытый водой электрод оставляют в чистой дистиллированной воде на ночь. Затем приступают к платинированию электрода. С этой целью в 100 мл воды растворяют 2—3 г PtCl4 и 0,02 г (CH3COO)2Pb. В этот раствор пускают подлежащий платинированию электрод и соединяют его с отрицательным полюсом аккумулятора на 2—4 в. Анодом служит также платиновая пластинка или проволока. Через раствор пропускают ток, регулируя его силу таким образом, чтобы на аноде непрерывно, но не слишком быстро, выделялись пузырьки газа. Через 4—6 мин. поверхность электрода покрывается ровным бархатисто-черным слоем губчатой платины. Платинированный электрод промывают дистиллированной водой и снова подвергают катодной поляризации, но уже в 0,05 н. H2SO4, чтобы удалить адсорбированные ионы Cl. Готовый электрод тщательно промывают дистиллированной водой и хранят погруженным в воду (рис. 1).
Располагая металлы в порядке возрастания их стандартных электродных потенциалов, получают ряд напряжений Николая Николаевича Бекетова (1827−1911), или ряд стандартных электродных потенциалов. Числовые значения стандартных электродных потенциалов для ряда технически важных металлов приведены в таблице.

Ряд напряжений характеризует некоторые свойства металлов:
- 1. Чем меньшее значение имеет электродный потенциал металла, тем он химически активнее, легче окисляется и труднее восстанавливается из своих ионов. Активные металлы в природе существуют только в виде соединений Na, K, …, встречаются в природе, как в виде соединений, так и в свободном состоянии Cu, Ag, Hg; Au, Pt — только в свободном состоянии;
- 2. Металлы, имеющие более отрицательный электродный потенциал, чем магний, вытесняют водород из воды;
- 3. Металлы, стоящие в ряду напряжений до водорода, вытесняют водород из растворов разбавленных кислот (анионы которых не проявляют окислительных свойств);
- 4. Каждый металл ряда, не разлагающий воду, вытесняет металлы, имеющие более положительные значения электродных потенциалов из растворов их солей;
- 5. Чем больше отличаются металлы значениями электродных потенциалов, тем большее значение э.д.с. будет иметь построенный из них гальванический элемент.
Зависимость величины электродного потенциала (Е) от природы металла, активности его ионов в растворе и температуры выражается уравнением Нернста ЕМе = ЕоМе + RTln (aМеn+)/nF,.
где ЕоМе — стандартный электродный потенциал металла, aMen+ - активность ионов металла в растворе. При стандартной температуре 25 оС, для разбавленных растворов заменяя активность (а) концентрацией ©, натуральный логарифм десятичным и подставляя значения R, T и F, получим ЕМе = ЕоМе + (0,059/n)lgс.
Например, для цинкового электрода, помещенного в раствор своей соли, концентрацию гидратированных ионов Zn2+Ч mH2O сокращенно обозначим Zn2+, тогда ЕZn = ЕоZn + (0,059/n) lg[ Zn2+].
Если [Zn2+] = 1 моль/дм3, то ЕZn = Е оZn.