Биологические свойства сальмонелл

Ввиду сходства бактерий рода Salmonella с другими микроорганизмами семейства Enterobacteriaceae возникает необходимость их дифференциации. В настоящее время в бактериологической практике широко используют плотные дифференциально-диагностические питательные среды с лактозой (среды Плоскирева, Эндо, Левина). По способности бактерий ферментировать лактозу гальмонеллы отличают от часто сопутствующей… Читать ещё >
Биологические свойства сальмонелл (реферат, курсовая, диплом, контрольная)
Род Salmonella
Возбудители пищевых токсикоинфекций, кишечных инфекционных болезней человека и пищевых токсикозов Род Salmonella разделен на 4 вида (подрода). Вид I— S. kauffmani — объединяет большую часть патогенных для человека сальмонелл. Вид II — S. salamal — отличается от сальмонелл других видов способностью разжижать желатин и расщеплять малонат натрия. Вид III — S. arizona—объединяет сальмонеллы, ферментирующие (большей частью замедленно) лактозу и не сбраживающие дульцита. Вид IV—S. houtenae — включает «атипичные» в биохимическом отношении сальмонеллы, ферментирующие салицин и растущие в присутствии цианида калия.

Salmonella.
Морфология. Бактерии рода Salmonella представляют собой мелкие палочки с закругленными концами, изредка овальной формы, длиной 2—4 мкм и шириной 0,5 мкм. Иногда они образуют нити. Бактерии подвижны, за исключением S. gallinarum — pullorum. Спор и капсул не образуют, грамотрицательны (рис. 15).
Культуральные свойства. Сальмонеллы относятся к аэробам, но отдельные виды могут развиваться при ограниченном доступе кислорода воздуха. Хорошо растут на простых питательных средах, за исключением некоторых ееротипов (S. paratyphi A., S. abortus ovis, S. pullorum, S. sendai, S. typhisuis), которые дают очень скудный рост. Резких различий в характере роста сальмонелл различных видов на простом МПА и простых жидких средах не наблюдается. Оптимальная реакция среды для роста сальмонелл слабощелочная (рН 7,2— 7,6); оптимальная температура 37 °C, но могут развиваться в пределах от 6 °C до 46 °C. При рН 5—8 и температуре 20 °C (или 38— 39°С) бактерии могут размножаться, но значительно медленнее, чем при оптимальных режимах роста.
На поверхности МПА в чашках Петри сальмонеллы образуют гладкие, круглые, очерченные, полупрозрачные, выпуклые, влажные колонии с металлическим блеском, иногда со слегка вдавленным центром (S-форма). Многие серологические типы бактерий рода Salmonella формируют на МПА вокруг колоний четко различимый слизистый вал — феномен валообразования. Феномен валообразования закономерно отсутствует у S. typhimurium, S. abortus ovis, S. pullorum, S. gallinarum. Наряду с S-формами колоний сальмонеллы формируют R-формы. Колонии R-формы в отличие от колоний S-формы шероховатые, мутные и сухие. На скошенном МПА колонии S-формы сальмонелл дают пышный рост с сильным помутнением конденсационной воды, а при росте на МПБ — с сильным помутнением среды (при кислой реакции среды на поверхности бульона иногда образуется пленка). R-формы колоний сальмонелл при росте на МПБ дают осадок, а надосадочная жидкость при этом остается прозрачной.
Общность морфологии и ряда культуральных свойств бактерий рода Salmonella не позволяет типизировать их по указанным признакам. Для этого кроме морфологии и культуральных свойств изучают ферментативные свойства и антигенную структуру, в отдельных случаях ставят биологическую пробу на лабораторных животных.
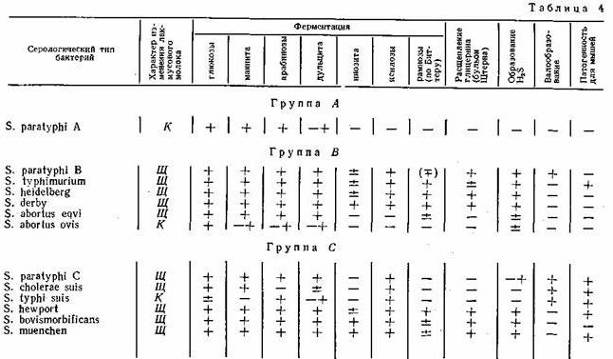
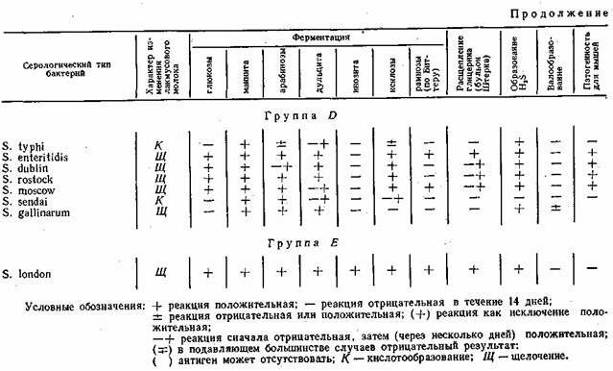
сальмонеллез бактерия размножение Ферментативные свойства. Ферментативные свойства бактерий обусловлены набором ферментов, отражают определенные условия питания и обмена веществ, свойственные данному виду микроорганизмов в тех или иных условиях внешней среды. Бактерии рода Salmonella характеризуются следующими ферментативными свойствами: не разжижают желатина, не разлагают адонита и не ферментируют сахарозу; подавляющее большинство не расщепляет салицина и не разлагает лактозу, не образует индола, не расщепляет мочевину, не дает реакции Фогес-Проскауера (реакция на ацетилметилкарбинол); ферментирует (за небольшим исключением мальтозу, маннит, сорбит, расщепляет глюкозу с образованием газа (S. typhi, S. pullorum обычно не образуют газа); дает положительную реакцию с метиловым красным, утилизирует аммоний и редуцирует нитраты; большинство из них продуцирует сероводород.
Для изучения ферментативных свойств бактерий рода Salmonella обычно используют короткий цветной (пестрый) ряд, состоящий из сред с глюкозой, маннитом, ара-бинозой, дульцитом, рамнозой (среда Биттера); глицеринофуксиновый бульон (бульон Штерна). Помимо указанных сред для дифференциации серологических типов сальмонелл используют также среды с мальтозой, инозитом, трегалозой, ксилозой; лакмусовое молоко (изменение лакмусового молока при росте сальмонелл позволяет их дифференцировать по способности образовывать кислоту или щелочь). Вместо лакмусового можно использовать обезжиренное молоко с индикатором бромтимоловым синим (1 мл 0,4%-ного раствора в 100 мл молока). Известное значение для дифференциации сальмонелл имеет образование сероводорода культурой. Протеоли-тические свойства исследуют путем посева изучаемой культуры сальмонелл на МПЖ и молоко.
Ввиду сходства бактерий рода Salmonella с другими микроорганизмами семейства Enterobacteriaceae возникает необходимость их дифференциации. В настоящее время в бактериологической практике широко используют плотные дифференциально-диагностические питательные среды с лактозой (среды Плоскирева, Эндо, Левина). По способности бактерий ферментировать лактозу гальмонеллы отличают от часто сопутствующей Е. соН, поэтому при исследовании материала на сальмонеллы вначале производят высев на одну из дифференциально-диагностических сред. На этих средах Е. coli, ферментирующая лактозу с образованием кислоты и изменением цвета индикатора, образует колонии, отличающиеся по цвету от колоний сальмонелл, не ферментирующих лактозу. На среде Эндо бактерии Е. coli дают колонии красного цвета, часто с металлическим блеском, сальмонеллы — бесцветные или бледно-розовые (окрашенные в цвет среды); на среде Плоскирева Е. coli — колонии оранжево-красного цвета, сальмонеллы — прозрачные или нежно-розовые; на среде Левина Е.- coli формируют колонии черного цвета, окруженные ободком, сальмонеллы— прозрачные, нежно-розовые или розовато-фиолетовые. Для дифференциации сальмонелл и культураль-но сходных штаммов, а также бактерий рода Proteus и бактерий группы кишечных палочек применяют среды с мочевиной (среда Прейса, Ресселя, Олькеницкого), SS-агар (Salmonella — Shigella — агар) и др. Цвет этих сред обусловлен неодинаковой интенсивностью расщепления микроорганизмами азотистых веществ с образованием щелочных продуктов. Бактерии группы кишечных палочек и Proteus (за исключением 0-формы), как правило, на SS-arape не дают роста, а сальмонеллы растут в виде нежных, бесцветных колоний.
Плотные дифференциально-диагностические среды служат лишь для определения принадлежности бактерий к роду Salmonella и отделения их от сопутствующей микрофлоры.
Для наиболее эффективного выделения сальмонелл из патологического материала, содержащего большое количество сопутствующей микрофлоры, препятствующей их росту, используют специальные среды обогащения (Мюллера, Кауфмана и др.). Тетратионовый натрий, добавляемый в среду Мюллера, подавляет рост бактерий группы кишечных палочек, но не препятствует развитию сальмонелл. Среда Кауфмана представляет собой модифицированную среду Мюллера, к которой добавлены раствор бриллиантовой зелени и натуральная бычья желчь. Эти компоненты задерживают рост бактерий группы кишечных палочек и особенно протеуса, но способствуют росту сальмонелл.
Ферментативные свойства сальмонелл не всегда стабильны и могут изменяться в зависимости от условий внешней среды, поэтому правильное типизирование сальмонелл возможно лишь в результате изучения комплекса морфологических, культуральных, ферментативных свойств и антигенной структуры.
Антигенная структура. Она детально изучена Кауфманом, Уайтом, положена в основу современной серологической классификации бактерий рода Salmonella.
У бактерий рода Salmonella различают два основных антигенных комплекса: Ои Н-антигены. Это структурные элементы бактериальной клетки. Соматические О-антигены термоустойчивы и представляют собой липо-полисахариднополипептидные комплексы. Жгутиковые Н-антигены термолабильны, имеют белковую природу. Кроме того, у бактерий рода Salmonella обнаружен ряд других антигенов — поверхностных и капсульных. Между капсульными и поверхностными антигенами не существует резкого разграничения, переход осуществляется постепенно, поэтому оба антигена, и капсульный, и поверхностный, объединяются под общим названием К-антиген.
Название К происходит от немецкого слова «kapsel». В группе Salmonella доказано наличие трех К-антигенов: антиген 5, Vi-антиген и М-антиген.
Схема серологической классификации сальмонелл разработана Кауфманом и Уайтом. Согласно предложенной схеме бактерии из рода Salmonella были разбиты на пять больших групп по общности соматического 0-антигена: А, В, С, D, Е. Оказалось, что О-антигены неоднородны и состоят из двух и более рецепторов (фракций), которые были обозначены в схеме римскими цифрами (I, II, III и т. д.). В свою очередь H-антигены, специфические и неспецифические оказались также неоднородными. Рецепторы специфических H-антигенов были обозначены малыми буквами латинского алфавита, а рецепторы неспецифических H-антигенов — арабскими цифрами и частично буквами.
Дальнейшее изучение антигенной структуры бактерий из рода Salmonella, выделенных от людей и животных, обнаруживало все большую сложность этой структуры, сопровождаясь все время открытием новых Ои H-антигенов, а следовательно, и новых типов. В серологические схемы Кауфмана — Уайта в 1939 г. на II Международном конгрессе микробиологов было введено разделение H-антигена на фазы I и II с упразднением деления на пецифическую и неспецифическую фазы. В обозначении 0-антигенов сальмонелл римские цифры были заменены арабскими.
В настоящее время для обозначения серологических групп в схеме исчерпаны все буквы латинского алфавита и последующие группы (51 и дальше) обозначены цифрами их соматических антигенов. Число систематизирован-ных сальмонелл превысило в настоящее время 1600.
Для полного типизирования сальмонелл по антигенной структуре достаточно иметь ограниченный набор монорецепторных Ои H-сыворрток, позволяющих идентифицировать типы сальмонелл групп А, В, С, D, E, которые чаще всего выделяются от людей и животных.
Помимо вышеописанных методов типизирования сальмонелл в последнее десятилетие нашел применение метод фаготипизирования.
В связи с тем что микроорганизмы из рода Salmonella, вызывающие пищевые токсикоинфекции, широко распространены в объектах внешней среды, особенно в пищевых продуктах, важное значение имеют сведения о влиянии на их жизнедеятельность различных физических факторов и химических веществ.
Устойчивость. Некоторые виды сальмонелл сохраняют свою жизнеспособность в течение 3 мес в комнатной пыли и навозе.
Сальмонеллы устойчивы к высушиванию. Так, они сохраняют. жизнеспособность в сухом кале телят до 185 дней (срок наблюдения), в сухом кале взрослого крупного рогатого скота — до 4 лет, в мышином кале — до 1 года (И. В. Шур, 1970). В различных почвах сальмонеллы остаются жизнеспособными от нескольких недель до 97 мес. Сальмонеллы в воде открытых водоемов сохраняли жизнеспособность от 15 до 45 дней в зависимости от температуры и других факторов. S. dublin выживала в предварительно прокипяченной воде: при 0°— 34—104 дня, при 15 °C —5—87 дней, при 37 °C — 3—20 дней. S. typhimurium в стерильной водопроводной воде оставалась жизнеспособной 250—270 дней, a S. enteritidis —230—250 дней (Ю. Б. Сафаров и М. А. Курбанова, 1966). Имеющиеся данные о влиянии высоких температур на жизнедеятельность бактерий рода Salmonella весьма противоречивы. Это объясняется тем, что отдельные виды сальмонелл и даже отдельные штаммы одного вида обладают различной устойчивостью. Так, S. typhimurium в физиологическом растворе при 70 °C погибают через 5 мин, а в МПБ —через 10 мин; S. chole-гае suis как в физиологическом растворе, так и в МПБ при 70 °C погибают через 5 мин (В. А. Килессо, Е. И. Выдрина, 1959). Сальмонеллы устойчивы к низким температурам. Так, на плотных питательных средах (МПА) культуры S. cholerae suis при 0 °C остаются жизнеспособными в течение 142 дней, а при — 10 °C — в течение 115 дней.
Сальмонеллы устойчивы к высоким концентрациям поваренной соли, особенно в средах, содержащих белок. В мясном рассоле, содержащем 29% поваренной соли, при 6—12°С S. paratyphi В сохраняли жизнеспособность до 4 мес; a S. enteritidis — 8 мес, S. typhimurium и S. anaturn выживали в мясном бульоне с концентрацией поваренной соли 10% при 3—5°С в течение 70 дней, а в МПБ, содержащем 20% поваренной соли и больше, — в течение 42—45 дней. Они устойчивы также к действию некоторых кислот. Например, после обработки при комнатной температуре бульонных культур S. dublin и S. cholerae suis 1%-ным раствором молочной кислоты они погибали через 9—12 ч. В результате обработки при комнатной температуре бульонных культур S. cholerae suis 6—8%-ным раствором уксусной кислоты их гибель наступала через 18—24 ч.
Сальмонеллы, находящиеся в пищевых продуктах (особенно в мясных), очень устойчивы к тепловой обработке. Мясо, обсемененное S. enteritidis и S. cholerae suis, полностью обезвреживается только при проварке его кусками массой 500 г и толщиной 6 см в течение 3 ч при 100 °C. И. С. Загаевский (1961) установил, что S. typhimurium погибает в толще куска свинины через 10 мин после того, как температура внутри куска достигнет 80 °C.
По действующим правилам ветеринарно-санитарнои экспертизы (1970) мясо, полученное от животных, больных сальмонеллезом, считается обезвреженным после проваривания его кусками массой не более 2 кг, толщиной 8 см в открытых котлах в течение 3 ч, а в автоклаве при 0,05 МПа в течение 2,5 ч (температура внутри куска не ниже 80°С). В мясе, хранящемся в холодильнике при низкой плюсовой температуре, сальмонеллы не только выживают, но и способны размножаться.
Соление и копчение мяса оказывают слабое воздействие на сальмонелл. В соленом и копченом мясе некоторые сальмонеллы сохраняют жизнеспособность в середине кусков до 75—97 дней.
При размножении сальмонелл в молоке его внешний вид и вкус не изменяются. Пастеризация молока при 85 °C в течение 30 мин в производственных условиях способствует полному уничтожению сальмонелл. В высушенном твороге, искусственно зараженном S. typhimurium и S. dublin и хранившемся при О—4°С, сальмонеллы выживают в течение 56 мес, а при комнатной температуре—34 мес. Сальмонеллы, которые были введены в сливочное масло, хранившееся при комнатной температуре, оставались жизнеспособными до 128 дней, а при О—4°С —284 дней. S. dublin и S. cholerae suis, внесенные в простоквашу кислотностью 85°Т, оставались жизнеспособными в течение 48 ч (предельный срок хранения простокваши) при 0—4°С.
В замороженных яичных желтках S. tenessee, S. mon-tevideo, S. typhimurium сохраняли жизнеспособность после 13-месячного хранения при —20°С. В яичном меланже S. cholerae suis погибали при 65 °C лишь через 20 мин.
Патогенность. Вопрос о разграничении бактерий рода Salmonella на монопатогенные для человека и для животных и бипатогенные до настоящего времени еще изучен недостаточно.
В процессе эволюции сальмонеллы приспособились к существованию в организме того или иного хозяина. Однако эта избирательная способность не определяет абсолютной монопатогенности данного возбудителя в отношении естественного хозяина.
Резкое деление бактерий рода Salmonella на патогенных только для человека или только для животных следует считать необоснованным. Так, S. cholerae suis, которую раньше считали патогенной только для свиней, может вызывать заболевание как различных животных, так и человека. В этиологии сальмонеллезов у людей значительную роль играет S. pullorum, которую долгое время не считали патогенной для человека. S. paratyphi В до недавнего времени считали патогенной только для человека.
В настоящее время установлено, что люди могут быть бактерионосителями и бактериовыделителями различных серологических типов сальмонелл вследствие перенесенного заболевания или употребления в пищу зараженных сальмонеллами продуктов. Кроме того, сальмонелло-носительство у человека возможно в результате контакта с больными людьми и животными, а также с обсемененными продуктами.
Довольно значительная часть бактерионосителей и бактериовыделителей встречается среди работников пищевых предприятий, причем типы выделяемых сальмонелл весьма разнообразны. Но преобладают сальмонеллы серологической группы В — S. typhimurium.
Эпидемиологическая опасность сальмонелловыделе-ния у людей связана с распространением инфекции среди населения через инфицированные пищевые продукты и возникновением вторичных форм сальмонеллезов, наслаивающихся на первичные патологические процессы (истощение, авитаминозы и пр.).
У животных существует три основные формы сальмонеллеза: первичные сальмонеллезы; вторичные сальмонеллезы; бактерионосительство.
Первичные сальмонеллезы — заболевания, вызываемые специфическими возбудителями из рода Salmonella (сальмонеллез телят, сальмонеллез поросят, инфекционный аборт лошадей и пр.). Они характеризуются специфической клинической картиной и патологоанатомическими изменениями, свойственными животным данного вида.
Вторичные сальмонеллезы не представляют собой самостоятельных заболеваний, а являются результатом патогенного действия микробов, обитающих в здоровом организме. Чаще всего заболеванию вторичными сальмонеллезами подвержены истощенные животные, животные с желудочно-кишечными заболеваниями, с обширными травмами и т. п. Эти заболевания не имеют специфической клинической картины.
Животные с вторичными сальмонеллезами представляют большую опасность для человека. Наиболее часто возбудителями их являются сальмонеллы группы В, С, D, Е. Поставить диагноз вторичного сальмонеллеза сложно, так как признаки заболевания маскируются симптомами основной болезни.
Бактерионосительство возникает у животных и человека в результате перенесения заболевания. При этом возбудитель, находясь в организме, длительное время выделяется во внешнюю среду с калом, мочой, слюной.
Многие серологические типы сальмонелл выделены у животных различных видов. У крупного рогатого скота преобладает S. typhimuriurn, встречаются S. dublin, S. paratyphi В, S. enteritidis, а также многие редкие типы сальмонелл: S. abortus bovis, S. brandenburg, S. monte-video, S. derby и др. У овец обнаружены S. dublin, S, anaturn и S. abortus ovis. В результате исследований, выполненных за рубежом, от крупного рогатого скота выделено свыше 30 различных типов сальмонелл.
Сальмонеллоносительство довольно широко распространено среди свиней. В настоящее время вопреки обычному представлению о преобладании у свиней S. cholerae suis выделены разнообразные серологические типы сальмонелл (наиболее часто выделяют S. typhimurium).
У лошадей обнаружены S. typhimurium и S. dublin. По степени сальмонеллоносительства лошади стоят на четвертом месте после телят, взрослого рогатого скота и свиней.
Помимо указанных животных сальмонеллоносительство, характеризующееся большим разнообразием серологических типов сальмонелл, выявлено у грызунов (особенно у мышей и крыс), кошек, собак, диких зверей и рыб.
В эпидемиологии сальмонеллезов большую роль играют водоплавающие птицы, а также куры, индейки, являющиеся носителями различных типов сальмонелл, в том числе и наиболее патогенных для человека S. typhimurium. Сальмонелл обнаруживают не только в органах и мышцах птиц, но и в яйцах. Яйцо, обсемененное сальмонеллами, обычно не имеет каких-либо органолептических изменений.
Продукты животного происхождения играют большую роль в эпидемиологии и эпизоотологии сальмонеллезов. Как показали многочисленные наблюдения, человек заражается сальмонеллами в результате употребления мяса и мясных продуктов. Для животных наибольшую опасность представляют сальмонеллоносители и корма животного происхождения, инфицированные сальмонеллами.
Мясо животных-сальмонеллоносителей и приготовленные из него продукты также опасны для человека. Кроме того, возможны случаи обсеменения мяса при убое и разделке туш животных. Даже при контакте с сырым мясом люди могут заражаться и оставаться сальмонеллоносителями. Доказано, что главная роль в возникновении сальмонеллезов у людей принадлежит мясу крупного рогатого скота.
Причиной массовых вспышек сальмонеллеза может быть и конина. Баранина редко является источником заражения. Следует отметить, что убой животных, находящихся в личном пользовании, а также мясо вынужденно убитых животных играют немаловажную роль в возникновении сальмонеллезов.
В эпидемиологии сальмонеллезов большое значение имеет кулинарная обработка мяса. Так, наибольшую опасность представляет, например, мясной фарш, скоропортящиеся колбасы (ливерная, кровяная), студни и пр.
В большинстве случаев мясо обсеменяется через людей — сальмонелловыделителей, реконвалесцентов — либо через насекомых, а также мышей и крыс. Сальмонеллы, попавшие на тушу даже в небольшом количестве, при соответствующей температуре и влажности могут быстро размножаться и проникать вглубь мышц.
Молоко и молочные продукты гораздо реже, чем мясные, являются причиной пищевых отравлений. Обсеменение молока сальмонеллами может быть эндогенным и экзогенным. Инфицирование молока главным образом происходит через загрязненную посуду, доильные аппараты, руки доильщиц и т. п. Часто фактором передачи сальмонелл служит инфицированное молоко от больных коров, а также молочные продукты, инфицированные после их приготовления.
Диагностика. При пищевых токсикоинфекциях, вызванных бактериями из рода Salmonella, исследуют рвотные массы, промывные воды желудка, испражнения, мочу и пищевые продукты. Поступивший в лабораторию материал подвергают микробиологическому анализу, который предусматривает посев на плотные дифференциальные питательные среды и среды накопления. Выделенную культуру испытывают на патогенность на белых мышах. Одновременно с выделенной чистой культурой исследуемый материал и подозреваемые пищевые продукты используют для биологической пробы.
Профилактика. Профилактика пищевых отравлений должна включать мероприятия, направленные на ликвидацию сальмонеллезной инфекции, а также условий ее возникновения и распространения. Эти мероприятия должны проводить как органы здравоохранения, так и ветеринарная служба.