Белки.
Нуклеиновые кислоты

Простые и сложные белки. По химическому составу выделяют белки простые и сложные. К простьм относятся белки, состоящие только из аминокислот, а к сложный — белки, содержащие белковую часть и небелковую (простетическую); простетическую группу могут образовывать ионы металлов, остаток фосфорной кислоты, углеводы, липиды и др. Простыми белками являются сывороточный альбумин крови, фибрин, некоторые… Читать ещё >
Белки. Нуклеиновые кислоты (реферат, курсовая, диплом, контрольная)
Аминокислоты — структурные компоненты белков. Белки, или протеины (греч. protos — первостепенный), — это биологические гетерополимеры, мономерами которых являются аминокислоты.
Аминокислоты представляют собой низкомолекулярные органические соединения, содержащие карбоксильную (-СООН) и аминную (-NH2) группы, которые связаны с одним и тем же атомом углерода. К атому углерода присоединяется боковая цепь — какой-либо радикал, придающий каждой аминокислоте определенные свойства. Общая формула аминокислот имеет вид:
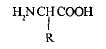
У большей части аминокислот имеется одна карбоксильная группа и одна аминогруппа; эти аминокислоты называются нейтральными. Существуют, однако, и основные аминокислоты — с более чем одной аминогруппой, а также кислые аминокислоты — с более чем одной карбоксильной группой.
Известно около 200 аминокислот, встречающихся в живых организмах, однако только 20 из них входят в состав белков. Это так называемые основные, или белокобразующие (протеиногенные), аминокислоты.
В зависимости от вида радикала основные аминокислоты делят на три группы: 1) неполярные (аланин, метионин, валин, про-лин, лейцин, изолейцин, триптофан, фенилаланин); 2) полярные незаряженные (аспарагин, глутамин, серии, глицин, тирозин, треонин, цистеин); 3) полярные заряженные (аргинин, гистидин, лизин — положительно; аспарагиновая и глутаминовая кислоты — отрицательно).
Боковые цепи аминокислот (радикал) могут быть гидрофобными или гидрофильными, что придает белкам соответствующие свойства, которые проявляются при образовании вторичной, третичной и четвертичной структур белка.
У растений все необходимые аминокислоты синтезируются из первичных продуктов фотосинтеза. Человек и животные не способны синтезировать ряд протеиногенных аминокислот и должны получать их в готовом виде вместе с пищей. Такие аминокислоты называются незаменимыми. К ним относятся лизин, валин, лейцин, изолейцин, треонин, фенилаланин, триптофан, метионин; атакже аргинин и гистидин — незаменимые для детей, В растворе аминокислоты могут выступать в роли как кислот, так и оснований, т. е. они являются амфотерными соединениями. Карбоксильная группаСООН способна отдавать протон, функционируя как кислота, а аминная — NH2 — принимать протон, проявляя таким образом свойства основания. Пептиды. Аминогруппа одной аминокислоты способна вступать в реакцию с карбоксильной группой другой аминокислоты.
Образующаяся при этом молекула представляет собой дипептид, а связьCO-NHназывается пептидной связью:
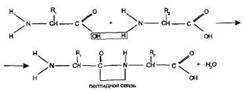
На одном конце молекулы дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды. Если таким образом соединяется много аминокислот (более десяти), то получается полипептид. Пептиды играют важную роль в организме. Многие олигои полипептиды являются гормонами, антибиотиками, токсинами.
К олигопептидам относятся окситоцин, вазопрессин, тиреотропин, а также брадикинин (пептид боли) и некоторые опиаты («естественные наркотики» человека), выполняющие функцию обезболивания. Принятие наркотиков разрушает опиатную систему организма, поэтому наркоман без дозы наркотиков испытывает сильную боль — «ломку», которая в норме снимается опиатами. К олигопептидам относятся и некоторые антибиотики (например, грамицидин S). Многие гормоны (инсулин, адренокортикотропный гормон и др,), антибиотики (например, грамицидин А), токсины (например, дифтерийный токсин) являются полипептидами.
Белки представляют собой полипептиды, в молекулу которых входит от пятидесяти до нескольких тысяч аминокислот с относительной молекулярной массой свыше 10 000. Структура белков. Каждому белку в определенной среде свойственна особая пространственная структура. При характеристике пространственной (трехмерной) структуры выделяют четыре уровня организации молекул белков (рис. 1,1).

Первичная структура — последовательность аминокислот в полипептидной цепи. Такая структура специфична для каждого белка и определяется генетической информацией, т. е. зависит от последовательности нуклеотидов в участке молекулы ДНК, кодирующем данный белок. От первичной структуры зависят все свойства и функции белков. Замена одной-единственной аминокислоты в составе молекул белка или нарушение порядка в их расположении обычно влечет за собой изменение функции белка.
Учитывая, что в состав белков входит 20 видов аминокислот, число вариантов их комбинаций в полипептидной цепи поистине безгранично, что обеспечивает огромное количество видов белков в живых клетках. Например, в организме человека обнаружено более 10 тыс. различных белков, и все они построены из одних и тех же 20 основных аминокислот.
В живых клетках молекулы белков или отдельные их участки представляют собой не вытянутую цепь, а скручены в спираль, напоминающую растянутую пружину (это так называемая а-спираль), или сложены в складчатый слой (р-слой). Такие а-спирали и р-слои являются вторичной структурой. Она возникает в результате образования водородных связей внутри одной полипептидной цепи (спиральная конфигурация) или между двумя полипептидными цепями (складчатые слои).
Полностью a-спиральную конфигурацию имеет белок кератин. Это структурный белок волос, ногтей, когтей, клюва, перьев и рогов; он входит в состав наружного слоя кожи позвоночных.
У большинства белков спиральные и неспиральные участки полипептидной цепи складываются в трехмерное образование шаровидной формы — глобулу (характерна для глобулярных белков). Глобула определенной конфигурации является третичной структурой белка. Такая структура стабилизируется ионными, водородными, ковалентными дисульфидными связями (образуются между атомами серы, входящими в состав цистеи-на, цистина и мегионина), а также гидрофобными взаимодействиями. Наиболее важными в возникновении третичной структуры являются гидрофобные взаимодействия; белок при этом свертывается таким образом, что его гидрофобные боковые цепи скрыты внутри молекулы, т. е. защищены от соприкосновения с водой, а гидрофильные боковые цепи, наоборот, выставлены наружу.
Многие белки с особо сложным строением состоят из нескольких полипептидных цепей (субъединиц), образуя четвертичную структуру белковой молекулы. Такая структура имеется, например, у глобулярного белка гемоглобина. Его молекула состоит из четырех отдельных полипептидных субъединиц (протомеров), находящихся в третичной структуре, и небелковой части — гема.
Только в такой структуре гемоглобин способен выполнять свою транспортную функцию.
Под влиянием различных химических и физических факторов (обработка спиртом, ацетоном, кислотами, щелочами, высокой температурой, облучением, высоким давлением и т. д.) происходит изменение вторичной, третичной и четвертичной структур белка вследствие разрыва водородных и ионных связей. Процесс нарушения нативной (естественной) структуры белка называется денатурацией. При этом наблюдается уменьшение растворимости белка, изменение формы и размеров молекул, потеря ферментативной активности и т. д. Процесс денатурации может быть полным или частичным. В некоторых случаях переход к нормальным условиям среды сопровождается самопроизвольным восстановлением естественной структуры белка. Такой процесс называется ренатурацией.
Простые и сложные белки. По химическому составу выделяют белки простые и сложные. К простьм относятся белки, состоящие только из аминокислот, а к сложный — белки, содержащие белковую часть и небелковую (простетическую); простетическую группу могут образовывать ионы металлов, остаток фосфорной кислоты, углеводы, липиды и др. Простыми белками являются сывороточный альбумин крови, фибрин, некоторые ферменты (трипсин) и др. К сложным белкам относятся все протеолипиды и гликопротеины; сложными белками являются, например, иммуноглобулины (антитела), гемоглобин, большинство ферментов и т. д.