Лептоспироз в убойных продуктах крупного рогатого скота: наличие бактерии во внутренних органах и морфологические данные

Как известно из литературных источников лептоспироз в последние годы протекает бессимптомно, что значительно осложняет обеспечение безопасности продуктов животноводства. В этой связи нами были проведены исследования по индикации лептоспир в продуктах убоя крупного рогатого скота, поступивших на убойные пункты Алматинской области. При визуальном исследовании из 573 убойных коров различные… Читать ещё >
Лептоспироз в убойных продуктах крупного рогатого скота: наличие бактерии во внутренних органах и морфологические данные (реферат, курсовая, диплом, контрольная)
Лептоспироз — зоонозная природноочаговая инфекционная болезнь диких, домашних животных и человека, широко распространенная в различных ландшафтно-географических зонах мира. Возбудители лептоспироза относятся к семейству Leptospiraceae, выделенному из Spirochaetaceae, роду Leptospira, который подразделяется на два вида: паразитический Interrogans и сапрофитический Biflexa. По последним данным в мире насчитывается свыше 240 патогенных, около 60 сапрофитых серотипов лептоспир. Патогенные лептоспиры имеют важное значениев области общественного здравоохранения, так как вызывают зоонозных заболеваний [1,2,3]. Широкий спектр видов хозяев, таких как люди, дикие и домашние животные, грызуны являются резервуаром для лептоспир [4].
В современном мире безопасность пищевых продуктов становится все более важной глобальной проблемой. Она не только касается здоровья людей, но и оказывает большое воздействие на экономику стран. При этом контроль продуктов питания, сырья животного происхождения является шагом первостепенной важности, направленным на защиту интересов потребителей. Анализ литературных данных показывает, что лептоспирозы различных животных часто протекают в субклинической форме, что приводит к несвоевременной диагностике этого заболевания [5,6,7]. Тем не менее, в организме животных лептоспиры локализируются в основном в почках и вызывает хронический интерстициальный нефрит [8], при этом животные могут быть клинический здоровы. Хотя и другие инфекции могут вызвать изменения в почках, интрестициальный нефрит часто вызывается лептоспирами [9,10,11,12]. Клинические признаки и результаты вскрытии может быть не патогномоничным и может быть ошибочно принято как другие патогены. Таким образом, один клинический диагноз не является достаточным и должно сопровождаться дополнительными исследованиямидля достижения точных результатов диагностики и разработки надлежащих стратегий борьбы с болезню [13,14,15,16].
Цель данного исследования выявить лептоспир в убойных продуктах крупного рогатого скота.
Материалы и методы исследований
Работа выполнялась в лаборатории противобактериозной биотехнологии и учебно научно-диагностической лаборатории Казахстанско-Японского инновационного центра Казахского национального аграрного университета. Исследованы внутренние органы 573 крупных рогатых скот, поступившие на убойные пункты Алматинской области в 2011;2013 годы. Эти животные привезены из разных фермерских хозяйств и от частных лиц юговосточного региона страны. С диагностической целью были были собраны почки.
32 коров, которые имели различные изменения.
Гистопатологическое исследование. Образцы тканей почек толщиной 1 см³ фиксировали в 10% нейтральном буферном растворе формалина. Образцы затем обезвоживали при возрастающей концентрации этанола и заливали в парафин. Срезы толщиной 5 мкм окрашивали гематоксилин-эозином и исследовали с обычным светом микроскоп.
Dark-fieldmicroscopy.Кусочки почки массой 2−3 г растирали на ступке с 5-см3 физиологическим раствором до получения гомогенной взвеси. Ткань растирали в фарфоровой ступке, центрифугировали при 3000 об/мин в течение 10 минут и микроскопировали верхний прозрачный слой. Готовили из каждой пробы 2−3 раздавленные капли и просматривали до 50 полей зрения в каждой (MEIJI TECHNO CO., LTD, Japan).
Биопроба. Золотистых хомяков (Mesocricetus auratus), массой 80−90г, заражали мочой или суспензией из почек, в которых при микроскопии обнаружили лептоспир. Исследуемый материал вводили внутрибрюшно в дозе 0,5−1 мл. Всего было заражено 6 хомяка, 3 суспензией из почек. Животных забивали на 21-й день после заражения.
Выделение культуры. Из почек получили образцы пастеревской пипеткой и вносили в среду Флетчера (HiMediaLaboratoriesPvt. Limited, Индия). Посеянные пробы с материалом немедленно ставили в термостат при температуре 28−300С. Рост лептоспир наблюдали каждые 3 сутки в течение трех месяцев. Из посеянного материала готовили препараты.
«раздавленная капля» и исследовали под микроскопом с темнопольным конденсором (MEIJI TECHNO CO., LTD, Japan). При обнаружении лептоспир проводился немедленный пересев выделенной культуры на свежие питательные среды, из сывороточного агара, который готовили из агара Дифко (EMJH media-DIFCO) с добавлением инактивированной сыворотки кролика. После выдерживания в термостате посевного материала в течение 10 -14 дней, участки агара свободные от видимого поверхностного роста переносили в пробирки с жидкой питательной средой [17].
Полимеразная цепная реакция. Выделение ДНК из замороженных почек и других внутренних органов проведены с помощью автоматической станции выделения НК — Thermo Scientific King Fisher. Пробоподготовка «Thermo Scientific King Fisher Celland Tissue DNAKit» будет проводится согласно протоколу набора. ПЦР была выполнена на основе гена LipL32 с использованием праймеров 5'ATCTCCGTTGCACTCTTTGC3', 5'ACCATCATCATCATCGTCCA3', как описано ранее по Tansuphasiriсо авт. (2006). Этот набор праймеров была разработана для выявления патогенных лептоспир. Образцы считали положительным, при получении продукт амплификации размером 474 п.н. (Vital-Бразилия и др. 2010).
Результаты исследования и их обсуждение
Как известно из литературных источников лептоспироз в последние годы протекает бессимптомно, что значительно осложняет обеспечение безопасности продуктов животноводства. В этой связи нами были проведены исследования по индикации лептоспир в продуктах убоя крупного рогатого скота, поступивших на убойные пункты Алматинской области. При визуальном исследовании из 573 убойных коров различные патоморфологические изменения были обнаружены в почках 32 коров. Результаты исследований отражены в таблице 1.
Таблица 1 — Частота обнаружения различных поражений в почках крупного рогатого скота и выявление лептоспир при этих поражениях.
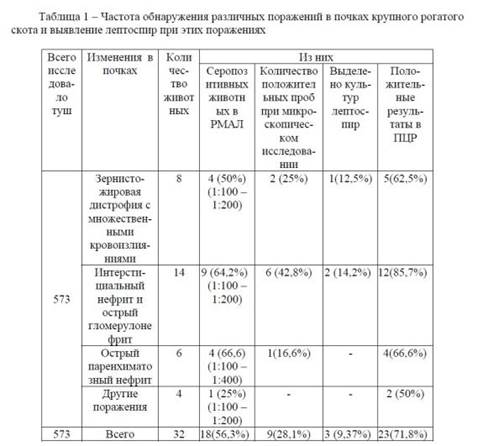
Патоморфологические изменения характеризовались следующими признаками: чаще всего почки были увеличены, светло-коричневого цвета, на поверхности почек обнаруживался серовато-белые очажки различной величины и формы, на разрезе проникающие до мозгового слоя. Множественные или единичные точечные кровоизлияния. Граница коркового или мозгового слоев сглажена.
При гистологическом исследовании почек наиболее часто, то есть в 64,2% случаев выявляли острый очаговый или диффузный интерстициальный нефрит и гломерулонефрит. Острый интерстициальный нефрит сопровождался зернистой дистрофией эпителия мочевых канальцев с единичными или множественными очагами пролиферации клеток лимфоидного типа, расположенных по ходу кровеносных сосудов, между канальцами и вокруг клубочков. При гломерулонефрите сосуды клубочков и интестициальная соединительная ткань расширены. Просвет капсулы Боумена-Шумлянского увеличен. Мочевые канальцы в состоянии дистрофии, их просветы заполены слабооксифильной массой. В 6 случаях обнаружен паренхиматозный нефрит и в 8 случаях отмечали зернистожировую дистрофию с множественными кровоизлияниями. При зернистой дистрофии отмечали помутнение, набухание протоплазмы эпителия мочевых канальцев. Просветы канальцев деформировались и в них обнаруживали слабооксифильную массу.
При микроскопическом исследовании в почках 9 коров были выявлены лептоспиры. Концентрация лептоспир в суспензиях из почек была различной. Во многих пробах единичные лептоспиры обнаруживали при просмотре большого числа полей зрения, в других содержалось 1−5 лептоспир в каждом поле. Вместе с тем, не всегда обнаруживали живые, с активной подвижностью, типичные лептоспиры. Чаше лептоспиры были мертвыми, зернистыми.
Содержание лептоспир в суспензии из почечной ткани, было различным. Чаще всего обнаруживали единичные лептоспиры при просмотре 10−30 полей зрения. В одном случае лептоспиры обнаружены в каждом поле.
Чистые культуры лептоспир выделены от 3 коров. Видимый рост лептоспир отмечен через 15 — 20 дней.
Наиболее высокий результат для индикации лептоспир показала ПЦР, при использовании которой положительную реакция на лептоспироз обнаружено в образцах почек и других внутренних органов от 23 коров, что составило 71,8%. В ряде случаев лептоспиры присутствовали, помимо почек и в других паренхиматозных органах. В печени и в легких лептоспиры обнаруживали у 12 коров, а в лимфоузлах и мышцах у трех животных.
Таким образом, в результате проведенных исследовании установлено, что лептоспиры с наибольшим постоянством обнаруживаются в материале от животных, имеющие поражения в почках, а именно при интерстициальном нефрите и гломерулонефрите. убойный продукт почка лептоспир При визуальном исследовании туш крупного рогатого скота установлено, что они по своим товарным качествам не отличались от туш животных, не зараженных лептоспирозом. Кроме того, при использовании общепринятых методов ветеринарно-санитарной экспертизы продуктов убоя нельзя было отметить каких-либо патологических изменений, кроме нарушений в почках, которые позволили бы задержать указанные туши и другие продукты убоя для более тщательного исследования.
Выводы
На основании проведенных нами исследований установлено, что поступившие на рынок крупный рогатый скот без каких-либо клинических признаков заболевания, могут быть лептоспироносителями, таким образом оказывать риск здоровью человека. Как известно, такие туши выпускаются без каких-либо ограничении, как полученные от здоровых животных. Само-собой разумеется, что это является недопустимым как с эпизоотологической, так и эпидемологической точки зрения.
Нами рекомендуется проводить ПЦР анализ всех убойных животных, которые оказались серопозитивными на лептоспироз, даже при отсутствии выраженных клинических признаков заболевания исключить убой животных на общих основаниях.
- 1. Bharti R., Nally J.E., Ricaldi J.N., Matthias M.A., Diaz M.M., Lovett M.A. et al., on behalf of Peru-United States Leptospirosis Consortium, 2003, `Leptospirosis: A zoonotic disease of global importance', Lancet Infectious Diseases 3, 757−771. http://dx.doi.org/10.1016/S1473- 3099(03)00830−2.
- 2. Levett, N., 2001, `Leptospirosis', Clinical Microbiology Review 4, 296−326. http:// dx.doi.org/10.1128/CMR.14.2.296−326.2001, PMid:11 292 640.
- 3. McBride A.J., Athanazio D.A., Reis M.G. &Ko A.I., 2005, `Leptospirosis', Current Opinion in Infectious Disease 18, 376−386. http://dx.doi.org/10.1097/01. 178 824.05715.2c, PMid:16 148 523.
- 4. Liu D., Lawrence M.L., Austin F.W., Ainsworth A.J. & Pace L.W., 2006, `PCR detection of pathogenic Leptospiragenomospecies targeting putative transcriptional regulator genes', Canadian Journal of Microbiology 52, 272−277. http://dx.doi. org/10.1139/W05−120, PMid:16 604 124.
- 5. Otaka Y., Martins G., Hamond C., Penna B., Medeiros M.A., Lilenbaum W. (2012) Serology and PCR for bovine leptospirosis: herd and individual approaches. Veterinary Record published online March 16. doi: 10.1136/vr.100 490.
- 6. Hernбndez-Rodrнguez, Dнaz C.A., Dalmau E.A., Quintero G.M. (2011) A comparison between polymerase chain reaction (PCR) and traditional techniques for the diagno-sis of leptospirosis in bovines. Journal of Microbiological Methods 84, 1−7.
- 7. Marianelli, Tarantino M., Astarita S., Martucciello A., Capuano F., Galiero G. (2007) Molecular detection of Leptospira species in aborted fetuses of water buffalo. Veterinary Record 161, 310−312.
- 8. Yang W., Wu M.S. & Pan M.J., 2001, `Leptospirosis renal disease', Nephrology Dialysis Transplantation 16, 73−77.http://dx.doi.org/10.1093/ndt/16.suppl5.73.
- 9. Maxie G., 1993, `The urinary system', in K.F. Jubb, P.C.N. Kennedy & N. Palmer, (eds.), Pathology of domestic animals, 4th edn., pp. 447−538, Academic Press, San Diego.
- 10. Thiermann B. (1983) Bovine leptospirosis: bacteriologic versus serologic diagnosis of cows at slaughter. American Journal of Veterinary Research 44, 2244−2245.
- 11. Boqvist S., Montgomery J.M., Hurst M., Thu Ho Thi Viet Evengall E., Olsson Gunnarsson A., Magnusson U., Leptospira in slaughtered fattening pigs in southern Vietnam: presence of the bacteria in kidneys and association with morphological findings. Vet. Microbiol. 93, 361−368.
- 12. Grooms D.L., Bolin C.A., 2005. Diagnosis of fetal loss caused by bovine viral diarrhea virus and Leptospira spp. Vet. Clin. North Am. Food Anim. Pract. 21, 463−472.
- 13. Agudelo-Florez P., Restrepo M. &Lotero M.A., 2006, `Evaluation of indirect immunofluorescence
- 14. Fearnley C., Wakley P.R., Gallego-Beltran J., Dalley C., Williamson S., Gaudie, Woodward M.J., 2008. The development of a real time PCR to detect pathogenic Leptospira species in kidney tissue. Res. Vet. Sci. 85, 8−16.
- 15. Lilenbaum, Varges R., Brandгo F.Z., Cortez A., de Souza S.O., Brandгo P.E., Richtzenhain L.J., Vasconcellos S.A., 2008. Detection of Leptospira spp. in semen and vaginal fluids of goats and sheep by polimerase chain reaction. Theriogenology 69, 837−842.
- 16. Lilenbaum W., Varges R., Ristow P., Cortez A., Souza S.O., Richtzenhaim J., Vasconcellos S.A., 2009. Identification of Leptospira spp. carriers among seroreactive goats and sheep by polymerase chain reaction. Res. Vet. Sci. 87, 16−19.
- 17. Малахов Ю. А., Панин А. Н., Соболева Г. Л. Лептоспироз сельскохозяйственных животных.- Москва, 2000. — 420 с.