Получение гаплоидных регенерантов рапса путем культуры микроспор

Существенным дополнением, повышающим эффективность традиционных методов селекции рапса, является гаплоидная технология. Результаты исследований ряда авторов показали, что до сих пор эмбриогенез в культуре пыльников in vitro различных видов Brassica происходит спонтанно и имеет низкую частоту выхода гаплоидных растений (1−4%), более того предлагаемые технологии трудно воспроизводимы и недостаточно… Читать ещё >
Получение гаплоидных регенерантов рапса путем культуры микроспор (реферат, курсовая, диплом, контрольная)
Получение гаплоидных регенерантов рапса путем культуры микроспор
Важным направление в современной селекции является создание улучшенных и принципиально новых генотипов сельскохозяйственных растений, обладающих единичной, групповой или комплексной устойчивостью к биотическим и абиотическим стрессовым факторам среды при сохранении и повышении их продуктивности и качества. В Казахстане потребности в растительном масле для внутреннего потребления стабильно растут. Так, в Послании Президента Республики Казахстан от 8 февраля 2008 г говорится, что необходимо особое внимание уделить стимулированию производства важнейших продуктов питания, по которым не удовлетворяются потребности страны, в частности растительного масла. По оценке председателя Совета ассоциации таможенных брокеров РК Геннадия Шестакова, сегодня в Казахстан завозится до 50% растительного масла.
Дефицит растительных жиров на рынке Казахстана составляет 60 тыс. т. Широкому внедрению рапса в Казахстане препятствует отсутствие сортов, адаптированных к местным почвенно-климатическим условиям [1, 2].
Существенным дополнением, повышающим эффективность традиционных методов селекции рапса, является гаплоидная технология [15]. Результаты исследований ряда авторов показали, что до сих пор эмбриогенез в культуре пыльников in vitro различных видов Brassica происходит спонтанно и имеет низкую частоту выхода гаплоидных растений (1−4%), более того предлагаемые технологии трудно воспроизводимы и недостаточно изучены на каждом этапе андрогенеза. В настоящей работе с помощью метода культуры микроспор проанализирован способ получения гаплоидных регенерантов рапса, с целью оптимизировать регламент получения дигаплоидов рапса (B. napus L.) в культуре микроспор.
Методы
Растения ярового рапса выращивались в теплице ИББР. Посев обычный рядовой. Глубина посева семян 2−3 см. Фенологические наблюдения проводились ежедневно. Отмечались даты наступления основных периодов вегетации — всходы, стеблевание, бутонизация, цветение, появление стручков, созревание. Проводилось описание элементов морфологии — высота растений, площадь и окраска листовых пластинок, число и размер бутонов и цветков.
Введение
в культуру проводилось в зимне-весенний — с доноров, выращенных в теплице. Закладка опытов, фенологические наблюдения, уход за посевами, гибридизация проводились согласно общепринятым методикам [13].
Изоляцию микроспор и посадку их на питательные среды проводили в асептических условиях — и ламинарных боксах, которые стерилизуют ультрафиолетовыми лучами в течение 15−20 минут.
При выполнении работы соблюдали условия стерилизации питательных сред, посуды, расходного (вата, вода, бумага), посадочного материала (соцветия, бутоны), инструментов (пинцеты, иглы и т. д.).
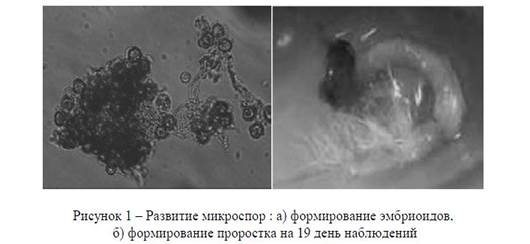
В исследовании использовали жидкую среду, которая разработана для получения гаплоидов из культуры микроспор растений: NLN, MS и Гамборга (В5) (табл.1).
Донорные растения перед введением в культуру in vitro должны содержать достаточное количество физиологически активных веществ. С этой целью, при выращивании донорных растений в теплице, готовили смесь почвы и песка в соотношении 3:1, добавляли удобрения из расчёта N: P=3:1 кг/га[3,6].
Влажность почвы поддерживали на уровне 70 — 80% от полной влагоёмкости. Интенсивность освещения составляла 20−25 тыс. люкс, фотопериод 16 часов день, 8 часов ночь, температура 15−26°С в дневное и 10−15°С в ночное время суток.
Сбор бутонов и соцветий проводили рано утром в часы интенсивного деления пыльцы, их размер находился в интервале 1,5−4,5 миллиметров (мм), и по 40−60 штук (шт.). Обрабатывали соцветия в течение 2 суток при температуре +4−6°С с последующим культивированием изолированных пыльников in vitro при температуре +32°С в течение 2 суток [14].
Изоляция микроспор проводилась по методу Кастерса (2002г.) и Эфтода С. [15] с нашими модификациями. Для эффективной изоляции микроспоры от зародыша использовали микросмеситель Vitek 1472PR. Зародыши помещали в прохладный микросмеситель (10єC), используя 5−10 мл прохладной среды B5 (10−12єC), и гомогенизировали 5−7 сек.
Результаты.
Модифицирована методика Кастерса (2002г.) и Эфтода С. 16] культивирования изолированных микроспор.
Исследования проводили на бутонах из соцветий, которые изолировали как с главного, так и боковых побегов. Схема включала 3 варианта:
- · обработка соцветий низкой положительной температурой (+4+6°С) в течение 2 суток до введения и после введения микроспор при температуре +25°С в течение двух суток в культуру in vitro;
- · обработка бутонов при температуре +10;+15°С до введения и после введения в культуру in vitro высокой температурой (+32°С) в течение 2 суток;
- · сочетание низкой положительной температуры (+4+6°С) в течение 2 суток (до введения в культуру in vitro) с последующей обработкой высокой температурой (+32°С) в течение 2 суток после введения микроспор в культуру in vitro.
Оптимальной была обработка соцветий в сочетании низкой положительной температуры (+4+6°С) в течение 2 суток (до введения в культуру in vitro) с последующей обработкой высокой температурой (+32°С) в течение 2 суток после введения пыльников в культуру in vitro.
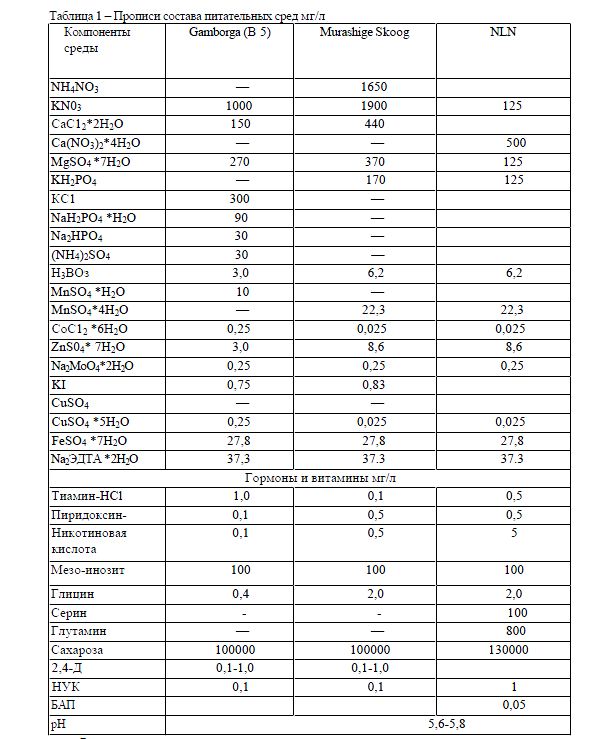
В результате проведенных анализов был выявлен оптимальный состав минеральных солей из прописи среды NLN. В этих условиях микроспоры сохраняли свою жизнеспособность на протяжении длительного периода выращивания в условиях in vitro, и нами был отмечен процесс прямого эмбриогенеза [8, 16] (рис1).
Было установлено, что быстрое развитие эмбриоидов в проростки происходило на агаризованной питательной среде, содержащей гормоны, в то время как в жидких условиях культивирования (на мостиках) сначала развивалась корневая система, а затем гипокотильная часть проростка. При длительном культивировании растений в условиях жидкой среды наблюдали спонтанное образование вторичных эмбриоидов, которые формировались из эпидермальных клеточных слоев гипокотиля и семядолей [5,9,10].
Повышенная температура культивирования в течение 14 суток положительно влияет на выход эмбриоидов на всех изучаемых средах, за исключением среды Мурасиге-Скуга (MS). Микроспоры, культивируемые в стандартных температурных условиях, индуцировали эмбриоиды с частотой 0,6%, при культивировании в опытных условиях — 0,4%. Максимальная частота выхода эмбриоидов — 1,6% получена на среде NLN при повышенной температуре. Резкое различие в выходе эмбриоидов наблюдали на среде В5,.
Повышенная температура стимулирует образование эмбриоидов с 1,3%. Низкий выход эмбриоидов (0,3%) наблюдали при культивировании микроспор на среде MS в стандартных температурных условиях + 26 °C.
Обсуждение результатов
Культивирование микроспор в условиях с повышенной температурой — 32 °C, в течение 14 суток стимулирует эмбриоидогенез в микроспорах ярового рапса. Результаты исследований показали, что эти модификации увеличивают выход гаплоидных регенерантов.
В заключении можно сказать:
- 1. Модифицирована методика Кастерса (2002г.) и Эфтода [16] культивирования изолированных микроспор.
- 2. Оптимизирована среда для культивирования культуры изолированных микроспор, больший выход гаплоидов дала среда NLN.
- 3. Подобраны оптимальные параметры удвоения хромосомного набора гаплоидных регенерантов.
рапс гаплоидный микроспора.
- 1. А. С. Скакун, И. В. Бурда, Д. Брауэр. РАПС — культура масличная. — Минск, 1994.
- 2. Хозяйственно-биологическая характеристика сортов сельскохозяйственных культур. Минск 1998.
- 3. А. Н. Анохин. Справочник агронома. — Изд. «Урожай»
- 4. Бутенко Р. Г. Культура клеток растений и биотехнология. — М.: Наука,
- 5. Катаева Н. В., Бутенко Р. Г. Клональное микроразмножение растений — М Наука,
- 6. Шевелуха B.C. Рост растений и его регуляция в онтогенезе. — М.: Колос,
- 7. Шевелуха В. С., Калашникова С. В., Дегтярев С. В. Сельскохозяйственная биотехнология — М.: Высшая школа,
- 8. Муравлев А. А. Культура пыльников в селекции ярового рапса. // Автореферат диссертации на соискание ученой степени кандидата биологических наук. -2007.
- 9. Май Дык Чунг, Калашникова Е. А. Экспериментальный морфогенез в культуре изолированных пыльников растений различных видов Brassica // Материалы Международной конференции молодых ученых «Фундаментальные и прикладные аспекты современной биотехнологии», 2008. Брянск,
- 10. Ницше В. Гаплоиды в селекции растений. /В. Ницше, Г. Веицель/ М.: Колос.-1980. 128 с.
- 11. Паушева 3. Н. Практикум по цитологии растений. /3. Н. Паушева// М.: Агропромиздат. — 1988. — 271 с.
- 12. Плотников В. А. Факторы лимитируюшие морфогенез в культуре пыльников подсолнечника. / В. А. Плотников // Культура клеток растений. — Абовян. — 1979. — с. 155.
- 13. Пустовойт В. Т. Руководство по селекции и семеноводству масличных культур. /под руководством В. Т. Пустовойта / М.: Колос, 1967. — 351с.
- 14. Раджи А. С. Влияние обработки донорных растений парааминобензойной кислотой на выход каллуса и регенерантов в культуре пыльников яровой пшеницы. / А. С. Раджи, Г. Н. Иванова, В. В. Ефремова // Труды Кубанского гос. агр. унив. — 1991. — - С. 62−66.
- 15. Соколов В. А. Технология гаплоидов в генетике и селекции растений. / В. А. Соколов, Шумный В. К. // Вавиловское наследие в современной биологии / М.: Наука. — С.247−270.
- 16. Eftoda Microspore Culture in Brassica species. Этот адрес e-mail защищен от спам-ботов. Чтобы увидеть его, у Вас должен быть включен Java-Script March. -2002.