Выделение геномной ДНК Pasteurella multocida из бактериальных культур с использованием различных методов

Пастереллы проявляют себя от крайне ослабленного при пастереллоносительстве до высоковирулентного возбудителя болезни в регионах с теплым и умеренным климатом, чаще в период дождей и резких колебаний температуры воздуха, и патогенетически опасным, так как обычно вызывает эпизоотии, нанося чрезвычайный ущерб. В таких ситуациях многие исследователи причиной развития пастереллеза видят в различных… Читать ещё >
Выделение геномной ДНК Pasteurella multocida из бактериальных культур с использованием различных методов (реферат, курсовая, диплом, контрольная)
Выделение геномной ДНК Pasteurella multocida из бактериальных культур использованием различных методов
Пастереллы проявляют себя от крайне ослабленного при пастереллоносительстве до высоковирулентного возбудителя болезни в регионах с теплым и умеренным климатом, чаще в период дождей и резких колебаний температуры воздуха, и патогенетически опасным, так как обычно вызывает эпизоотии, нанося чрезвычайный ущерб [1, 2, 3]. В таких ситуациях многие исследователи причиной развития пастереллеза видят в различных предрасполагающих факторах — неблагоприятные климатические условия, экологические факторы, ведущие к снижению естественной резистентности организма. Однако, по их наблюдениям, с внезапным появлением и очень быстрым («молниеносным») развитием заболевания обычно первыми гибнут достаточно упитанные животные и птица. Известная «особенность» патогенности возбудителя пастереллеза, когда в природе восприимчивые организмы заражаются легко и быстро, а в экспериментах при естественных путях инфицирования далеко не всегда возможно вызвать заболевание [4, 5, 6, 7], не находит точного объяснения. Условия этого процесса, особенно по части восстановления биологических свойств пастерелл, почти не изучены. До настоящего времени основным способом определения патогенности выделенных культур Р. multocida является трудоемкая процедура постановки биологической пробы на белых мышах, что требует определенное время и немалые затраты.
К концу прошлого столетия в микробиологической практике получило широкое развитие использование новых методических подходов, как в прикладном, так и фундаментальном аспекте. Среди них ведущее место заняли молекулярно-генетические методы — рестрикционный анализ, молекулярная гибридизация нуклеиновых кислот, молекулярное клонирование. Применение этих методов не только в научных целях, но и в практической лабораторной диагностике стало возможным в немалой степени благодаря созданию в середине 80-х годов процесса искусственного многократного копирования ДНК и дальнейшему стремительному развитию этой технологии, в настоящее время известной как полимеразная цепная реакция (ПЦР) [8, 9].
Основное преимущество этих методов, по сравнению с иммунологическими, состоит в возможности их использования при латентных и хронических инфекциях для широкого спектра патогенных микроорганизмов, а также определять генетическое родство возбудителей [10]. пастереллез молекулярный гибридизация нуклеиновый При диагностике пастереллеза животных методом ПЦР основным рабочим материалом является ДНК Pasteurella multocida [11]. Основным критерием в методах выделения ДНК является высокая степень очистки нуклеиновой кислоты от примесей клеточных ДНК и белков. Выделенная геномная ДНК должна быть нефрагментированной, так как она служит матрицей для синтеза специфического продукта [12]. Поэтому, нами проведены исследования по отработке оптимальных методов экстрагирования бактериальной ДНК.
Материалы и методы исследований. Решение поставленных задач проводили в научно-диагностической лаборатории, лаборатории противобактериозной биотехнологи КазНАУ, в институте карантинных инфекций им. Айкимбаева, «Молекулярной биологии и генной инженерии вирусов» НИИПББ НЦБ РК, в филиале Костанайская НИВС.
Для выбора оптимального варианта в работе использовали несколько методов выделения ДНК.
Выделение ДНК проводили с помощью коммерческих наборов ДНК-сорб Б, PureLink Genomic DNA Mini Kit, также для этих целей использовали автоматическую станцию выделения НК — Thermo Scientific King Fisher и метод горячего лизиса.
Выделение ДНК с помощью сорбентов. Вносили в пробирки 1,5 см³ суточной культуры и центрифугировали 8 тысяч оборот/мин — 5 минут. Надосадочную жидкость сливали и отмывали буферным раствором. Добавляли в пробирку с осадком 1 см³ буферного раствора TES — разбивали осадок на вортексе. Снова осаждали центрифугированием 8 тыс оборот/мин — 5 минут. Затем сливали надосадочную жидкость и снова добавляли 1 см³ буфера TES, разбивали на вортексе и добавляли 300 мкл лизирующего раствора (изаминидин циотинад) и размешивали на вортексе и оставили на 5 минут в термостат при температуре 65оС. Мутность свидетельствует о лизировании. Затем добавили сорбент — 25 мкл., предварительно встряхнули, после добавления также смешивали на вортексе и оставляли при 370С на 2 минуты. Затем втряхнули несколько несколько секунд на вортексе и снова ставили на 5 минут при комнатной температуре. Центрифугировали 5 тыс/оборот в минуту, 30 секунд. Затем убирали надосадочную жидкость, оставляя шарики на дне. Затем добавляли раствор для отмывки № 1 — 300 мкл (прогретый до 60−650С). Затем центрифугировали 30 секунд при 5 тыс./оборот в минуту.
Удалили надосадочную жидкость и добавляли 500 мкл буфера № 2. Встряхивали на вортексе. Затем центрифугировали 30 секунд, удаляли надосадочную жидкость. Затем сушили в термостате с открытой крышкой 5 минут при 650С. Затем добавляем 50 мкл TE для элюции и встряхивали на вортексе и оставили в термостате на 5 минут, при температуре 650С. Затем центрифугировали при 12 тыс оборот/минут — 1 минуту. Затем переносили ДНК в пробирку.
Выделение ДНК из суточной культуры пастерелл с помощью автоматической станции выделения нуклеиновых кислот — Thermo Scientific King Fisher.
Пробоподготовка «Thermo Scientific King Fisher Cell and Tissue DNA Kit» проводили согласно протоколу набора. Основа набора — парамагнитные кварцевые частицы, которые связывают нуклеиновой кислоты в присутствии хаотрофических солей. После стадии связывания комплекс ДНК/магнитные частицы тщательно промывали в промывающих буферах, чтобы удалить все оставшиеся контаминанты и затем очищенную ДНК погружали в элюэнтный буфер.
Взвесь культуральных клеток в PBS-буфере промыли, затем обрабатывали лизирующим буфером (содержащий 10 мкл в-МЕ на 1000 мкл буфера), так что конечная концентрация составила 1×106 клеток/100 мкл. Затем перешли к протоколу набора.
Выделение ДНК из бактериальной культуры Pasteurella multocida проводили методом горячего лизиса. Два мл 18 ч бульонной культуры пастерелл осаждали центрифугированием при 10 000 оборотов в минуту в течение 10 минут. Осадок промывали стерильным буферным раствором PBS (10mMTris Hcl, 10mMKcl, 10 mM Mgcl2,2 mM EDTA) в два раза и вновь суспендировали 30 мкл деионизированной водой и кипятили в течение 10 минут. После кипячения, образцы поместили в слой льда в течение 30 минут. Затем, образцы центрифугировали 3000 оборотов в минуту в течение 10 минут для осаждения. Супернатант хранили при — 200C до использования.
Выделение ДНК с помощью коммерческих наборов PureLink Genomic DNA Mini Kit. Набор предназначен для выделения геномной ДНК с высоким выходом и чистотой из самых разнообразных типов образцов. Набор позволяет выделять геномную ДНК из крови, тканей, клеток, слюны, бактерий, мазков и пятен крови, формалин-фиксированных парафиновых тканей (FFPE).
Метод выделения основан на фиксации ДНК на кремневой основе в центрифужной пробирке. Для выполнения выделения ДНК требуется выполнение этапов центрифугирования. Набор включает все необходимые реагенты, буферы для промывок, протеиназу К, РНКазу, колонки и пробирки.
Ход работы: Бактериальную суспензию пастерелл центрифугировали. Затем ресуспендировали клеточный осадок в 180 мкл PureLink™ буфером. Добавили 20 мкл Протеиназы К для лизирования клетки. Все хорошо перемешивали кратким встряхиванием. Инкубировали пробирку при 55 °C, периодически встряхивая на вортексе до лизиса (от 30 минут до 4 часов). Добавили 20 мкл RNase, А к лизату, хорошо перемешали с помощью вортекса и инкубируют при комнатной температуре в течение 2 минут. Добавили 200 мкл PureLink™ Genomic Lysis/Binding Buffer и хорошо перемешивали на вортексе, чтобы получить гомогенный раствор. Добавили 200 мкл 96−100% этанола к лизату. Все хорошо перемешали путем встряхивания в течение 5 секунд для получения гомогенного раствора. Далее очистку ДНК произвели по протоколу набора.
Кроме того, для выделения ДНК Pasteurella multocida использовали методику, разработанную сотрудниками лаборатории противобактериозной биотехнологии (Заключение о выдаче инновационного патента на изобретение по заявке № 2013/1702.1, от 06.11.2013 г.).
Главными критериями при отработке оптимальных методов были концентрация и чистота препарата.
После выделения ДНК Pasteurella multocida вышеперечисленными методами проводили качественный и количественный анализ образца. Электрофорез проводили в 0,8% агарозном геле в ТАЕ-буфере. Спектрофотометрически измеряли отношение между оптическими плотностями при 260 и 280 нм. Максимум поглощения для нуклеиновых кислот регистрируется при длине волны 260 нм. Препарат ДНК считается свободным от примесей при величине отношений Е260/280 равным 1,8 и выше. Если этот показатель ниже указанного, то образец загрязнен белками или фенолом.
Результаты исследования и их обсуждения. Образцы ДНК Pasteurella multocida, с использованием сорбентов оказались невысокого качества. Отношения между оптической плотностью при длинах волн 260 и 280 нм в среднем составляли 1,65−1,7, что говорило о загрязненности ДНК белком и другими примесями. Таким образом, полученные результаты показали неэффективность этих методов.
Хорошие результаты получены при фиксации ДНК на магнитной частице и кремневой основе в центрифужной пробирке.
Отношение оптической плотности (Е260/ Е280) полученных препаратов ДНК Pasteurella multocida имело средние значение 1,81±0,04 (n=4).
Лучшие результаты были получены при использовании метода № 2013/1702.1, от 06.11.2013 г.).
Отношение оптической плотности (Е260/ Е280) полученных препаратов ДНК Pasteurella multocida имело средние значение 1,93±0,03 (n=4).
Результат качественного анализа полученного препарата ДНК при использовании метода № 2013/1702.1, от 06.11.2013 г.).
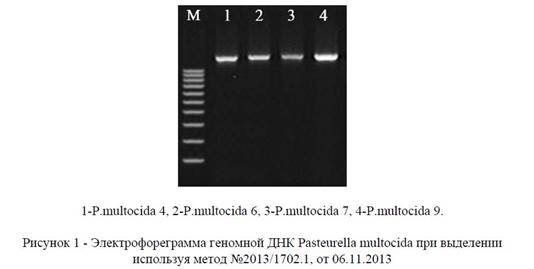
Как видно из рисунка, при использовании разработанную нами метод выделения ДНК Pasteurella multocida, результаты представлены одной четкой линией, что говорит о нативности препарата.
Таким образом, результаты качественного и количественного анализа показали, что при выделении ДНК из культур пастерелл, хорошие результаты дают использование комерческих набора PureLink Genomic DNA Mini Kit и автоматической станции выделе-ния НК — Thermo Scientific King Fisher, а также метод № 2013/1702.1, от 06.11.2013 г.
- 1. Watt J.M., Swiatlo E., Wade M.M., Champlin F.R. Regulation of capsule biosynthesis in serotype A strains of Pasteurella multocida// Microbiol Lett. -2003. Vol. 8. — Р. 9−14.
- 2. Ewers C., Lьbke-Becker A., Bethe A., Kiebling S., Filter M., Wieler H. Virulence genotype of Pasteurella multocida strains isolated from different hosts with various disease status//Vet Microbiol. -2006. — Vol.7. — Р. 3−4.
- 3. Шегидевич Э. А., Федотов В. Б., Крючков В. Я. Серотиповой состав Пастерелла мультоцида // Труды ВИЭВ. — М., 1983. — Т. — С.15−19.
- 4. Масимов К. А. Значение пастерелл (Р.multocida) при остром респираторном синдроме парагриппа-3 у телят в откормочных хозяйствах промышленного типа: автореф… канд. вет. наук. — М., 1982. — 29 с.
- 5. Gautam R., Kumar A.A., Singh V.P., Singh V.P., Dutta T.K., Shivachandra S.B. Specific identification of Pasteurella multocida serogroup-A isolates by PCR assay// Res Vet Sci. — Vol.3. -Р.179−85.
- 6. Масимов Н. А. Пастереллез животных: Лекция // Моск. Гос. Акад. вет. медицины и биотехнологии им. К. И. Скрябина. — М., 1995. — 12с.
- 7. Джупина С. И., Колосов А. А. Особенности эпизоотологии, клинического проявления и диагностики пастереллеза в Новосибирской области // Профилактики и лечение болезней крупного рогатого скота. — 1992. — № - С.15−22.
- 8. Некоторые теоретические основы полимеразной цепной реакции // ДНКТехнологии. М., 1998. 23 с.
- 9. Miflin J.K., Blackall J. Development of a 23S rRNA-based PCR assay for the identification of Pasteurella multocida//Lett Appl Microbiol. — 2001 — Vol. 33(3). — Р. — 216−219.
- 10. Liu, Lawrence M.L., Austin F.W. Специфическая идентификация ПЦР Pasteurella multocida основанный на предполагаемых транскрипционных генах регуляторах // J Microbiol Методы. — 2004. — Vol. 58 (2). — Р.263−277.
- 11. Nagai, Someno S., Yagihashi T. Differentiation of toxigenic from nontoxigenic isolates of Pasteurella multocida by PCR. // J Clin Microbiol. — 1994. — Vol.32(4). — Р. 100−115.
- 12. Fisher M.A., Weiser C., Hunter D.L., Ward A.C. Use of a polymerase chain reaction method to detect the leukotoxin gene lktA in biogroup and biovariant isolates of Pasteurella haemolytica and P trehalosi// Am J Vet Res. — 1999. — Vol. 60 (11).- Р.140−146.