Хлоридные комплексные соединения рения

Получены зеленые кристаллы K2ReOHCl5 и красные кристаллы состава K4Re2OCl10. Эти соли значительно отличаются по своим свойствам от гексахлороренатов. Строение их подтверждено измерением молекулярной электропроводности, которое показало наличие трех и пяти ионов в растворах солей соответственно. Растворы этих солей обладают прочностью K2ReCl6. Так, H2O2 на последние соединения не действует… Читать ещё >
Хлоридные комплексные соединения рения (реферат, курсовая, диплом, контрольная)
В работе Колтона сообщалось о выделении соли Cs2ReOCl6, полученной путем добавления хлористого цезия к раствору ReCl5 в концентрированной соляной кислоте, простоявшему на воздухе 20−30 часов. Однако эти данные не были воспроизведены. Брайсдоном и Эдвардсом получены комплексы рения (VI) состава (C6H5)4AsReOCl5 и (C2H5)4NReOCl5 смешиванием безводных хлороформных или дихлорметановых растворов ReOCl4 с растворами хлоридов тетрафениларсония или тетраэтиламмония в том же растворителе. Кристаллические соединения неустойчивы на воздухе и гидролизуются от влаги воздуха с образованием [(C2H5)4As]2Re2O3Cl8 и [(C2H5)4N]2Re2O3Cl8, в которых валентность рения равна шести.
В таблице 4 приведены параметры спектров поглощения синтезированных соединений в сравнении с параметрами оксихлорида ReOCl4 и оксопентахлоридного комплекса рения (V) — Cs2ReOCl5. ИК-спектры этих солей характеризуются дублетом при 970, отнесенному к связи Re — O, и полосой при 730, характерной вероятно, для связи Re — O — Re. Была выделена твердая соль оксохлоридного комплексашестивалентного рения состава (Ph)4P[ReOCl5], образующаяся при смешивании HReOCl5 (который получали при действии на H2[ReOCl5] концентрированной серной кислотой в присутствии HCl) с раствором (Ph)4PCl в концентрированной серной кислоте.
Таблица 4. Полосы поглощения () оксохлоридных соединений рения.
Соединение. | Отражение (в диапазоне 10,0 — 30,0). | Светопоглощение раствора (в диапазоне 10,0 — 50) max. | |
ReOCl4. | 12,3; 16,1;23,9. | 12,6(80); 17,4 (520); 23,3 (2000)34,5; 39,0 (5400). | |
(C6H5)4AsReOCl5. | 11,8; 18,1; 12,1. | 11,2 (12); 11,7 (13); 12,1 (12); 18,0 (160); 23,0 (1200). | |
[(C6H5)4As]2Re2O3Cl8. | 11,8; 18,1; 22,2; 24,0. | 11,6 (15); 12,0 (15); 18,2 (120); 22,2; 24,7 (300); 32,3 (2000); 42,6 (17 000). | |
(C6H5)4NReOCl5. | 11,8; 12,2; 17,1; 18,1; 27,0. | ; | |
[(C6H5)4N]2Re2O3Cl8. | 12,0; 12,3; 17,4; 18,9; 27,0. | ; | |
Cs2ReOCl5. | 10,9; 11,3; 20,6. | ; | |
Рений (V) образует в основном комплексы со связью Re — O. Все они диамагнитны. При электролизе растворов KReO4 в HCl с Pd-электродами получались изумрудно-зеленые растворы, из которых при добавлении хлорида калия выпадали желто-зеленые кристаллы состава K2ReOCl5. В сухом воздухе они устойчивы, но легко гидролизуются во влажном, переходя в гидрооксид рения (V), а затем в ReO2*H2O вследствие диспропорционирования соединений рения (V) по схеме:
3Re (V) = 2Re (IV) + Re (VII)
В концентрированной соляной кислоте кристаллы плохо растворимы; при этом раствор окрашен в желто-зеленый цвет. При разбавлении этих растворов водой растворимость увеличивается; окраска становится зеленой, затем зеленовато-золотой, после чего уже выпадает гидрооксид. В двунормальном растворе соляной кислоты быстро протекает гидролиз. При действии на кислые растворы соли окислителей — Fe (III), KMnO4, H2O2 — происходит окисление рения до. Кроме K2ReOCl5, получена соль (NH4)2ReOCl5, которая легче растворяется в HCl. Выделены также соли K2Re (OH)2Cl5, Rb2Re (OH)2Cl и Cs2Re (OH)2Cl5. Установлено, что все полученные соединения содержат рений в пятивалентном состоянии. Исследованы магнитные свойства комплексных соединений пятивалентного рения — K2ReOCl5 и Me2ReOBr5, а также комплексных соединений рения (V) с другими лигандами. Доказано, что диамагнетизм этих соединений обусловлен наличием у пятивалентного рения в комплексах двух спаренных 5d-электронов. В настоящее время химия оксогалогенидных комплексов рения (V) тщательно изучена.
Следует отметить, что термодинамическая устойчивость галогенидных комплексов рения изменяется в обратном порядке и уменьшается при переходе от к. В то время как комплекс с анионом начинает разлагаться уже под влиянием следов влаги, аналогичный комплекс с разлагается в момент растворения 1−2 секунд после растворения.
Комплексные оксихлориды состава Me2ReOCl5, где, и получены восстановлением HReO4 в HCl 2 экв. HJ с послудующим прибавлением солянокислой соли амина. Изучены термические свойства соединений оксохлороренатов (V) с аминами. Синтезирвоаны новые серии комплексных соединений рения (V) типа MReX4О, где и MReX4OL, где L — H2O или растворитель. Анион образуется при восстановлении в смеси CH3OH и концентрированной серной кислоты гранулированным цинком.
При взаимодействии HReO4 с третичными фосфинами или арсинами в этанольном растворе, содержащем HCl, образуются комплексы типа ReOCl3(PPh3)2, где Ph — фенил. Комплексы такого типа применяют в качестве исходных веществ для синтеза многих соединений рения.
Наиболее устойчивы в растворе хлоридные и оксохлоридные комплексы рения (IV). Гексахлороренат (IV) изучен лучше других комплексов рения. Синтез комплексов состава M2ReCl6, где M — и др. происходит при восстановлении KReO4 йодистым калием в растворе соляной кислоты или гипофосфорной кослотой в концентрированной соляной кислоте, при растворении ReO2 в концентрированной соляной кислоте с последующим осаждением K2ReCl6 при добавлении хлорида калия. Растворимость K2ReCl6 составляет 0,1689 и 0,0841 моль/1000 г при 250 и 0 °C соответственно. Растворы гексахлороренатов устойчивы длительное время при 20 °C, но повышение температуры или добавление щелочи вызывает гидролиз, сопровождающийся выделением гидратирвоанного оксида рения (IV), который при этом осаждается количественно.
Получены зеленые кристаллы K2ReOHCl5 и красные кристаллы состава K4Re2OCl10. Эти соли значительно отличаются по своим свойствам от гексахлороренатов. Строение их подтверждено измерением молекулярной электропроводности, которое показало наличие трех и пяти ионов в растворах солей соответственно. Растворы этих солей обладают прочностью K2ReCl6. Так, H2O2 на последние соединения не действует, K2ReOHCl5 окисляет до перрената, а двуядерный комплекс переводит сначала в K4Re2O2Cl10, который через несколько часов обесцвечивается с образованием перренат-иона. Анион образован двумя октаэдрами, связанными через атом кислорода.
Многие работы посвящены синтезу солей гексахлорорената с органическими катионами. Доказано, что в водном растворе при попытке ввести реагенты во внутреннюю сферу гексахлорорената происходит окисление Re (IV) до Re (V) с одновременным образованием комплекса состава [ReO2Py4]Cl. Для комплексов гексахлороренатов с органическими основаниями характерна низкая растворимость, что может быть использовано для разделения Re (IV) и Re (VII), а также для весового определения и экстракционного извлечения Re (IV).
Устойчива также соль типа MReCl4 (где М —), которая выделена из раствора трихлорида рения в HCl при добавлении раствора RbCl в 35%-ной соляной кислоте. Соль стабильна на воздухе, растворяется в разбавленной соляной кислоте. При термическом разложении в атмосфере азота образуются ReCl3, M2ReCl6 и металлический рений.
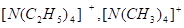
Другим типом комплексных соединений рения (III) являются двуядерные комплексы типа M2Re2Cl8 с короткой и прочной связью Re — Re без галогенных мостиков. Комплексы получены восстановлением перренат-иона в водном растворе соляной кислоты действием H3PO2 или водорода. Получены соли с катионами, с четвертичным и аммонием, фосфонием и арсонием. Структурной особенностью является очень короткое межатомное расстояние Re — Re, равное 2,24 А. Для Re (III) характерно образование многоядерных анионов. При растворении Re3Cl9 в концентрированной соляной кислоте и действии тяжелых однозарядных катионов и др. выделены соли составов M3Re3Cl12, M2Re3Cl11, и MRe3Cl10. Получен ряд смешанных комплексов при замене части ионов хлора на другие лиганды.