Результаты исследований и их обсуждение

Примечание: дорожки 1, 2, 5, 10, 12 — ДНК штаммов B. pertussis (50 штаммов); 3, 4 — ДНК штаммов B. parapertussis (20 штаммов); 6, 7 — ДНК штаммов B. bronchiseptica (8 штаммов); 8 -ДНК штамма С. glutamicum (2 штамма); 11 — ДНК штамма C. ulcerans (10 штаммов); 14 — ДНК штамма C. pseudodiphtheriticum (8 штаммов); 15, 16 — ДНК штаммов C. diphtheriae (20 штаммов); 9, 13 — ДНК штаммов S. aureus (2… Читать ещё >
Результаты исследований и их обсуждение (реферат, курсовая, диплом, контрольная)
Структура основных генов патогенности B. pertussis и особенности циркуляции возбудителя коклюша в различные периоды эпидемического процесса коклюшной инфекции
Микробиологический и молекулярно-генетический мониторинг штаммов B. pertussis позволил оценить особенности распространения и свойства штаммов возбудителя коклюша, циркулировавших в прошлые годы, и сопоставить с данными о биологических и молекулярно-генетических свойствах штаммов, циркулирующих на современном этапе развития эпидемического процесса коклюшной инфекции.
Изучена вариабельность биологических свойств 187 штаммов B. pertussis разных этапов эпидпроцесса, характеризующихся различным уровнем заболеваемости, охвата прививками, динамикой тяжести клинического течения коклюша и удельного веса штаммов различных серотипов (рис. 1):
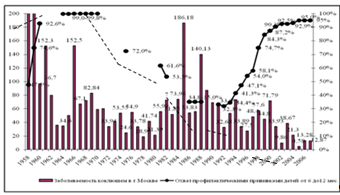
Рисунок 1 Заболеваемость коклюшем и охват профилактическими прививками в г. Москве (1958 — 2007 гг.).
I период — допрививочный и первые десять лет проведения массовой иммунизации детского населения АКДС-вакциной (1958 — 1969 гг.), II — период стабилизации заболеваемости в 70-е годы и роста заболеваемости в 80-е годы при резком уменьшении охвата профилактическими прививками (1970 — 1989 гг.) и III — период относительной стабилизации заболеваемости на фоне роста охвата прививками, который к настоящему времени достиг 95,0% (1990 — 2007 гг.).
В патогенезе заболевания коклюшем главная роль принадлежит коклюшному токсину — его энзиматически активной S1 субъединице, кодируемой ptxА геном. Вместе с тем, немаловажную роль в развитии инфекции играют другие факторы патогенности, такие как пертактин, кодируемый prn геном, фимбриальные белки, кодируемые fim2 и fim3 генами, и фактор колонизации трахеи, кодируемый tcfA геном, которые обеспечивают адгезию на поверхности чувствительных клеток эпителия и участвуют в запуске инфекционного процесса. Эти факторы патогенности B. pertussis, определяющие патогенез заболевания коклюшем, имеют важное значение при конструировании перспективных вакцинных препаратов — бесклеточных коклюшных вакцин.
Изучена динамика распространения 187 штаммов B. pertussis, выделенных в разные периоды эпидпроцесса коклюшной инфекции, и показано, что штаммы с новыми «невакцинными» (ptxA1, prn2/prn3, fim2−2 и fim3В) аллелями четырех генов, кодирующих основные факторы патогенности возбудителя коклюша — коклюшный токсин, пертактин и фимбриальные белки, постепенно вытесняют штаммы со старыми «вакцинными» (ptxA2/ptxA4, prn1, fim2−1 и fim3А) аллелями этих генов (рис. 2).
Для штаммов B. pertussis, циркулировавших в допрививочный период и первые 10 лет проведения массовой иммунизации детского населения АКДС-вакциной (I период наблюдения), характерными были «вакцинные» аллели четырех основных генов патогенности: ptxА2/ptxА4 аллели гена коклюшного токсина (в 47,0% и 53,0% случаев, соответственно), prn1 аллель гена пертактина (в 100% случаев), fim2−1 и fim3А аллели фимбриальных генов (в 89,5% и 100% случаев, соответственно).
С начала 70-х годов в популяции штаммов коклюшного микроба появились штаммы (16,7% штаммов) с новым «невакцинным» ptxА1 аллелем гена коклюшного токсина. Начиная с 80-х годов штаммы B. pertussis, имеющие «невакцинный» ptxА1 аллель гена, стали доминирующими в популяции штаммов B. pertussis и в последующие годы полностью вытеснили штаммы с «вакцинными» ptxА4 и ptxА2 аллелями этого гена.
Распространение штаммов, несущих новые «невакцинные» аллели гена пертактина и фимбриальных генов происходило более медленно. Во II периоде наблюдения (1970 — 80-е годы), продолжали циркулировать штаммы «вакцинных» аллелей: prn1 аллеля (в 89,5% случаев), fim2−1 и fim3А аллелей фимбриальных генов (в 53,3% и 53,3% случаях, соответственно), кроме того, регистрировали штаммы с «невакцинными» аллелями этих генов патогенности: prn3/prn2 аллелями (в 25,1% и 11,0% случаев, соответственно), fim2−2 и fim3 В аллелями (в 46,7% и 46,7% случаев, соответственно). Начиная с 90-х годов и до настоящего времени, в циркулирующей популяции штаммов B. pertussis, доминируют штаммы «невакцинных» аллелей этих четырех генов — ptxА1, prn2, fim2−2, fim3 В и ptxА1, prn3, fim2−2 и fim3 В.
Таким образом, вся циркулирующая популяция современных штаммов B. pertussis (в 100% случаев) имеет «невакцинный» ptxA1 аллель гена коклюшного токсина; доминируют штаммы, содержащие «невакцинные» prn2 и prn3 аллели гена пертактина (в 76,0% и 21,9% случаев, соответственно); отмечается тенденция к увеличению доли штаммов с «невакцинными» fim2−2 и fim3 В аллелями фимбриальных генов (в 53,3% и 83,4% случаев, соответственно).
«Невакцинный» ptxА1 аллель характерен для структуры гена коклюшного токсина (КТ) современных штаммов B. pertussis, он отличается от других аллелей «немолчащей» мутацией в положении 684, приводящей к замене аминокислоты метионина на изолейцин (M228I) в молекуле белка КТ. Все три вакцинных штамма B. pertussis имели «вакцинные» (№ 475 — ptxА4, № 267 и № 305 — ptxА2) аллели гена КТ.
Наиболее существенные изменения произошли в структуре гена пертактина. Вакцинные штаммы характеризовались наличием «вакцинного» prn1 аллеля гена пертактина. «Невакцинные» аллели prn2 и prn3 отличались от «вакцинного» аллеля «немолчащими» мутациями в положениях 832 — 834, приводящими к замене аминокислоты аланина на фенилаланин (А278F), и мутацией в положении 836 с заменой аминокислоты валин на глицин (V279G), а также наличием у prn2 аллеля дополнительного фрагмента в 15 п.н., которые кодируют новые аминокислоты в белковой молекуле пертактина, что существенно отличает её от молекулы белка пертактина вакцинных штаммов.
Значительно меньшие изменения обнаружены в fim2 и fim3 генах, кодирующих фимбриальные белки. Структура fim2 и fim3 генов циркулирующих штаммов B. pertussis соответствовала одному из двух аллелей fim2 гена и одному из трех аллелей fim3 гена. Вакцинные штаммы характеризовались наличием «вакцинных» (fim2−2 и fim3А) аллелей фимбриальных генов. У «невакцинного» fim2−2 аллеля обнаружена «молчащая» мутация в положении 521, не приводящая к изменению на аминокислотном уровне. Вместе с тем, в «невакцинном» fim3 В аллеле выявлена «немолчащая» мутация в положении 260, сопровождающаяся заменой аланина на глутаминовую кислоту (А87Е), что является контрастной заменой и оказывает влияние на функциональное состояние белка.
Следовательно, генетическая структура современных штаммов B. рertussis с новыми «невакцинными» аллелями генов, кодирующих основные факторы патогенности возбудителя коклюша, отличается от генетической структуры вакцинных штаммов, входящих в АКДС-вакцину, что является весомым основанием для выбора и использования новых штаммов при конструировании АКДС-вакцины (табл. 1).
Все изученные штаммы B. pertussis, независимо от периода эпидемического процесса коклюшной инфекции, также как и три производственных вакцинных штамма, были однородны и имели одинаковую структуру tcfA гена — «вакцинный» tcfA2 аллель. Другими словами, изменений в tcfA гене, кодирующем фактор колонизации трахеи, оказывающим существенное влияние на процесс адгезии и колонизации возбудителя коклюша в респираторном эпителии дыхательных путей, не обнаружено.
Таблица 1.
Сопоставление структуры генов коклюшного токсина (ptxA), пертактина (prn) и фимбриальных (fim2 и fim3) у современных штаммов B. pertussis (2002 — 2007 гг.) и штаммов B. pertussis, входящих в АКДС-вакцину.
Штаммы B. pertussis. | ptxA ген. | рrn ген. | fim2 ген. | fim3 ген. | |
от больных коклюшем (70 шт.). | ptxA1 (100%). | prn1 (2,4%). prn2 (75,8%). prn3 (21,8%). | fim2−1 (33,3%). fim2−2 (66,7%). | fim3A (12,5%). fim3B (87,5%). | |
Вакцинные штаммы. № 267 1.0.3. № 305 1.2.0. № 475 1.2.3. | ptxA2. ptxA2. ptxA4. | рrn1. рrn1. рrn1. | fim2−1. fim2−1. fim2−1. | fim3A. fim3A. fim3A. | |
Вирулентные свойства штаммов B. pertussis, выделенных на современном этапе эпидпроцесса коклюшной инфекции, изучены в пробе in vivo на мышах. Патогенные свойства штаммов B. pertussis оценивали по вирулентности и лейкоцитозстимулирующей активности.
Анализ данных литературы по изучению вирулентных и токсических свойств штаммов B. рertussis прошлых лет и собственных исследований современных штаммов позволил получить полное представление о свойствах возбудителя коклюша в процессе его циркуляции в различные периоды эпидпроцесса (рис. 3).
Показано, что в 60-е годы прошлого столетия в популяции возбудителя коклюша преобладали высокопатогенные штаммы. Начиная с 70-х годов, в течение 10 лет, стали регистрировать единичные штаммы с новыми «невакцинными» аллелями генов основных факторов патогенности возбудителя коклюша. При этом высокопатогенных штаммов не выявляли.
В 80-е годы, т. е. в период снижения охвата профилактическими прививками и закрепления в популяции штаммов B. рertussis с «невакцинными» аллелями, среди циркулирующих штаммов появились высокопатогенные штаммы B. рertussis, удельный вес которых составил 6,0% - 8,0%, а к началу 90-х годов, когда штаммы с «невакцинными» аллелями заняли доминирующее положение, удельный вес высокопатогенных штаммов вырос до 11,1%. В настоящее время, когда охват профилактическими прививками достиг 95,0%, циркулируют штаммы B. рertussis с новыми «невакцинными» аллелями генов, кодирующих основные факторы патогенности, и в 72,7% случаев — с высокой степенью патогенности.
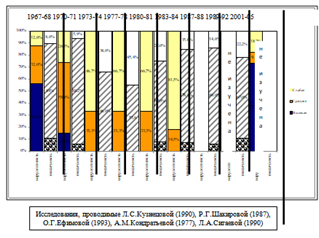
Рисунок 3 Патогенные свойства штаммов B. рertussis, выделенных в 1967 — 2005 гг.
Штаммы B. pertussis с мутационными изменениями в гене коклюшного токсина, гене пертактина и фимбриальном гене, обнаружены еще в начале 70-х годов (рис. 2), т. е. через 10 лет проведения массовой иммунизации детского населения АКДС-вакциной в период стабилизации заболеваемости и высокого охвата прививками. Однако широкое распространение этих новых аллелей происходило в 80 — 90-е годы, когда процент охвата прививками не превышал 32,0% - 33,4%. В это время распространились штаммы B. pertussis с новыми «невакцинными» аллелями генов коклюшного токсина, пертактина и фимбриальных белков. Появившиеся мутационные изменения в геноме возбудителя коклюша оказались «успешными» для циркулирующей популяции и в последующих поколениях получили преимущественное распространение. Можно полагать, что период отсутствия или снижения охвата прививками явился «стрессовым» фактором, позволившим «закрепиться» новым мутационным изменениям в циркулирующей популяции и «запустить» распространение высокопатогенных штаммов B. pertussis с новыми «невакцинными» аллелями генов, т. е. имеющих новую генетическую структуру основных факторов патогенности.
Нами подобраны три штамма B. рertussis — кандидата для вакцинных препаратов: № 186−01 (серотипа 1.0.3) с ptxA1, prn2, fim2−2 и fim3 В аллелями, № 178−03 (серотипа 1.2.0) с ptxA1, prn3, fim2−2 и fim3 В аллелями и № 19−05 (серотипа 1.0.3) с ptxA1, prn2, fim2−2, fim3А аллелями генов. Предварительные исследования иммунобиологических свойств этих штаммов показали возможности использования их в качестве кандидатов для конструирования вакцинных препаратов.
Особенности структуры tox гена, кодирующего синтез дифтерийного токсина С. diphtheriae
При постановке задач по изучению дифтерийной инфекции были учтены результаты совместных исследований, проводимых ранее в Федеральной референс лаборатории диагностики дифтерийной инфекции ФГУН «МНИИЭМ им. Г. Н. Габричевского Роспотребнадзора» (руководитель — д.м.н., профессор И.К. Мазурова) по изучению фенои генотипических свойств С. diphtheriae, выявлению особенностей формирования структуры популяции и раскрытию механизмов эпидемического распространения возбудителя дифтерии.
Полная нуклеотидная последовательность tox гена секвенирована у 45 штаммов С. diphtheriae (табл. 2). У 18 штаммов С. diphtheriae (в 40,0% случаев) последовательность нуклеотидов структурного tox гена соответствовала последовательности нуклеотидов этого гена производственного вакцинного штамма С. diphtheriae PW 8. В тоже время у 27 штаммов (в 60,0% случаев) в последовательности нуклеотидов обнаружены точечные мутации в 7 положениях. При этом, мутации в 6 положениях не приводили к замене аминокислот и только в позиции 1252 мутация сопровождалась изменением аминокислотного состава белка дифтерийного токсина.
Мутационные изменения у штаммов C. diphtheriae встречались в различных сочетаниях (табл. 4). У большинства штаммов C. diphtheriae (в 66,7% случаях) замены нуклеотидов были только в одном из трех положений, у 11,1% штаммов — в двух и у 22,2% штаммов — в трех положениях. Частота встречаемости выявленных мутаций в tox гене штаммов С. diphtheriae была различная (табл. 3).
Таблица 2.
Замены нуклеотидов в tox гене у штаммов С. diphtheriae по сравнению со структурой tox гена штамма С. diphtheriae PW 8.
Штаммы С. diphtheriae. | Количество штаммов. | Положение нуклеотида в нуклеотидной последовательности гена ДТ. | |||||||
Промотор-ная обл. | Фрагмент А. | Фрагмент В. | 3'некодирую-щая область. | ||||||
— 58. | |||||||||
PW 8 (производственный). | с. | t. | g. | g. | g. | g. | t. | ||
от больных и бактерионосителей без изменений нуклеотидных последовательностей. | c. | t. | g. | g. | g. | g. | t. | ||
от больных и бактерионосителей с изменениями нуклеотидных последовательностей. | t. | c. | a. | a. | c! | a. | c. | ||
Во фрагменте, А tox гена только у одного штамма С. diphtheriae обнаружили замену нуклеотида, не приводящую к замене аминокислоты в белке дифтерийного токсина, что подтверждает консервативность, А фрагмента tox гена. У большинства штаммов С. diphtheriae (в 75,0% случаях) мутационные изменения зарегистрированы в В фрагменте структурного tox гена, из них у 44,4% штаммов мутации выявлены в положении 1233. Обнаруженные мутации также не приводили к изменениям на аминокислотном уровне, за исключением замены нуклеотида в положении 1252, выявленной у двух штаммов биовара mitis, которая повлекла за собой изменение состава аминокислот — глицина на аргинин в положении 393 (G393R), что может оказывать влияние на конформацию и, следовательно, функциональные свойства белка дифтерийного токсина.
Таблица 3.
Сочетания мутационных изменений в tox гене ДТ.
Штаммы С. diphtheriae. | Количество шта-ов. | Положение нуклеотида в нуклеотидной последовательности гена ДТ. | |||||||
Промотор-ная область. | Фрагмент А. | Фрагмент В. | 3' некодирую-щая область. | ||||||
— 58. | |||||||||
PW 8 (производственный). | c. | t. | g. | g. | g. | g. | t. | ||
выделенные от больных и бактерионосителей. | *. | *. | *. | *. | *. | *. | c. | ||
*. | *. | *. | *. | *. | a. | c. | |||
*. | *. | *. | a. | *. | *. | *. | |||
*. | *. | a. | *. | *. | a. | c. | |||
*. | c. | *. | *. | *. | *. | *. | |||
*. | *. | *. | a. | *. | *. | c. | |||
*. | *. | *. | a. | c! | *. | c. | |||
t. | *. | a. | *. | *. | *. | с. | |||
Частота распространения мутаций (%). | 2,2. | 2,2. | 8,8. | 44,4. | 4,4. | 8,8. | 29,2. | ||
Нами проведен мониторинг штаммов C. diphtheriae для обнаружения выявленной мутации в положении 1252. Секвенирован фрагмент tox гена размером 760 п.н. (положение нуклеотидов 991 — 1751) у 35 штаммов C. diphtheriae биовара mitis, выделенных в различных регионах России. В результате проведенного исследования оказалось, что у всех 35 штаммов C. diphtheriae биовара mitis мутация в положении 1252 не выявлена.
Таким образом, обнаружено, что у большинства штаммов C. diphtheriae (в 60,0% случаях) имеются единичные мутации в структурном tox гене, которые не сказываются на первичной структуре белка дифтерийного токсина, и только у 2 штаммов C. diphtheriae (в 2,5% случаях) выявлена мутация (замена нуклеотида в положении 1252), которая приводит к контрастной замене аминокислот, что может оказывать влияние на функциональное состояние белка дифтерийного токсина. Появление даже единичных штаммов со значительными мутационными изменениями в tox гене дифтерийного токсина у циркулирующих штаммов свидетельствует о «подвижности» генетической структуры C. diphtheriae, что может привести к снижению эффективности анатоксина, полученного из токсина C. diphtheriae PW8. С другой стороны, накопление штаммов с множественными мутационными изменениями, не приводящими к аминокислотным изменениям, также может влиять на формирование генетической вариабельности вида и, вероятно, создает резерв изменчивости возбудителя дифтерии в меняющихся условиях существования.
Особенности структуры генетической детерминанты амилазной активности штаммов C. diphtheriae
Другим фактором патогенности C. diphtheriae, не связанным с токсическим компонентом, является способность возбудителя синтезировать фермент амилазу, который утилизирует углеводы, и тем самым создает дополнительный источник энергии для ускорения процессов генерации, роста на питательных средах и колонизации на слизистых оболочках человека.
Анализ структуры генома возбудителя дифтерии позволил нам выявить в островке патогенности, включающем локусы DIP0334 — DIP0357, нуклеотидную последовательность — amy ген, кодирующий синтез амилазы, отвечающей за расщепление углеводов. Было сконструировано 10 пар праймеров, фланкирующих 10 взаимоперекрывающихся участков amy гена (рис. 4).
После амплификации (рис. 5) выбранных областей специфические светящиеся фрагменты выявили только в образцах, содержащих ДНК штаммов C. diphtheriae биовара gravis и не обнаружили в образцах, содержащих ДНК штаммов C. diphtheriae биовара mitis. Был проведен мониторинг 87 штаммов C. diphtheriae биоваров gravis и mitis, выделенных от больных и бактерионосителей в различные периоды эпидемического процесса дифтерийной инфекции, на наличие фрагментов amy гена. Показано, что все образцы ДНК из 31 штаммов C. diphtheriae биовара gravis содержали специфический фрагмент ДНК, в то время как в 56 образцах, содержащих ДНК штаммов C. diphtheriae биовара mitis, данный фрагмент гена не регистрировали.
Рисунок 4 Схема расположения праймеров, фланкирующих фрагменты amy гена
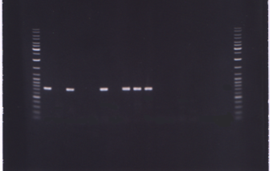
Рисунок 5 Фотография фрагмента 1,5% агарозного геля, содержащего электрофоретически разогнанные продукты ПЦР с использованием специфических праймеров Amy3 °F — Amy3R к последовательности фрагмента amy гена.
Примечание: дорожки 1, 18 — маркер молекулярных весов; 2, 4, 7, 9, 10, 11 — ДНК штаммов C. diphtheriae биовара gravis; 3, 5, 6, 8, 12, 13, 14 — ДНК штаммов C. diphtheriae биовара mitis; 15, 16, 17 — отрицательные контроли.
Следующим этапом исследования явилось установление размера делеции. Анализ последовательности нуклеотидов в геноме штамма C. diphtheriae показал, что перед аmy геном расположен ген DIP0354. После проведения амплификации со специфическими праймерами и электрофореза регистрировали ПЦР — продукты во всех образцах, содержащих ДНК штаммов C. diphtheriae биовара gravis, и отсутствие таких фрагментов при исследовании образцов, содержащих ДНК штаммов C. diphtheriae биовара mitis.
Для установления начала делеции провели анализ последовательности нуклеотидов генома C. diphtheriae и сконструировали две пары праймеров (рис.6): первая пара праймеров фланкировала область DIP0353 — DIP0354 размером 285 п.н., охватывающую фрагмент гена DIP0353 и фрагмент гена DIP0354; другая пара — фланкировала область DIP3 532 °F — DIP03532R размером 225 п.н., охватывающую фрагмент гена DIP0353.
После амплификации и электрофореза с парой праймеров DIP3 531 °F — DIP03541R выявлены ПЦР — продукты в образцах, содержащих ДНК штаммов C. diphtheriae биовара gravis и отсутствие данных ПЦР — продуктов в образцах, содержащих ДНК штаммов C. diphtheriae биовара mitis (рис. 7А). После амплификации со второй парой праймеров (DIP0353 2 °F — DIP0353 2R) получили ПЦР — продукты в образцах, содержащих ДНК, как штаммов C. diphtheriae биовара gravis, так и штаммов C. diphtheriae биовара mitis (рис. 7Б).
Рисунок 6 Схема расположения праймеров, фланкирующих фрагменты генов DIP0354, DIP0357 (amy ген) и DIP0358 C. diphtheriae
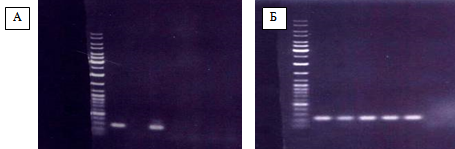
Рисунок 7 Фотография фрагмента 1,5% агарозного геля, содержащего электрофоретически разогнанные продукты ПЦР с использованием праймеров DIP3 531 °F — DIP03541R к последовательности фрагмента локуса DIP0353 — DIP0354 (А) и продукты ПЦР с использованием праймеров DIP3 532 °F — DIP03532R к последовательности фрагмента гена DIP0353 (Б) C. Diphtheriae.
Примечание: дорожки 1 — маркер молекулярных весов; 2, 4 — ДНК штаммов C. diphtheriae биовара gravis; 3, 5, 6 — ДНК штаммов C. diphtheriae биовара mitis.
Для определения конца делеции также сконструировали две пары праймеров (рис. 6): первая пара фланкировала область DIP0357 — DIP0358 размером 307 п.н., охватывающую фрагмент гена DIP0357 (аmy ген) и фрагмент гена DIP0358, кодирующего синтез ацил-CoA-синтазы. После амплификации с этой парой праймеров (рис. 8А) выявлены ПЦР — продукты в образцах, содержащих ДНК штаммов C. diphtheriae биовара gravis и отсутствие ПЦР — продуктов в образцах, содержащих ДНК штаммов C. diphtheriae биовара mitis. Другая пара праймеров фланкировала фрагмент гена DIP0358 размером в 210 п.н. После амплификации с этой парой праймеров (рис. 8Б) получили ПЦР — продукты в образцах, содержащих ДНК, как штаммов C. diphtheriae биовара gravis, так и штаммов C. diphtheriae биовара mitis.
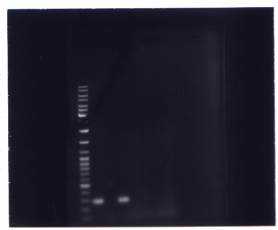
Рисунок 8 Фотография фрагмента 1,5% агарозного геля, содержащего электрофоретически разогнанные продукты ПЦР с использованием праймеров DIP0357FDIP0358R к последовательности фрагмента локуса DIP0357 — DIP0358 (А) и продукты ПЦР с использованием праймеров DIP3 582 °F — DIP0358yR к последовательности фрагмента гена DIP0358 (Б) C. diphtheriae.
Примечание: дорожки 1 — маркер молекулярных весов; 2, 4 — ДНК штаммов C. diphtheriae биовара gravis; 3, 5, 6 — ДНК штаммов C. diphtheriae биовара mitis.
Таким образом, полученные результаты свидетельствуют в пользу того, что в геноме штаммов C. diphtheriae биовара mitis отсутствуют локусы DIP0354 — DIP0357 (amy ген) и, следовательно, эти штаммы не обладают амилазной активностью.
Способностью штаммов C. diphtheriae биовара gravis продуцировать амилазу и использовать дополнительные источники энергии (углеводы) можно объяснить различия и во времени генерации (in vitro) штаммов биоваров gravis и mitis. У штаммов биовара gravis оно составляет 60 минут, в то время как у штаммов биовара mitis — 180 минут. Быстрорастущие штаммы, формирующие колонии большего размера на питательной среде и на слизистых человека, имеют возможность более быстрого захвата железа из инфицированных тканей, что приводит к более ранней и высокой продукции дифтерийного токсина. При изучении уровня токсинообразования (УТ) штаммов C. diphtheriae двух биоваров нами показано, что у штаммов биовара gravis УТ в два раза превышал УТ штаммов биовара mitis (Борисова О.Ю., 1999; Комбарова С. Ю. и др., 2004; Мазурова И. К., 1993; Мазурова И. К. и др., 1999). Поэтому, взаимосвязь между тяжестью клинического течения дифтерии и выделением возбудителя биовара gravis можно объяснить высоким уровнем продукции дифтерийного токсина и быстрой колонизацией слизистой ротоглотки штаммами этого биовара. Так, совместные многолетние клинико-микробиологические исследования, проводимые сотрудниками лаборатории ФРЛДДИ совместно с Т. В. Платоновой показали, что в 90-е годы, в период эпидемического подъема заболеваемости дифтерией, формировалась генетически однородная высокотоксигенная популяция C. diphtheriae. При этом от больных выделяли штаммы биовара gravis и наблюдали утяжеление клинической картины дифтерии у непривитых детей, по сравнению с 80-ми годами ХХ века, когда у больных выделяли штаммы C. diphtheriae биовара mitis. Такое наблюдение подкрепляется и данными литературы, показавшими более тяжелую клиническую картину дифтерии при выделении штаммов C. diphtheriae биовара gravis (Нисевич Н.И., 1947; Хрущева В. А., 1964; Корженкова М. П., 2002, 2006).
Способность штаммов C. diphtheriae биовара gravis продуцировать амилазу создает преимущества перед штаммами биовара mitis в скорости роста и, что, наряду с другими особенностями структуры биовара gravis, определяет более широкое и длительное распространение этого биовара. Показано, что период распространения штаммов C. diphtheriae биовара mitis (в 80-ые годы прошлого столетия) составил 7 — 8 лет, в то время как штаммы биовара gravis доминировали и циркулировали многие десятилетия — в 40 — 70-е годы и в течение последних 18 лет (Борисова О.Ю., 1999; Комбарова С. Ю., 2004, 2007; Мазурова И. К., 1993, 1997, 1999).
Таким образом, исследование показало, что только штаммы C. diphtheriae биовара gravis несут генетическую детерминанту — amy ген, определяющую дополнительный фактор патогенности — фермент амилазу, дающий микроорганизму лучшие возможности колонизировать слизистые оболочки ротоглотки и, вследствие этого, более широко и длительно циркулировать среди населения, в то время как штаммы C. diphtheriae биовара mitis, в том числе и производственный вакцинный штамм C. diphtheriae PW8, имеют делецию фрагмента генома, включающего гены DIP0354 — DIP0357.
Разработка ускоренных методов, основанных на амплификационных технологиях, для наблюдения и выявления возбудителя коклюша
Новые знания о структуре генетических детерминант, кодирующих основные факторы патогенности, их мутационных изменениях, особенностях циркулирующих штаммов B. pertussis позволили подобрать специфические «мишени» и разработать на их основе новые молекулярно-генетические методы наблюдения и диагностики за возбудителями коклюша и дифтерии.
Современный мониторинг и лабораторная диагностика инфекционных заболеваний, базирующиеся на молекулярно-генетических методах исследования, выявляют специфические генетические «мишени» и с большей достоверностью, по сравнению с фенотипической диагностикой, идентифицируют возбудителей инфекций, а также значительно сокращают сроки исследования.
Молекулярно-генетический метод, основанный на полиморфизме длин рестрикционных фрагментов, для ускоренного выявления штаммов B. pertussis, циркулирующих на современном этапе
Нами разработан новый молекулярно-генетический метод мониторинга штаммов B. pertussis, основанный на изучении полиморфизма длин рестрикционных фрагментов амплифицированных продуктов (ПЦР-ПДРФ). Метод базируется на выявлении специфических генетических «мишеней», дифференцирующих штаммы с новыми особенностями структуры ptxА гена, кодирующего основной фактор патогенности возбудителя коклюша — коклюшный токсин. Метод позволяет после проведения рестрикции амплифицированного определенного фрагмента ДНК специфической рестриктазой и последующего электрофореза, получить характерный рестрикционный профиль, являющийся генетическим «маркером», тесно связанным с генотипом микроорганизма. Учитывая выявленные особенности структуры различных аллелей ptxА гена (рис. 9), выбран фрагмент ДНК этого гена и подобраны две рестриктазы (EheI и BfuI), с помощью которых получен специфический рестрикционный профиль ДНК (рис. 10).
Наличие мутации в положении 684 ptxA1 аллеля (рис. 9), создающей сайт рестрикции для фермента-рестриктазы EheI, определило выбор специфической «мишени» для дифференциации штаммов B. pertussis, имеющих новый «невакцинный» ptxА1 аллель гена от штаммов, несущих старые «вакцинные» аллели (рис. 10А). Наличие мутации в положении 586, создающей сайт рестрикции для рестриктазы BfuI, определило выбор другой специфической «мишени», с помощью которой можно дифференцировать штаммы B. pertussis с уникальным ptxА5 аллелем гена от штаммов с другими аллелями (рис. 10Б).
* 196 204 586 684 696.
ptxA2 GTG CTC GAC CAT CTG -//- GAG TAT T CC AAC GCT -//- CGC ATG GCG CCG GTG ATA GGC.
ptxA4 GTG CTC GAА CAT CTG -//- GAG TAT T CC AAC GCT -//- CGC ATG GCG CCG GTG GTG GGC.
ptxA5 GTG CTC GAА CAT CTG -//- GAG TAT С CC AAC GC T -//- CGC ATG GCG CCG GTG ATG GGC.
ptxA1 GTG CTC GAC CAT CTG -//- GAG TAT T CC AAC GCT -//- CGC ATA GCG CCG GTG ATA GGC.
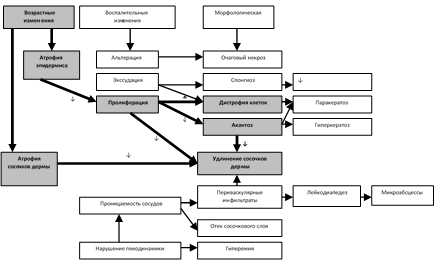
Рисунок 9 Сайты рестрикции для ферментов-рестриктаз EheI и BfuI.
Примечание: показаны четыре аллели ptxА гена; положения нуклеотидов относительно стартового кодона AJ245366.
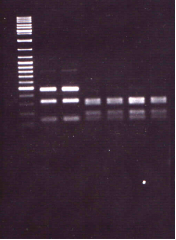
Рисунок 10 Профили рестрикции штаммов B. pertussis, полученные после обработки ампликонов рестриктазой EheI (А) и BfuI (Б).
Примечание А: Дорожки: 1 — маркер молекулярных весов DNA Ladder Mix; 2, 3 — рестрикционный профиль тип 1 (EheI); 4, 5, 6, 7 — рестрикционный профиль тип 2 (EheI).
Б: Дорожки: 1 — маркер молекулярных весов DNA Ladder Mix; 4 — рестрикционный профиль тип I (BfuI); 2, 3, 5 — рестрикционный профиль тип II (BfuI).
Для подтверждения возможностей использования нового метода для мониторинга штаммов возбудителя коклюша, изучен 121 штамм B. pertussis и показана полная корреляция между результатами рестрикционного анализа и секвенирования.
Разработанный нами новый метод типирования штаммов B. pertussis может явиться инструментом в системе мониторинга коклюшной инфекции, позволяющим проводить наблюдение за циркулирующей популяцией штаммов B. pertussis, выявлять штаммы с измененной структурой ptxА гена и следить за их распространением. На новый молекулярно-генетический способ типирования штаммов B. pertussis, имеющих различную структуру гена коклюшного токсина, получен патент на изобретение № 2 299 908, зарегистрированный в Государственном реестре изобретений Российской Федерации 27 мая 2007 г.
Прямой ускоренный молекулярно-генетический метод лабораторной диагностики коклюшной инфекции
Лабораторная диагностика коклюша в России до сих пор основана на микробиологических методах исследования, которые являются недостаточно чувствительными и эффективными. Серологические методы диагностики используются для ретроспективного анализа, так как эффективны только на 4-ой неделе заболевания. Все используемые в настоящее время амплификационные технологии не обладают высокой специфичностью, чувствительностью и дают ложноположительные результаты из-за большой гомологии геномов представителей рода Bordetella.
Нами впервые разработан прямой, ускоренный и эффективный метод лабораторной диагностики коклюша — LAMP-вариант, основанный на современной изотермальной амплификационной технологии. Первым этапом разработки нового метода было воспроизведение LAMP-технологии. Использование этой технологии представляло серьезные затруднения вследствие отсутствия реагентов, используемых в LAMP, трудности их приобретения, а также их высокой стоимости. Поэтому были проведены предварительные эксперименты по оптимизации параметров амплификации — подобраны реагенты, отработаны концентрации и условия постановки реакции. Разработанный протокол исследования изучен на большой панели микроорганизмов (рис. 11). Обнаружено, что для всех образцов, содержащих ДНК штаммов B. pertussis, характерными были светящиеся специфические Ladder-подобные профили. Во всех остальных образцах, содержащих ДНК штаммов других микроорганизмов, регистрировали отрицательный результат.
Данный метод с разработанным нами составом реакционной смеси был воспроизводим, что подтверждено серией повторяющихся экспериментов. Во всех сериях опытов отмечали постоянство профилей LAMP-ампликонов штаммов B. pertussis.
Вместе с тем, такой вариант применим только при изучении «чистой» культуры возбудителя коклюша. Поэтому, перед нами стояла цель разработки прямого метода ускоренной лабораторной диагностики коклюша для выявления возбудителя непосредственно из клинического материала (с тампонов от больных коклюшем).
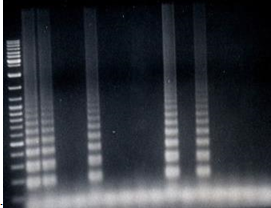
Рисунок 11 Профили LAMP-ампликонов штаммов B. pertussis, B. parapertussis, B. bronchiseptica, С. glutamicum, C. ulcerans, C. pseudodiphtheriticum, C. diphtheriae и S. Aureus.
Примечание: дорожки 1, 2, 5, 10, 12 — ДНК штаммов B. pertussis (50 штаммов); 3, 4 — ДНК штаммов B. parapertussis (20 штаммов); 6, 7 — ДНК штаммов B. bronchiseptica (8 штаммов); 8 -ДНК штамма С. glutamicum (2 штамма); 11 — ДНК штамма C. ulcerans (10 штаммов); 14 — ДНК штамма C. pseudodiphtheriticum (8 штаммов); 15, 16 — ДНК штаммов C. diphtheriae (20 штаммов); 9, 13 — ДНК штаммов S. aureus (2 штамма) Чувствительность амплификационных технологий высока только при работе с «чистыми» культурами микроорганизмов и автоматически не распространяется на чувствительность метода при работе с клиническим материалом, где на эффективность метода влияет методика подготовки клинического образца, способ выделения ДНК, освобождение от ингибиторов фермента амплификации, а также низкая концентрация первичной матрицы в малом объеме клинического образца. Разработка прямого молекулярно-генетического метода включала несколько этапов экспериментальных исследований: предварительную обработку клинического образца (смыв клинического материала с тампона от больного и его первичная обработка), подготовку клинического образца (разрушение клеточной стенки возбудителя коклюша в клиническом образце различными детергентами), выделение ДНК из клинического материала (изучены методы выделения ДНК с использованием сорбентов, детергентов, магнитных частиц, а также метода кипячения).
В результате большого числа предварительных экспериментов показано, что прямой ускоренный метод лабораторной диагностики коклюша LAMP-вариант обладает высокой специфичностью в 100% случаев, высокой чувствительностью — выявляет 103 м.кл. возбудителя и позволяет идентифицировать возбудителя заболевания в течение 9 -10 часов от начала исследования непосредственно в клиническом материале от больного без этапа выделения «чистой» культуры.
Клинические испытания прямого ускоренного молекулярно-генетического метода LAMP-варианта
Применение LAMP-варианта для ускоренного выявления B. pertussis в клиническом материале больных коклюшем. Обследовано 86 больных, из них 53 больных с клиническим диагнозом «коклюш» разной степени тяжести (у 9,4% больных коклюш протекал в легкой форме, у 66,0% - в среднетяжелой форме и у 24,6% - в тяжелой форме), обследованных на различные сроки от начала заболевания (7,5% больных обследованы на 1ой неделе заболевания; 30,2% - на 2ой; 41,5% - на 3ьей; 15,1% - на 4ой и 5,7% - на 5ой неделях заболевания) и 33 больных с другими заболеваниями верхних дыхательных путей. Основную группу больных коклюшем (67,9%) составили дети в возрасте до 1 года, обследованных на 2ой — 3ьей неделях заболевания.
Клинический материал от 86 больных коклюшем и из контрольной группы изучали одновременно в разработанном молекулярно-генетическом методе — LAMP-варианте и в классическом бактериологическом методе. Проведенные клинические испытания прямого метода LAMP-варианта, показали его высокую специфичность и высокую диагностическую эффективность, по сравнению с бактериологическим методом (рис. 12). Из 53 больных с диагнозом «коклюш», у 35 больных (в 66,0% случаях) клинический диагноз подтвержден только в LAMP-варианте; у 10 больных (в 18,9% случаях) диагноз подтвержден в LAMP-варианте и в бактериологическом методе; у 2 больных (в 3,8% случаях) диагноз подтвержден только в бактериологическом методе и у 6 больных (в 11,3% случаях) клинический диагноз не был подтвержден ни в одном из используемых методов. При сопоставлении эффективности LAMP-варианта и бактериологического метода показано, что из 53 больных коклюшем, у 45 больных клинический диагноз «коклюш» был подтвержден в LAMP-варианте, т. е. процент совпадений клинического диагноза и результатов разработанного метода составил 84,9% ± 4,9% (р < 0,001). В то время как бактериологическое подтверждение клинического диагноза «коклюш» было лишь в 12 случаях, что составило 22,7% ± 5,7% (р < 0,001).
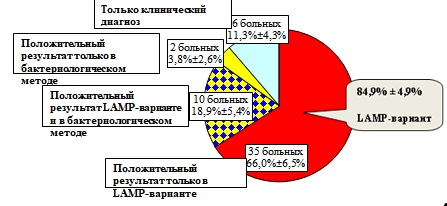
Рисунок 12 Диагностическая эффективность LAMP-варианта при сравнении с бактериологическим методом при обследовании 53 больных с клиническим диагнозом «коклюш».
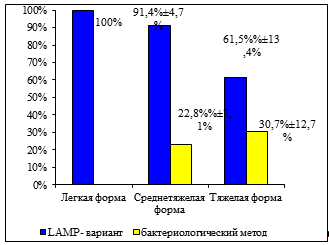
Рисунок 13 Сравнение эффективности LAMP-варианта и бактериологического метода в зависимости от формы заболевания коклюшем.
Высокая диагностическая эффективность LAMP-варианта показана при обследовании больных с различными клиническими формами заболевания (рис. 13) — не только при среднетяжелых (в 91,4% случаев) и тяжелых формах (в 61,5% случаев), но и при легких формах заболевания (в 100% случаев). В тоже время бактериологическим методом возбудитель коклюша выявлен в небольшом проценте случаев только при среднетяжелых (в 22,8% случаях) и тяжелых формах заболевания (в 30,7% случаях).
Высокая эффективность LAMP-варианта показана также при обследовании больных коклюшем в различные сроки от начала заболевания (рис. 14) — от 72,7% на 3ьей неделе, 87,5% на 4ой неделе заболевания до 100% на 1ой, 2ой и 5ой неделях заболевания. Бактериологическим методом удалось выявить возбудителя коклюша лишь в небольшом проценте случаев и то, только на 3ьей и на 4ой неделях заболевания.
С целью определения специфичности разработанного метода взята контрольная группа больных — 33 человека с диагнозами «ОРВИ», «лакунарная ангина», «респираторный микоплазмоз» и др. Исследование клинических образцов, полученных от этих больных, в разработанном LAMP-варианте показало, что у всех 33 больных, т. е. в 100% случаев, были отрицательные результаты, также как и при бактериологическом обследовании.
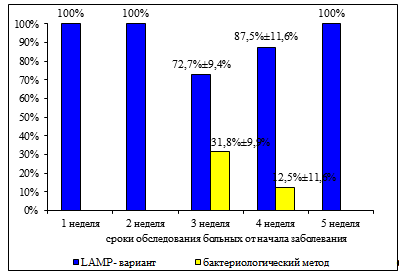
Рисунок 14 Сравнение эффективности разработанного метода ускоренной диагностики коклюша и бактериологического метода в зависимости от сроков обследования больных коклюшем.
Таким образом, использование LAMP-варианта расширило возможности эффективного обследования больных, как с различной тяжестью клинического течения болезни, так и в различные сроки от начала заболевания (с ранних сроков и вплоть до 31 дня болезни, т. е. даже в период обратного развития заболевания), а также при обследовании детей до 1 года, детей с коклюшем, осложненным другими заболеваниями и в очагах инфекции, в первую очередь, в детских специализированных учреждениях. Разработанный метод применим для быстрого подтверждения или опровержения клинического диагноза «коклюш», в то время как бактериологический метод обладает низкой диагностической эффективностью (10,0%) и длительностью выдачи ответа (5 — 7 дней).
Приведем несколько примеров эффективного использования нового прямого ускоренного молекулярно-генетического метода — LAMP-варианта при обследовании больных с подозрением на коклюш.
Ребенок А. (11 мес.) госпитализирован в ИКБ № 1 с предварительным диагнозом «коклюш» из Дома ребенка № 2 СЗАО г. Москвы. При обследовании группы контактных лиц (10 детей и 10 взрослых) бактериологическим методом и разработанным ускоренным методом — LAMP-вариантом в течение суток был выявлен ребенок Г. (11 мес.) с положительным результатом в LAMP-варианте, что позволило быстро удалить его из очага коклюша и госпитализировать также в инфекционное отделение с диагнозом «коклюш». Однако, бактериологическое подтверждение этого случая было получено только через 6 дней. Следовательно, применение LAMP-варианта позволило провести быстрое обследование очага коклюшной инфекции, выявить заболевшего ребенка и своевременно изолировать его от остальных детей грудничкового возраста, тем самым предотвратив распространение инфекции.
Ребенок М. (4 мес.) с серьезной патологией сердечно-сосудистой системы переведен из специализированного стационара в ИКБ № 1 с подозрением на коклюш при отрицательных результатах бактериологического обследования. Применение разработанного LAMP-варианта позволило быстро подтвердить диагноз «коклюш».
Ребенок Г. (4 мес.) из асоциальной семьи госпитализирован в ИКБ № 1 с диагнозом «респираторный микоплазмоз, острый бронхиолит, ателектаз сегмента левого легкого». Симптомы заболевания коклюшем у него были замаскированы выраженным микоплазмозом. Разработанный LAMP-вариант позволил подтвердить диагноз «коклюш», в то время как бактериологическое обследование дало отрицательные результаты. Впоследствии, серологическое обследование показало убедительное нарастание динамики титров антител в РА с 1:20 до 1:320, т. е. в четыре раза, на четвертой неделе от начала заболевания, что ретроспективно также подтвердило диагноз «коклюш» у ребенка.
Апробация LAMP-варианта для ускоренного выявления B. pertussis в клиническом материале больных, обследованных с подозрением на коклюш и коклюшеподобные заболевания, проведена на 447 клинических образцах от лиц, обследованных с подозрением на коклюш и коклюшеподобные заболевания. Среди них, 81 (18,1%) образец был положительным в LAMP-варианте, в то время как в бактериологическом методе положительными были только 19 образцов. Из 81 положительного LAMP-образца, бактериологически подтвержденными оказались только 23,4% образцов. Таким образом, выявлена высокая эффективность применения LAMP-варианта для диагностики больных с подозрением на коклюш и коклюшеподобные заболевания, которая в 4,3 раза превышала результативность бактериологического обследования, а также в 5 — 7 раз сокращала срок выдачи окончательного ответа.
На новый метод LAMP-вариант получено положительное решение о выдаче патента от 16.09.2008 г. по заявке № 2 007 147 797/13 (52 390).
Выбор фрагмента нуклеотидной последовательности в amy гене в качестве «мишени» для определения принадлежности C. diphtheriae к биовару с помощью ПЦР
Система бактериологической диагностики дифтерии, разработанная в России несколькими поколениями исследователей и практических микробиологов и используемая в настоящее время, направлена на то, чтобы в максимально короткий срок (4 — 5 дней) с помощью минимального набора тестов выявить в исследуемом материале (в мазках из ротоглотки и носа, или других мест локализации) возбудителя дифтерии — токсигенные С. diphtheriae.
Определение принадлежности штаммов С. diphtheriae к биовару проводится классическим бактериологическим методом — биохимической реакцией разложения крахмала на среде Грисса. Однако результаты проведения биохимической идентификации С. diphtheriae зависят от большого числа факторов, таких как качество питательных сред и реагентов, условий их приготовления, определения рН среды, а также квалификации персонала и др. Поэтому, выявление генетической детерминанты амилазной активности (фрагмента amy гена) в геноме возбудителя дифтерии с помощью ПЦР является более точным и достоверным методом определения принадлежности к биовару, по сравнению с биохимической идентификацией.
На основании выявленных особенностей структуры генетической детерминанты, определяющей амилазную активность, нами разработан новый основанный на ПЦР способ, позволяющий дифференцировать штаммы C. diphtheriae по принадлежности к биоварам.
На консервативную область аmy гена сконструированы праймеры, фланкирующие фрагмент гена, после амплификации с которыми положительными считались образцы, содержащие специфический светящийся фрагмент и данные штаммы регистрировались как C. diphtheriae биовар gravis (рис. 15).

Рисунок 15 Фотография фрагмента 1,5% агарозного геля, содержащего электрофоретически разогнанные продукты ПЦР с использованием праймеров AmyF1 — AmyR1 к последовательности фрагмента amy гена C. diphtheriae.
Примечание: дорожки 1 — маркер молекулярных весов; 2, 4, 7, 9, 10, 11 — ДНК штаммов C. diphtheriae биовара gravis; 3, 5, 6, 8, 12, 13 — ДНК штаммов C. diphtheriae биовара mitis.
Специфичность, чувствительность и воспроизводимость метода подтверждена при изучении 99 штаммов C. diphtheriae (48 штаммов биовара gravis и 51 штамм биовара mitis), выделенных от больных и бактерионосителей в 80 — 90-е годы прошлого столетия, а также на современном этапе эпидпроцесса дифтерийной инфекции. Сравнительные исследования фенотипических свойств штаммов C. diphtheriae в классическом бактериологическом методе и ПЦР показали 100% корреляцию результатов. Вместе с тем, разработанный способ позволял дифференцировать штаммы C. diphtheriae биовара gravis от штаммов биовара mitis в более короткие сроки (на 1 сутки меньше). Данный метод явился одним из этапов разработки метода ускоренной лабораторной диагностики дифтерии. На разработку способа дифференцирования штаммов C. diphtheriae биовара gravis от штаммов mitis получено положительное решение о выдаче патента от 13.11.2008 г. по заявке № 2 007 140 879/13 (44 745).
Для оценки возможностей использования разработанных «мишеней» в amy гене в качестве диагностического критерия определения принадлежности к биовару в ускоренной лабораторной диагностике дифтерии предпринята попытка применения мультиплексной амплификационной технологии для выявления возбудителя дифтерии в клиническом материале больных, позволяющей одновременно в одной пробирке определять фрагменты amy гена, ответственного за амилазную активность, и tox гена, кодирующего токсинообразование.
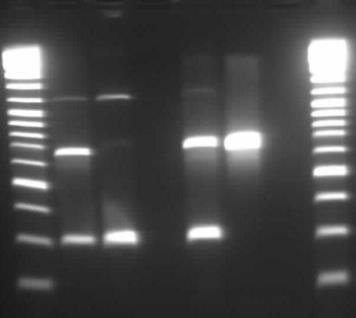
Рис. 16 Фотография фрагмента 1,5% агарозного геля, содержащего электрофоретически разогнанные продукты ПЦР с использованием праймеров DTF — DTR и AmyF1 — AmyR1 к последовательностям фрагментов tox и amy генов C. Diphtheriae
Примечание: дорожки 1, 8 — маркер молекулярных весов; 2, 5 — ДНК токсигенных штаммов C. diphtheriae биовара gravis; 3 — ДНК нетоксигенного штамма C. diphtheriae биовара gravis; 4 -ДНК нетоксигенного штамма C. diphtheriae биовара mitis; 6 — ДНК токсигенного штамма C. diphtheriae биовара mitis; 7 — отрицательный контроль Метод апробирован на 147 штаммах C. diphtheriae, как токсигенных (100 штаммов), так и нетоксигенных (47 штаммов), двух биоваров — gravis (76 штаммов) и mitis (71 штаммов). У токсигенных штаммов C. diphtheriae биовара gravis регистрировали специфический профиль, состоящий из двух фрагментов ДНК с молекулярной массой 634 п.н. и 289 п.н., у токсигенных штаммов C. diphtheriae биовара mitis — фрагмент с молекулярной массой 634 п.н. При отсутствии этих фрагментов в исследуемом образце ДНК, продукты амплификации не регистрировали (рис. 16).
Апробирование метода подтвердило специфичность «мишеней» в amy гене для определения биовара gravis и показало возможности использования мультиплексной ПЦР-технологии для диагностических целей.
Нами предпринята попытка выделения возбудителя дифтерии по наличию фрагментов tox и amy генов непосредственно в клиническом материале от больных дифтерией. Обследовано 9 больных в возрасте от 28 лет до 60 лет, госпитализированных в ИКБ № 1 (г. Москва). Патологический материал собирали двумя тампонами из ротоглотки и носа для дальнейшего изучения в бактериологическом методе и мультиплексной ПЦР.
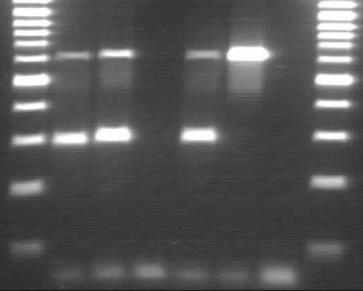
Рис. 17 Профили ПЦР-ампликонов образцов клинического материала, полученного от больного (С., 44 года) с подозрением на дифтерию
Примечание: дорожки 1, 8 — маркер молекулярных весов; 2 — ДНК из клинического образца от больного дифтерией (С, 44 года (нос); 3 — ДНК из клинического образца от больного дифтерией (С., 44 года (зев); 5 — положительный контроль — ДНК токсигенного штамма C. diphtheriae биовара gravis; 6 — положительный контроль — ДНК токсигенного штамма C. diphtheriae биовара mitis; 4, 7 — отрицательные контроли На рис. 17 представлены результаты обследования больного (С., 44 лет) с подозрением на дифтерию в мультиплексной ПЦР. Положительной считалась проба, имеющая характерный вид профиля, состоящего из двух специфических светящихся фрагментов определенной молекулярной массы. В образцах, содержащих ДНК из клинического образца из носа и ротоглотки больного, регистрировали положительные результаты, что свидетельствовало о наличие в материале от больного токсигенного штамма C. diphtheriae биовара gravis и подтверждало клинический диагноз «дифтерия ротоглотки и носа».
С помощью мультиплексной ПЦР клинический диагноз «дифтерия» удалось подтвердить у трех больных: у больного (С., 44 лет) с диагнозом «комбинированная дифтерия ротоглотки и носа»; у больной (И., 54 лет) с клиническим диагнозом «комбинированная локализованная дифтерия ротоглотки и носа»; у больной (Е., 60 лет) с клиническим диагнозом «токсическая дифтерия ротоглотки II — III степени в комбинации с дифтерией гортани». Для первых двух больных получено бактериологическое подтверждение на 4 сутки, бактериологическое обследование последней больной дало отрицательные результаты. У остальных шести больных, госпитализированных в стационар с подозрением на дифтерию, при поступлении поставлены диагнозы «лакунарная ангина» и при бактериологическом обследовании и в мультиплексной ПЦР получены отрицательные результаты. Проведенное исследование показало возможности использования «мишеней» в amy гене, выявление которых с помощью ПЦР позволяет определять принадлежность к биоварианту, с целью коплексирования в мультиплексной ПЦР для разработки ускоренного метода обследования больных с подозрением на дифтерию. В настоящее время исследования по разработке ускоренного метода лабораторной диагностики дифтерии продолжаются.