Результаты исследования.
Диагностика и интенсивная терапия коагулопатий у больных с абдоминальной хирургической патологией

При проведении дифдиагностики нарушений гемостаза невозможно интерпретировать лабораторные данные без их сопоставления с клиникой. Так, при изолированном повышении ПТВ необходимо выяснить получает ли больной непрямые антикоагулянты. Если да, то у пациента передозировка непрямых антикоагулянтов, если нет — мы имеем дело с дефицитом витамина К. Аналогичной должна быть тактика диагностики при… Читать ещё >
Результаты исследования. Диагностика и интенсивная терапия коагулопатий у больных с абдоминальной хирургической патологией (реферат, курсовая, диплом, контрольная)
Частота дооперационных и интраоперационных нарушений гемостаза. Наиболее частыми коагулопатиями, выявляемыми на дооперационном этапе были изолированная тромбоцитопения и лабораторная стадия ДВС-синдрома (таблица 3). При этом, какая-либо коагулопатия регистрировалась примерно у каждого четвертого исследуемого пациента. Полученные данные свидетельствуют о том, что изучаемый контингент больных имеет достаточно высокий исходный риск развития тромботических и геморрагических осложнений, возникновение которых может реализоваться на интраили послеоперационном этапах лечения.
Наиболее частыми коагулопатиями, выявляемыми на интраоперационном этапе были: гемодилюционная коагулопатия, изолированная тромбоцитопения, лабораторная стадия ДВС-синдрома (таблица 3). Отсутствие какой-либо коагулопатии регистрировалось только примерно у трети исследуемых пациентов. Доля пациентов с интраоперационно диагностированной коагулопатией возрастала по мере увеличения длительности оперативного вмешательства. Наибольшую зависимость от длительности вмешательства имела гемодилюционная коагулопатия.
Таблица 3. Частота коагулопатий в дооперационном периоде (%)
Коагулопатия. | Дооперационный период. | Интраоперационный период. | |
Клинический ДВС-синдром. | 0,3. | ||
Лабораторный ДВС-синдром в.т.ч. коагуляционный вариант фибринолитический вариант. |
|
| |
Гемодилюционная коагулопатия. | 3,2. | ||
Печеночная коагулопатия. | 4,0. | ||
Изолиров. тромбоцитопения. | 9,3. | 15,6. | |
Все коагулопатии. | 24,1. | 48,4. | |
На основании проведенного анализа можно сделать вывод, что характер интраоперационных гемостазиологических нарушений неоднороден и зачастую непредсказуем, поэтому применение фармакологических средств, влияющих на систему гемостаза, должно быть только на фоне мониторинга его состояния. Мониторинг функционального состояния системы гемостаза должен стать неотъемлемой частью анестезиологического пособия.
Частота послеоперационных нарушений гемостаза. Наиболее частыми нарушениями гемостаза у больных с неосложненным течением послеоперационного периода были: гиперфибриногенемия; структурная и хронометрическая гиперкоагуляция (АЧТВ, ПТВ, КА, Ао), сопровождающаяся активацией или угнетением фибринолиза; гипокоагуляция (АЧТВ, ПТВ, ТВ, КА, Ао), сопровождающаяся активацией или угнетением фибринолиза; тромбоцитопения, имевшая, как правило, умеренный характер; тромбоцитоз; повышение или снижение агрегационной активности тромбоцитов.
У больных с органной недостаточностью, а тем более у больных с ПОН, чаще встречались, по сравнению с пациентами с неосложненным послеоперационным периодом, следующие нарушения гемостаза: тромбоцитопения (при этом, она зачастую имела тяжелый характер); тромбоцитоз; гипофибриногенемия; структурная и хронометрическая гипокоагуляция; активация фибринолиза; снижение агрегационной активности тромбоцитов; снижение уровня АТ III. При этом, у этих больных реже наблюдались: структурная и хронометрическая гиперкоагуляция; угнетение фибринолиза; повышение агрегационной активности тромбоцитов.
Наиболее частыми коагулопатиями, выявляемыми на послеоперационном этапе у больных с неосложненным течением послеоперационного периода были: лабораторный ДВС-синдром (коагуляционный или фибринолитический вариант), изолированная тромбоцитопения таблица 4).
Таблица 4. Частота коагулопатий в послеоперационном периоде (%).
Коагулопатия. | Подгруппа. | Контрольная группа. | |
Клинический ДВС-синдром. | Всего. | 0,7. | |
1.1. | |||
1.2. | |||
1.3. | 8,1*. | ||
Лабораторный ДВС-синдром в.т.ч. коагуляционный вариант фибринолитический вариант. | Всего. |
| |
1.1. |
| ||
1.2. |
| ||
1.3. |
| ||
Гемодилюционная коагулопатия. | Всего. | 2,9. | |
1.1. | |||
1.2. | 13,6*. | ||
1.3. | 8,3*. | ||
Изолиров. тромбоцитопения. | Всего. | 4,3. | |
1.1. | 4,2. | ||
1.2. | 7,2*. | ||
1.3. | 0*. | ||
Печеночная коагулопатия. | Всего. | 3,1. | |
1.1. | |||
1.2. | 19,5*. | ||
1.3. | |||
Уремическая коагулопатия. | Всего. | 1,3. | |
1.1. | |||
1.2. | 8,6*. | ||
1.3. | |||
Передозировка прямых антикоагулянтов. | Всего. | 2,1. | |
1.1. | 2,3. | ||
1.2. | 2,1. | ||
1.3. | 0*. | ||
Все коагулопатии. | Всего. | 45,2. | |
1.1. | 29,6. | ||
1.2. | 90,3*. | ||
1.3. | 100*. | ||
* - р 0,05 в отношении частоты данной коагулопатии по сравнению с больными с неосложненным течением послеоперационного периода У пациентов с органной недостаточностью чаще других регистрировались: лабораторный ДВС-синдром (коагуляционный или фибринолитический вариант), печеночная и уремическая коагулопатия, гемодилюционная коагулопатия, изолированная тромбоцитопения. У больных с полиорганной недостаточностью отмечался ДВС-синдром (клиническая или лабораторная стадия, коагуляционный или фибринолитический вариант) и гемодилюционная коагулопатия. Та или иная коагулопатия регистрировалась практически у всех пациентов с органной и полиорганной недостаточностью; в подгруппе с неосложненным послеоперационным периодом — у каждого третьего — четвертого больного.
При изучении частоты и характера нарушений гемостаза был отмечен факт довольно частой трансформации одного вида коагулопатии в другой. К примеру, у 7,14% пациентов изначально фибринолитический вариант ДВС-синдрома трансформировался в ходе наблюдения в коагуляционный вариант, а у 4,76% больных — в коагулопатию потребления; у 25% больных изначально коагуляционный вариант ДВС-синдрома перешел в фибринолитический вариант ДВС-синдрома.
Зависимость степени расстройств гемостаза от тяжести состояния пациента на основе оценочных шкал. На примере больных с полиорганной недостаточностью была изучена корреляционная взаимосвязь частоты наиболее типичных гемостазиологических изменений с тяжестью состояния пациента. Получены сильные прямые корреляционные связи между частотой выявления тромбоцитопении, повышением ПТВ, ПДФ, РФМК и суммой баллов по шкале APACHE III (ранговая корреляция Спирмена) (рисунок 1).
Интегральная оценка степени компенсации системы гемостаза. Учитывая литературные данные (Раби К., 1974; Kitchens C.S., 2004), согласно которым, ключевой момент диагностики острых нарушений гемостаза заключается в ответе на вопрос — образуется ли у пациента достаточный и стабильный сгусток в результате взаимодействия всех плазматических факторов, ингибиторов, тромбоцитов и фибринолитических агентов цельной крови, была определена значимость и информативность оценки плотности образующегося сгустка как интегрального маркера функционального состояния системы гемостаза. Для решения поставленной задачи был проведен ретроспективный клинико-статистический анализ 2530 гемостазиограмм больных контрольной группы. Выявлены следующие закономерности (таблица 5).
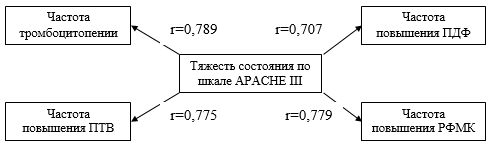
Рисунок 1. Взаимосвязь между частотой нарушений гемостаза и тяжестью состояния пациента по данным шкалы APACHE III.
Таблица 5. Частота выявления аномальных коагулологических тестов в зависимости от наличия (Ао) или отсутствия (Ао N) рыхлого сгустка
АЧТВ. | ПТВ. | фибриногена. | тромбоцитов. | ФП. | ||
Ао N. | 4,7%. | 13,1%. | 0%. | 25,1%. | 17,8%. | |
Ао. | 46,3%. | 46,3%. | 31,3%. | 44,8%. | 49,2%. | |
р*. | 0,05. | 0,05. | 0,05. | 0,05. | 0,05. | |
* - р 0,05 по сравнению с больными контрольной группы При наличии рыхлого сгустка частота выявления аномальных коагулологических тестов (повышение АЧТВ и ПТВ, снижение уровня фибриногена и тромбоцитов, повышение ФП) была в 2−30 раз выше по сравнению с подгруппой, где сгусток был нормальным. Наиболее достоверные отличия получены в отношении фибриногена: при его уровне ниже 1,5 г/л сгусток всегда был рыхлым; частота гипофибриногенемии в подгруппе рыхлого сгустка составила 31,3%. В подгруппе рыхлого сгустка выявлялось, как правило, сочетание нескольких аномальных коагулологических тестов, в то время как при нормальном сгустке определялся практически всегда единичный дефект (исключение составили случаи сочетания умеренной тромбоцитопении и повышения ПТВ).
Изолированный дефицит факторов внутреннего (повышение АЧТВ) или внешнего пути свертывания (повышение ПТВ) не приводил к формированию рыхлого сгустка. При наличии последнего наблюдалось сочетание повышения АЧТВ и ПТВ, нередко вместе с гипофибриногенемией; на основании данного факта можно сделать вывод, что одной из причин формирования рыхлого сгустка является дефицит факторов общего пути свертывания (нарушение фибринообразования). По мнению различных авторов, (Rustad H., Myhre E., 1963; Wahl M.J., 1998; Kitchens C.S., 2004) изолированное удлинение ПТВ и АЧТВ в 1,5 раза от середины диапазона нормы (что и наблюдалось в подгруппе с нормальным сгустком) не сопровождается риском кровотечения; он увеличивается при их совместном удлинении или наличии сопутствующих факторов (дисфункция тромбоцитов, активация фибринолиза).
Второй причиной формирования рыхлого сгустка была тромбоцитопения. Но необходимо ответить, что изолированная умеренная тромбоцитопения (более 50 тыс/мкл) не сопровождалась образованием рыхлого сгустка. Последний наблюдался при выраженной тромбоцитопении (менее 50 тыс/мкл) или при ее сочетании с функциональными дефектами тромбоцитов (снижение агрегационной активности) или с другими нарушениями гемостаза (дефицит факторов свертывания и/или гиперактивация фибринолиза).
Гиперфибринолиз — еще одна причина образования рыхлого сгустка. Важной особенностью, выявленной при анализе, было то, что далеко не во всех случаях регистрации активации фибринолиза (на основании интерпретации параметра ФП ЭлКоГ) формировался рыхлый сгусток. В данных случаях активация фибринолиза носила, надо полагать, компенсаторный ответ на активацию коагуляции, не была сопряжена с риском кровотечения и не должна была требовать какой-либо медикаментозной коррекции.
Используя статистические методы, была рассчитана чувствительность и специфичность различных гемостазиологических тестов в диагностике той или иной коагулопатии (таблицы 6 и 7).
Таблица 6. Значения LR+ для различных лабораторных нарушений гемостаза при той или иной коагулопатии (часть 1).
Характер лабораторных нарушений. | Вид коагулопатии. | ||||
Изолирован. тромбоци-топения. | Изолирован тромбоцито-патия. | Передозир. прям. анти-коагулянтов. | Передозир. непрям. анти-коагулянтов. | ||
кол-ва тромбоцитов. | 387,1. | 0,0. | 0,0. | 0,0. | |
повышение АЧТВ. | 0,0. | 1,4. | 44,9. | 0,6. | |
снижение АЧТВ. | 0,0. | 0,0. | 0,0. | 0,0. | |
повышение ПТВ. | 0,1. | 0,8. | 0,5. | 42,6. | |
уровня фибриногена. | 0,0. | 0,0. | 0,0. | 0,0. | |
повышение РФМК. | 0,3. | 0,2. | 0,2. | 0,4. | |
повышение ПДФ. | 0,0. | 0,0. | 0,0. | 0,0. | |
повышение D-димера. | 0,0. | 0,0. | 0,0. | 0,0. | |
снижение Ао ЭлКоГ. | 0,1. | 0,0. | 0,2. | 0,2. | |
повышение Ао ЭлКоГ. | 10,5. | 10,5. | 15,8. | 10,5. | |
агрегац. тромбоцит. | 1,2. | 0,0. | 0,8. | 0,0. | |
агрегац. тромбоцит. | 0,4. | 36,4. | 1,0. | 0,6. | |
При определении чувствительности мы отвечали на вопрос — типичен ли оцениваемый признак для данной коагулопатии (другими словами — как часто он при ней встречается)? При определении специфичности мы отвечали на вопрос — как часто оцениваемый признак отсутствует у больных, не имеющих данную коагулопатию? Для определения значимости того или иного теста в диагностике изучаемой коагулопатии пользовались интегральным параметром, учитывающем значения чувствительности и специфичности — отношением вероятности положительного теста (LR+), что позволяло избежать ошибок статистического анализа. Величина LR+ более 10,0 указывала на большую вероятность наличия исследуемого признака при данной коагулопатии, а величина в 0,1 и менее — на большую вероятность отсутствия исследуемого признака при данной коагулопатии [Петри А., Сэбин К., 2003].
Таблица 7. Значения LR+ для различных лабораторных нарушений гемостаза при той или иной коагулопатии (часть 2)
Характер лабораторных нарушений. | Вид коагулопатии. | ||||
ДВСсиндром. | Печеночная коагулопатия. | Уремическая коагулопатия. | Гемодилюц. коагулопатия. | ||
кол-ва тромбоцитов. | 10,0. | 15,0. | 15,7. | 75,2. | |
повышение АЧТВ. | 5,3. | 4,0. | 7,0. | 73,0. | |
снижение АЧТВ. | 1,3. | 3,1. | 0,0. | 0,0. | |
повышение ПТВ. | 11,2. | 60,7. | 5,1. | 2,4. | |
уровня фибриногена. | 2,4. | 0,0. | 0,0. | 32,9. | |
повышение РФМК. | 231,7. | 0,2. | 0,3. | 0,0. | |
повышение ПДФ. | 769,2. | 0,0. | 0,0. | 0,0. | |
повышение D-димера. | 110,2. | 0,0. | 0,0. | 0,0. | |
снижение Ао ЭлКоГ. | 3,1. | 1,2. | 0,0. | 0,0. | |
повышение Ао ЭлКоГ. | 324,1. | 10,6. | 31,6. | 120,4. | |
агрегац. тромбоцит. | 0,6. | 0,4. | 0,0. | 0,0. | |
агрегац. тромбоцит. | 3,3. | 1,0. | 42,4. | 0,9. | |
Единственным гемостазиологическим тестом, изменяющимся при любой коагулопатии, был параметр электрокоагулограммы, характеризующий плотность образующегося сгустка, что еще раз подчеркивает значимость данного показателя, как интегрального маркера наличия коагулопатии.
Таким образом, оценка структурных свойств образующегося сгустка баланса между процессами коагуляции и фибринолиза по данным электрокоагулограммы позволяет сделать вывод о степени реактивности и компенсации системы гемостаза. На основании этого нами сформулированы характеристики степеней дисфункции системы гемостаза.
Степени дисфункции системы гемостаза.
- 1. Компенсированная дисфункция гемостаза — различные нарушения, проявляющиеся количественными изменениями компонентов системы, не приводящие к структурным нарушениям образующегося сгустка. Система гемостаза в данном случае сбалансирована, а имеющиеся нарушения не предрасполагают к тромботическим или геморрагическим осложнениям. Гемостазиологическая коррекция не требуется.
- 2. Субкомпенсированная дисфункция гемостаза — различные нарушения, сопровождающиеся структурными изменениями образующегося сгустка. Система гемостаза разбалансирована, имеется возможность развития тромботических и/или геморрагических осложнений. Реализация осложнений будет зависеть от наличия предрасполагающих клинико-лабораторных факторов (шкала оценки риска развития коагулопатии — таблица 13). Требуется своевременная гемостазиологическая коррекция. Можно выделить два варианта субкомпенсированной дисфункции гемостаза:
- — 1 вариант — тромботический — повышение гемостатического потенциала крови на фоне формирования плотного длительно существующего сгустка;
- — 2 вариант — геморрагический — снижение гемостатического потенциала крови на фоне формирования рыхлого сгустка.
- 3. Декомпенсированная дисфункция гемостаза — имеются выраженные хронометрические и структурные нарушения, сопровождающиеся клиническими проявлениями (тромбозы и/или кровотечения). Проблема прогнозирования в данной ситуации не актуальна, требуется немедленная интенсивная терапия.
Таким образом, необходимость коррекции гемостазиологических нарушений, в первую очередь, должна зависеть от степени компенсации системы гемостаза, определяемой на основе оценки структурных свойств образующегося сгустка (рисунок 2).

Рисунок 2. Принципы коррекции коагулопатии в зависимости от стадии процесса и степени компенсации системы гемостаза.
Взаимосвязь между состоянием системы гемостаза и функциональным состоянием организма по данным регистрации сверхмедленных биопотенциалов (СМБП). Была изучена взаимосвязь между характеристиками СМБП и функциональным состоянием системы гемостаза у 126 больных контрольной группы. На первом этапе анализа была оценена корреляционная связь между уровнем постоянного потенциала (ПП) и различными параметрами гемостаза. Выявлены следующие корреляционные связи с величиной ПП:
- — прямая корреляционная связь средней силы с величиной Ао ЭлКоГ (r=0,530 (р<0,05));
- — прямая корреляционная связь средней силы с величиной ГП ЭлКоГ (r=0,528 (р<0,05)).
Полученные результаты подтверждают правильность концепции определения степени компенсации функционального состояния системы гемостаза на основе оценки структурных свойств образующегося сгустка (параметр Ао ЭлКоГ) и баланса между процессами коагуляции и фибринолиза (параметр ГП ЭлКоГ).
В таблице 8 представлено распределение больных с различной степенью компенсации системы гемостаза, а также качество течения послеоперационного периода в зависимости от уровня ПП.
Таблица 8. Распределение больных с различной степенью компенсации системы гемостаза в зависимости от уровня постоянного потенциала
Величина постоянного потенциала. | ||||
— 15 — -25 мВ. | — 26 — -40 мВ. | — 14 — +20 мВ. | ||
Взаимосвязь со степенью компенсации системы гемостаза. | ||||
Компенсация системы гемостаза. | 64% * #. | 5%. | ; | |
Тромботический вариант субкомпенсации. |
более 12/10мин). | 95%. | ; | |
Геморрагический вариант субкомпенсации. |
| ; | 38%. | |
Декомпенсация системы гемостаза. | — #. | ; |
| |
Течение послеоперационного периода. | ||||
Неосложненное течение. | 88,0% * #. | 42,0%. | ; | |
Органная недостаточность. | 12,0% * #. | 33,0%. | 52,9%. | |
Полиорганная недостаточность. | — * #. | 25,0%. | 47,1%. | |
* - p0,05 по сравнению с пациентами, имевшими субкомпенсированное функциональное состояние на основании критерия z.
# - p0,05 по сравнению с пациентами, имевшими декомпенсированное функциональное состояние на основании критерия z.
Для больных с компенсированным функциональным состоянием на основе данных ПП было характерно компенсированное состояние системы гемостаза, послеоперационный период у них имел, как правило, неосложненный характер течения. В этой группе встречался также и тромботический или геморрагический вариант субкомпенсированной дисфункции гемостаза. Была отмечена закономерность со стороны динамической составляющей — сверхмедленных колебаний потенциала (СМКП): тромботический вариант субкомпенсированной дисфункции гемостаза у больных с компенсированным функциональным состоянием на основе данных ПП формировался при высокой волновой активности (более 12/10 мин), а геморрагический вариант — при низкой волной активности (0−3/10 мин).
Для больных с субкомпенсированным функциональным состоянием на основе данных ПП был характерен тромботический вариант субкомпенсированной дисфункции гемостаза, вероятность его развития увеличивалась при наличии высокой волной активности (СМКП более 12/10 мин), при умеренной волной активности не исключалось формирование компенсированного состояния гемостаза. Что касается качества течения послеоперационного периода у больных данной группы, то большая часть пациентов имела неосложненное течение, но примерно у каждого третьего больного развивалась органная, а у каждого четвертого — полиорганная недостаточность.
Для больных с декомпенсированным функциональным состоянием на основе данных ПП был характерен геморрагический вариант субкомпенсированной дисфункции гемостаза (при наличии умеренной волной активности — СМКП 4−12/10 мин) или декомпенсированная дисфункция гемостаза (при наличии низкой волной активности — СМКП 0−3/10 мин). У половины пациентов этой группы в послеоперационном периоде имелась органная, а у второй половины — полиорганная недостаточность.
Таким образом, функциональное состояние организма, оценить которое можно на основе регистрации сверхмедленных биоэлектрических потенциалов, предопределяет возможность и выраженность расстройств системы гемостаза. Один и тот же инициирующий фактор может индуцировать развитие коагулопатии у одного больного и не привести к таким последствиям у другого. На примере больных контрольной группы, перенесших массивную кровопотерю была проанализирована частота развития коагулопатии (таблица 9).
Объем кровопотери достоверно не отличался между пациентами с разным уровнем функционального состояния организма, но последствия этой кровопотери были различны. У больных с субкомпенсированным, а тем более декомпенсированным функциональным состоянием организма значительно чаще по сравнению с больными, имевшими компенсированное функциональное состояние, регистрировались геморрагический шок, полиорганная недостаточность, коагулопатии. Что касается качественного состава коагулопатий в рассматриваемых группах, то при компенсированном функциональном состоянии регистрировалась преимущественно гемодилюционная коагулопатия, а при декомпенсированном — ДВС-синдром.
Таблица 9. Частота развития коагулопатии у больных с массивной кровопотерей в зависимости от функционального состояния организма.
Функциональное состояние организма (величина ПП). | ||||
— 15 — -25 мВ (компенсированное). | — 26 — -40 мВ (субкомпенсированное). | — 14 — +20 мВ (декомпенсированное). | ||
Кровопотеря, мл Ме (Р25/Р75). | 2750 (2080/3600). | 2800 (2070/3625). | 2800 (2100/3525). | |
Больные с гемор-рагическим шоком. | 33,3%*. | 100%*. | ||
Больные с СПОН. | 25%*. | 47,1%*. | ||
Летальность. | 39,7%*. | |||
Больные с коагулопатиями. | 32,3%. | 56,4%*. | 100%*. | |
В том числе с ДВС-синдромом. | 0*. | 33,3%*. | 57,4%*. | |
* - р < 0,05 по сравнению с группой компенсированного функционального состояния (по критерию — z).
Было также выявлено, что больным с субкомпенсированным, а тем более декомпенсированным функциональным состоянием организма требовалось достоверно больше времени (средняя длительность коррекции коагулопатии) и средств (средняя потребность в СЗП) по сравнению с больными, имевшими компенсированное функциональное состояние на коррекцию коагулопатии (таблица 10). В этом заключается, так называется «цена вопроса» терапии нарушений гемостаза.
Таблица 10. Длительность и «затратность» коррекции коагулопатий в зависимости от функционального состояния организма.
Функциональное состояние организма (величина ОП). Декомпенсированное функциональное состояние организма свидетельствует об истощении стресс-реализующих механизмов организма и наличии субстратно-ферментного и/или гипоксического энергодефицита. У больных с гипоксическим энергодефицитом отмечались низкая венозная сатурация, высокий коэффициент утилизации кислорода, что являлось следствием нарушенного поступления кислорода в ткани и несоответствия доставки потреблению кислорода. При гипоксическом гипоэргозе нарушения системы гемостаза в артериальном и венозном русле носили разнонаправленный характер, поэтому артериовенозная разница гемостазиологических параметров была наиболее существенной среди всех рассматриваемых гипоэргозов. В патологический процесс вовлекалось артериальное русло (не последнюю роль в этом играет вторичное острое повреждение легких), для которого становились типичными те гемостазиологические нарушения, которые были описаны для венозного русла при гиперметаболическом гипоэргозе (гиперкоагуляция, повышение уровня РФМК, тромбоцитопения и угнетение фибринолиза). В венозном русле выявлялась несколько иная картина: тенденция к гипокоагуляции вследствие дефицита факторов свертывания (потребление), выраженное повышение уровня РФМК, активация фибринолиза, тромбоцитопения. Все отмеченное способствовало формированию рыхлого сгустка по данным ЭлКоГ в образцах венозной крови. Таким образом, у пациентов с гипоксическим гипоэргозом для артериального русла крови характерны признаки тромботического варианта, а для венозного русла — геморрагического варианта субкомпенсации системы гемостаза.Для больных с ферментным энергодефицитом были характерны нормогликемия, низкие значения потребления кислорода, высокая венозная сатурация кислорода (наличие гипероксии), тенденция к гиподинамии кровообращения. Данное состояние связано со снижением активности различных ферментных систем (в том числе дыхательных ферментов) клетки, участвующих в процессах окисления и фосфорилирования (при выраженном снижении митохондриального рН скорость метаболизма падает), что приведет к развитию ферментного гипоэргоза и блоку метаболизма. Артериовенозная разница параметров гемостаза при ферментном гипоэргозе была незначительная, но их изменения имели ярко выраженный характер, как в венозном, так и в артериальном русле. Характер нарушений гемостаза был одинаков для артериальной и венозной крови — выраженная гипокоагуляция и тромбоцитопения на фоне максимальной активации системы гемостаза (продолжающееся повышение уровня РФМК) и истощения фибринолиза. Вследствие этого, по данным ЭлКоГ формировался гемостатически неполноценный рыхлый сгусток. Описанная картина характерна для коагулопатии потребления ДВС-синдрома. Степень выраженности данных нарушений была выше в венозном русле. Таким образом, в результате проведенного изучения выявлена четкая взаимосвязь между характером артериовенозной разницы параметров гемостаза и видом энергодефицита, характеризующего степень тканевого обмена и являющегося отображением функционального состояния организма по данным регистрации СМБП. Можно сделать вывод, что патогенетической основой развития тромботического варианта субкомпенсации системы гемостаза является гиперметаболический энергодефицит, геморрагического варианта субкомпенсации системы гемостаза — гипоксический энергодефицит, а декомпенсации системы гемостаза — субстратно-ферментный энергодефицит. Алгоритм прогнозирования риска развития коагулопатии. В работе была определена чувствительность, специфичность, а также их интегральный параметр — отношение вероятности положительного теста различных клинико-лабораторных факторов риска развития коагулопатии [Петри А., Сэбин К., 2003] (таблица 12). На основании вычисленных значений статистического параметра «отношение вероятности положительного теста (LR+)» разработана шкала клинико-лабораторной вероятности развития коагулопатии (таблица 13). В предлагаемой шкале за ту или иную клиническую ситуацию дается балл соответствующий округленному значению LR+. Сумма баллов у конкретного пациента менее 3,0 указывает на низкую вероятность коагулопатии, от 3,0 до 10,0 — на среднюю вероятность, а сумма более 10,0 — на высокую вероятность коагулопатии. Практическая значимость представленной клинико-лабораторной шкалы заключается в следующем: показанием к выполнению гемостазиологического исследования является умеренная или высокая вероятность развития коагулопатии. Этот принцип может использоваться как на интраоперационном, так и на послеоперационном этапах лечения. На дооперационном этапе, когда у пациента еще нет каких-либо клинико-лабораторных факторов риска развития коагулопатии, можно определить предрасположенность его системы гемостаза к субкомпенсации или декомпенсации в интраооперационном и/или послеоперационном этапе лечения методом регистрации СМБП, характеризующих функционального состояния организма (рисунок 3). Таблица 12. Факторы риска развития коагулопатии (95% доверительный интервал)
Таблица 13. Шкала клинико-лабораторной вероятности развития коагулопатии.
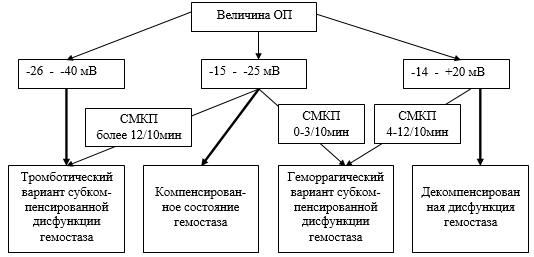 Рисунок 3. Прогнозирование степени компенсации системы гемостаза на основе регистрации СМБП (жирные линии — преимущественный вариант развития) Данные о предрасположенности системы гемостаза к развитию субкомпенсации ли декомпенсации должны предопределять объем гемостазиологического обследования на дооперационном этапе, необходимость интраоперационного гемостазиологического мониторинга, а также характер мероприятий, направленных на упреждение развития коагулопатии начиная с дооперационного этапа. Алгоритм дифференциальной диагностики приобретенных коагулопатий. На основании полученных ранее данных (таблицы 6 и 7) разработан алгоритм дифференциальной диагностики приобретенных коагулопатий (рисунок 4 и 5). В алгоритме использованы лабораторные тесты, позволяющие провести дифференциальную диагностику нарушений гемостаза: АЧТВ, ПТВ, количество тромбоцитов, агрегационная активность тромбоцитов, маркеры активации системы гемостаза (РФМК, ПДФ, D-димеры). Для определения варианта течения коагулопатии (применительно к коагулопатиям, характеризующимся поражением всех звеньев системы гемостаза — ДВС-синдрому и печеночной коагулопатии) и степени компенсации системы гемостаза использовались данные электрокоагулографии. Если у пациента при анализе скрининговых лабораторных тестов выявляется только снижение уровня тромбоцитов, то можно говорить об изолированной тромбоцитопении, если только снижение агрегационной активности тромбоцитов — об изолированной тромоцитопатии. При проведении дифдиагностики нарушений гемостаза невозможно интерпретировать лабораторные данные без их сопоставления с клиникой. Так, при изолированном повышении ПТВ необходимо выяснить получает ли больной непрямые антикоагулянты. Если да, то у пациента передозировка непрямых антикоагулянтов, если нет — мы имеем дело с дефицитом витамина К. Аналогичной должна быть тактика диагностики при выявлении изолированного повышения АЧТВ. Если больной получает прямые антикоагулянты, то можно подозревать у него передозировку данных препаратов. Дополнительная диагностическую помощь в данной ситуации окажет определение тромбинового времени — в случае передозировки прямых антикоагулянтов оно будет существенно удлинено. Если больной, у которого выявлено изолированное повышение АЧТВ, не получает гепарины, то, в первую очередь, необходимо исключить ошибки преданалитического этапа (дефект забора, длительное хранение образца крови и т. д.), для этого выполняется повторное определение АЧТВ. При удлинении АЧТВ при повторном анализе необходимо думать о наследственном дефиците отдельных факторов внутреннего пути свертывания (гемофилии, А и В и т. д.), для исключения которого выполняется пофакторный анализ коагуляционной системы. 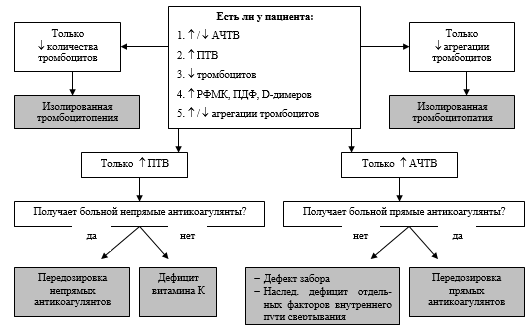 Рисунок 4. Алгоритм дифференциальной диагностики приобретенных коагулопатий (наличие одного лабораторного дефекта). Если при анализе скрининговых гемостазиологических данных выявляется два и более нарушения, то в первую очередь необходимо исключить ДВС-синдром. Обязательное условие диагностики ДВС-синдрома — повышение уровня маркеров активации системы гемостаза — РФМК, ПДФ и D-димеров. Кроме того, должны присутствовать другие наиболее достоверные критерии наличия ДВС-синдрома — повышение уровня ПТВ и/или снижение количества тромбоцитов. Помимо этого, у пациента должно быть заболевание, ассоциируемое с возможным развитием ДВС-синдрома. При диагносцировании ДВС-синдрома пациенту должно быть проведено расширенное гемостазиологическое исследование, позволяющее уточнить стадию и вариант течения данной коагулопатии. Обязательным компонентом такого исследования должен быть инструментальный метод диагностики (тромбоэластография или электрокоагулография), позволяющий определить вариант течения ДВС-синдрома и степень компенсации системы гемостаза. 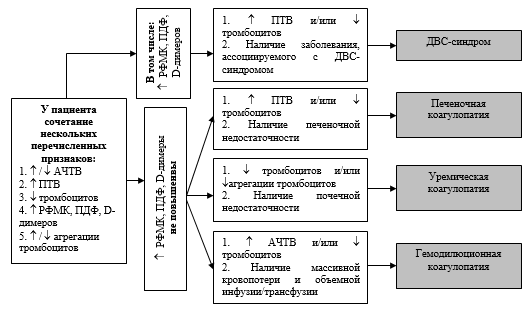 Рисунок 5. Алгоритм дифференциальной диагностики приобретенных коагулопатий (наличие нескольких лабораторных дефектов). При выделении стадий ДВС-синдрома, мы руководствовались рекомендациями Международного общества по тромбозам и гемостазу (2001), определивших клиническую (явный ДВС-синдром) и лабораторную стадию (пре-ДВС-синдром — ДВС крови) данной коагулопатии. Для клинической стадии характерно наличие генерализованного или локального тромбогеморрагического синдрома. Помимо выделения стадий процесса, мы уточняли вариант течения ДВС-синдрома (Matsuda T., 1996), суть заключалась в ответе на вопрос — активация какого звена системы гемостаза (коагуляционного или фибринолитического) превалирует. Интегральная классификация ДВС-синдрома представлена на рисунке 6. 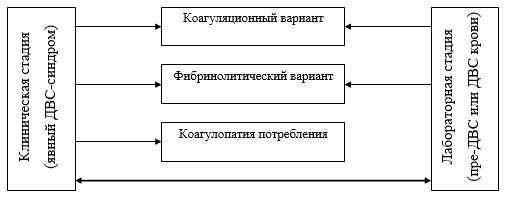 Рисунок 6. Интегральная классификация ДВС-синдрома. Для коагулопатии потребления характерен дефицит компонентов всех звеньев системы гемостаза (повышение уровня АЧТВ и ПТВ, снижение уровня фибриногена и тромбоцитов, снижение агрегационной активности тромбоцитов) и повышение уровня маркеров активации системы гемостаза (РФМК, ПДФ и D-димеров). По данным ЭлКоГ регистрируется несворачиваемость крови и практически отсутствие сгустка, что соответствует декомпенсированной дисфункции системы гемостаза и сопровождается клиникой генерализованного тромбогеморрагического синдрома. Для фибринолитического варианта ДВС-синдрома характерно по данным ЭлКоГ формирование патологически рыхлого сгустка и преобладание активации фибринолиза над активацией коагуляции, что соответствует геморрагическому варианту субкомпенсированной дисфункции системы гемостаза. При этом, клинических проявлений может не быть или имеет место локальный геморрагический синдром. Для коагуляционного варианта ДВС-синдрома характерно по данным ЭлКоГ формирование плотного, длительное время существующего сгустка и преобладание активации коагуляции над активацией фибринолиза, что соответствует тромботическому варианту субкомпенсированной дисфункции системы гемостаза. При этом, клинических проявлений может не быть или имеет место локальный тромботический синдром. Если у пациента, имеющего два и белее гемостазиологических нарушений, ДВС-синдром исключен, то необходимо проводить дифференциальную диагностику между печеночной, уремической и гемодилюционной коагулопатиями. Необходимо не забывать, что у одного больного возможно сочетание нескольких коагулопатий. Постановка правильного диагноза возможна при совместной интерпретации лабораторных и клинических данных. Повышение уровня ПТВ и снижение уровня тромбоцитов (возможно также повышение уровня АЧТВ) на фоне печеночной дисфункции свидетельствует о наличии печеночной коагулопатии; снижение количества и агрегационной активности тромбоцитов (возможно также повышение уровня АЧТВ и ПТВ) на фоне почечной недостаточности — об уремической коагулопатии; повышение уровня АЧТВ и снижение уровня тромбоцитов (возможно также повышение уровня ПТВ и снижение фибриногена) у больных, перенесших массивную кровопотерю и объемную инфузионно-трасфузионную терапию — о гемодилюционной коагулопатии. Оптимизация интенсивной терапии ДВС-синдрома, а зависимости от стадии и варианта течения. При рассмотрении вопросов, касающихся интенсивной терапии коагулопатий, наиболее дискутабельной темой остается лечение ДВС-синдрома. Основной вопрос, который возникает при обсуждении принципов лечения ДВС-синдрома — какие препараты у данного конкретного больного и на какой стадии ДВС-синдрома необходимы? В работе были изучены показания к применению при ДВС-синдроме двух наиболее обсуждаемых групп препаратов — прямых антикоагулянтов и ингибиторов протеаз (препаратов апротинина). С целью сравнения эффективности применения различных антикоагулянтов при коагуляционном варианте ДВС-синдрома были оценены пациенты контрольной группы, получавшие НФГ, эноксапарин и дальтепарин. Полученные результаты представлены в таблице 14. У больных, получавших НФГ, сохранялась повышенная агрегация тромбоцитов, при применении НМГ степень агрегации тромбоцитов оставалась в пределах нормы и была достоверно ниже, чем при применении НФГ. Полученные результаты соответствуют литературным данным [R.M. Hardaway et al., 2001], согласно которым НФГ обладает проагрегационным влиянием на тромбоциты, а НМГ имеют незначительное влияние на количество тромбоцитов и их агрегационную способность. Данный факт делает применение НФГ малоэффективным при коагуляционном варианте ДВС-синдрома, патогенез которого связан не только с прокоагулянтной направленностью плазменного звена гемостаза, но и повышенной активностью тромбоцитов (в том числе их проагрегационной функцией). Один из ключевых патофизиологических моментов коагуляционного варианта синдрома ДВС — угнетение фибринолиза, следовательно, активация фибринолиза является одной из важнейших задач коррекции данного состояния. При использовании эноксапарина фибринолитическая активность нормализовалась у всех пациентов, при использовании далтепарина натрия — только у половины больных, а при применении НФГ фибринолиз у всех пациентов оставался угнетенным. В предыдущих исследованиях было показано, что аналогично дальтеприну проявлял себя другой НМГ — надропарин. Таблица 14. Влияние гепаринов на основные параметры системы гемостаза при коагуляционном варианте ДВС-синдрома.
* - р0,05 по сравнению с исходным состоянием по критерию Ньюмена-Кейлса. Согласно литературным данным [В.П. Балуда с соавт., 1995; A.V. Bendetowicz et al., 1992], антифибринолитический эффект, связанный с ингибированием Ха-зависимого (внутреннего) фибринолиза, является существенным недостатком НФГ. НМГ, имеющие незначительную анти-Ха-активность, лишены данных свойств. Кроме того, они обладают профибринолитическими свойствами за счет стимуляции секреции активатора плазминогена тканевого типа из эндотелия сосудистой стенки в кровоток [Fareed J. et al., 1985]. Фибринолитический эффект эноксапарина в данном исследовании оказался существенно выше по сравнению с далтепарином натрия, что также не противоречит литературным данным, указывающим на наиболее выраженный профибринолитический эффект эноксапарина по сравнению с другими НМГ [Alban S. et al., 1996]. Таким образом, согласно полученным результатам, антикоагулянтом выбора при коагуляционном варианте лабораторной стадии ДВС-синдрома должен быть препарат, обладающий профибринолитическим эффектом — эноксапарин (клексан). При фибринолитическом варианте лабораторной стадии ДВС-синдрома антикоагулянты выбора — дальтепарин (фрагмин) или надропарин (фраксипарин), не оказывающие существенного влияния на фибринолитичекую активность крови. Для сравнения эффективности использования различных ингибиторов протеаз при фибринолитическом варианте ДВС-синдрома были оценены пациенты контрольной группы, получавшие с целью купирования гиперфибринолиза в эквивалентных дозировках препараты апротинина — трасилол и апротекс. При расчете необходимых для пациента доз ингибиторов протеаз ориентировались, прежде всего, на оценке значения плотности сгустка (Ао) электрокоагулограмммы. Устранить гиперактивацию фибринолиза (о чем свидетельствовала нормализация параметров Ао и ФП ЭлКоГ, ПДФ) удалось у всех пациентов к концу 1-х суток терапии. Отмечалась также тенденция к нормализации количества тромбоцитов, уровня фибриногена и ПТВ. Перед назначением ингибиторов протеаз потребность в трансфузии СЗП имелась у 86,7% пациентов. В 1 сутки наблюдения потребность снизилась на 47% у пациентов, получавших апротекс и на 68% у пациентов, получавших трасилол. Перед назначением ингибиторов протеаз потребность в трансфузии эритроцитарной массы имелась у 66,7% пациентов. На 1 сутки потребность в гемотрансфузии при применении апротекса уменьшилась на 67%, при применении трасилола — на 47%. На 2 и 3 сутки наблюдения потребности в гемотрансфузии не было. Объем геморрагического отделяемого по дренажам на 1 сутки при применении апротекса уменьшился на 57%, при применении трасилола на 73%. На 2−3 сутки продолжалось достоверное снижение объема геморрагического отделяемого по дренажам у всех пациентов. Таким образом, применение препаратов апротинина у больных с фибринолитическим вариантом ДВС-синдрома — патогенетически обоснованная терапия, позволяющая снизить потребность в гемои плазмотрансфузиях и объем геморрагических потерь по дренажам. Наоборот, при коагуляционном варианте ДВС-синдрома ингибиторы фибринолиза противопоказаны, так как в данном случае будут усугублять тяжесть процесса. Методика использования препаратов апротинина на примере трасилола: в/в болюсно 200−500 тыс. ед, а затем в виде в/в непрерывной инфузиидо 2.500 тыс. ед/сут. Оптимизация упреждающей терапии гемодилюционной коагулопатии в зависимости от степени компенсации системы гемостаза. Для того, чтобы выявить факторы, влияющие на возможность развития гемодилюционной коагулопатии и определяющие степень ее выраженности, была проанализирована взаимосвязь между процентом изменения по сравнению с исходным уровнем значений основных гемостазиологических тестов, диагностирующих наличие гемодилюционной коагулопатии — АЧТВ, уровень фибриногена и тромбоцитов — и основными параметрами, определяющими выраженность кровопотери и ее заместительную инфузионно-трансфузионную коррекцию. Оказалось, что при достижении определенного порога кровопотери (более 40% - что трактуется как массивная кровопотеря) степень изменения гемостазиологических параметров переставала коррелировать с объемом этой кровопотери. Более того, нередко наблюдалось более значимое удлинение АЧТВ у пациентов с менее выраженной кровопотерей. Ранее (таблица 9) уже обсуждалась зависимость частоты развития и выраженности коагулопатии у больных, перенесших массивную кровопотерю от функционального состояния организма. Было показано, что при одинаковом объеме кровопотери, но разном уровне функционального состояния организма, последствия кровопотери были различны. У больных с субкомпенсированным, а тем более декомпенсированным функциональным состоянием организма значительно чаще по сравнению с больными, имевшими компенсированное функциональное состояние, регистрировались геморрагический шок, полиорганная недостаточность, коагулопатии. Для оценки влияния качества проводимого возмещения кровопотери на развитие гемодилюционной коагулопатии были сравнены параметры трансфузионно-инфузионной терапии у пациентов с диагностированной гемодилюционной коагулопатией с аналогичными параметрами больных, у которых данная коагулопатия не развилась (таблица 15). Таблица 15. Влияние параметров трансфузионно-инфузионной терапии на развитие гемодилюционной коагулопатии (среднее значение (минимальноемаксимальное))
* - на основании критерия Манна-Уитни Вклад реинфузии отмытых аутоэритроцитов и трансфузии свежезамороженной плазмы был большим у пациентов без коагулопатии, а вклад инфузии синтетических коллоидов и кристаллоидов — у пациентов с развившейся гемодилюционной коагулопатией. Полученные достоверные отличия свидетельствуют, что на развитие гемодилюционной коагулопатии влияет, в первую очередь, качественный состав проводимой инфузионной терапии. Использование методики реинфузии отмытых аутоэритроцитов снижает риск развития гемодилюционной коагулопатии. Данный вывод объясняется механизмами патогенеза рассматриваемой коагулопатии, имеющей синоним «синдром массивных гемотрансфузий». По данным литературы, чем больший объем консервированной эритроцитарной массы от разных доноров используется, тем выше вероятность развития коагулопатии. Реинфузия собственных свежих эритроцитов, собранных из раневой поверхности и отмытых аппаратом типа «Sell-Sever», оказывает, при этом, гораздо менее заметное повреждающее влияние на систему гемостаза. Таким образом, при прогнозировании массивной интраоперационной кровопотери использование аппаратных кровесберегающих технологий — метод выбора восполнения кровопотери, оказывающий наименьшее повреждающее воздействие на систему гемостаза. На основе полученных данных можно сделать вывод, что оптимизация упреждающей терапии гемодилюционной коагулопатии возможна на основе прогнозирования характера гемостазиологических нарушений по данным регистрации СМБП в дооперационном периоде и индивидуализации, в результате этого, интраоперационной трансфузионноинфузионной терапии. При прогнозировании компенсированного состояния системы гемостаза или тромботического варианта субкомпенсации можно придерживаться стандартных рекомендаций относительно качественно-количественных характеристик инфузионно-трансфузионной терапии для восполнения кровопотери. Если у пациента прогнозируется геморрагический вариант субкомпенсации или декомпенсация системы гемостаза, то необходимо:
Эффективность применения алгоритмов прогнозирования, диагностики и интенсивной терапии нарушений гемостаза. Эффективность предложенных алгоритмов прогнозирования, диагностики и интенсивной терапии нарушений гемостаза у пациентов основной группы была оценена на основании данных о частоте выявленных коагулопатий на интраи послеоперационном этапах лечения, а также на основе анализа качества течения послеоперационного периода и частоты осложнений. Исходно, на дооперационном этапе не было достоверной разницы между частотой нарушений гемостаза в контрольной и основной группе. У больных с умеренным и высоким риском развития интраи послеоперационных нарушений гемостаза (их доля в основной группе, согласно прогнозированию, составляла 55,6%) проводились мероприятия, согласно представленным ранее алгоритмам, направленные на своевременную диагностику и упреждение прогнозируемых нарушений. Результатом данных мероприятий стало достоверное снижение в интраоперационном периоде общей частоты коагулопатий в основной группе по сравнению с контрольной за счет снижения частоты выявления ДВС-синдрома (клинической и лабораторной стадии) и гемодилюционной коагулопатии (таблица 16). В послеоперационном периоде у больных основной группы также отмечалось достоверное снижение общей частоты коагулопатий по сравнению с контрольной группой за счет снижения частоты ДВС-синдрома (существенно сократилась частота фибринолитического варианта лабораторной стадии, а клиническая стадия вообще не наблюдалась), гемодилюционной коагулопатии, передозировки прямых антикоагулянтов (таблица 17). Таблица 16. Частота коагулопатий в интраоперационном периоде (%).
* - р 0,05 в отношении частоты данной коагулопатии по сравнению с больными контрольной группы. Таблица 17. Частота коагулопатий в послеоперационном периоде (%)
* - р 0,05 в отношении частоты данной коагулопатии по сравнению с больными контрольной группы Нарушения системы гемостаза неразрывно ассоциированы с формированием и/или прогрессированием органной или полиорганной недостаточности. Активное упреждение коагулопатий позволило наряду с усовершенствованием всего комплекса интенсивной терапии снизить в основной группе частоту формирования в послеоперационном периоде органной и полиорганной недостаточности (таблица 18). Таблица 18. Характер течения послеоперационного периода (%).
* - р 0,05 по сравнению с больными контрольной группы В таблице 19 представлена частота осложнений напрямую или опосредовано связанных с клиническими проявлениями коагулопатий. Наряду с достоверным снижением частоты осложнений напрямую связанных с клинической манифестацией коагулопатий (тромботические — ТЭЛА, инфаркт миокарда, ишемический инсульт; геморрагические — генерализованные геморрагии, обусловленные клинической манифестацией ДВС-синдрома) наблюдалось снижение частоты возникновения таких осложнений послеоперационного периода, как жидкостные скопления, интраабдоминальные гематомы и абсцессы. Формирование жидкостных скоплений и гематом (особенно в раннем послеоперационном периоде), которые в последствии могут абсцедироваться, во многом обусловлено расстройствами гемостаза, характеризующимися образованием рыхлого гемостатически неполноценного сгустка (геморрагический вариант субкомпенсированной дисфункции гемостаза, а также декомпенсированная дисфункция системы гемостаза). Так как активность компонентов системы гемостаза реализуется в конечном счете на уровне эндотелия, то при описанных выше расстройствах гемостаза повышается сосудистая проницаемость, что приводит к экссудации жидкости из сосудистого русла в интерстиций и формированию жидкостных скоплений и гематом. Своевременная диагностика лабораторной стадии коагулопатий и их упреждающая терапия согласно разработанным алгоритмам позволили уменьшить частоту рассматриваемых осложнений. Данный факт представляет большой интерес как в анестезиолого-реанимационном, так и в хирургическом аспекте: снижается потребность в выполнении инвазивных вмешательств для пункции и дренирования подобных образований, уменьшается риск развития септического процесса, снижаются фармако-экономические затраты на лечение пациента и в конце концов уменьшается средний койко-день и летальность. Таблица 19. Частота осложнений, ассоциируемых с нарушениями гемостаза
* - р 0,05 по сравнению с больными контрольной группы В таблице 20 сравнены некоторые показатели лечебной работы, а также летальность между контрольной и основной группами. Безусловно, что воздействие на систему гемостаза, являющейся неотъемлемой и важной составляющей гомеостаза в целом, вносит ощутимый вклад в результативность интенсивной терапии критических состояний. Таблица 20. Показатели интенсивной терапии в контрольной и основной группе.
* - р0,05 между группами на основании критерия 2. Снижение в основной группе доли пациентов с осложненным течением послеоперационного периода сопровождалось снижением потребности в инотропной поддержке, продленной искусственной вентиляции легких. Благодаря своевременному упреждению расстройств гемостаза на дои интраоперационном этапах уменьшалась потребность в применении компонентов крови (свежезамороженная плазма, эритроцитарная масса) в послеоперационном периоде. У больных основной группы отмечалось достоверное снижение общей летальности по сравнению с контрольной группой, а также уменьшение летальности при тяжелом сепсисе. |