Отдаленные результаты.
Хирургическое лечение некоторых осложненных и распространенных форм рака желудка

Одномоментная резекция желудка с удалением отдаленных метастазов выполнена у 46 больных раком желудка с метастазами в печени (n=22) и яичники (n=26). Следует подчеркнуть, что здесь рассматриваются только случаи «относительно некуративных» резекций, что подразумевает удаление всех макроскопических проявлений заболевания — как первичного очага с зоной регионарного метастазирования, так и отдаленных… Читать ещё >
Отдаленные результаты. Хирургическое лечение некоторых осложненных и распространенных форм рака желудка (реферат, курсовая, диплом, контрольная)
У 16 пациентов на разных сроках наблюдения зарегистрировано прогрессирование заболевания. Самой частой локализацией рецидива являлись л/узлы — у 11 пациентов.
Общая 5-летняя выживаемость составила 19%, медиана жизни составила 13 месяцев. Выживаемость была лучше при R0 резекциях, чем при R½: 1-летняя выживаемость составила 61% и 38%; 5-летняя — 23% и 0% соответственно (Рис. 3).
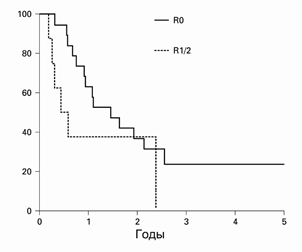
Рисунок 3. Выживаемость после ГПДР в зависимости от радикальности операции (р=0,05).
Гистологически подтвержденное врастание опухоли в поджелудочную железу достоверно ухудшало прогноз: медиана жизни составила 11 месяцев при врастании опухоли, и 23 месяца при отсутствии инвазии (р=0,05).
Имплантация самораскрывающихся металлических стентов в пилородуоденальную зону при стенозирующем неоперабельном раке дистального отдела желудка выполнена у 28 больных. Показанием служил рак желудка с метастазами в печень (3 больных), забрюшинные л/узлы (5), диссеминация опухоли по брюшине (13) или наличие более 2 зон метастазирования (7). У 19 больных выявлено поражение антрального отдела, у 9 опухоль распространялась также на тело желудка.
Мы применяли нитиноловые стенты российских и зарубежных фирм (Cook (США) и M.I. Tech (Южная Корея).
Непосредственных и ближайших серьезных осложнений не отмечено ни у одного больного. У 4 больных в течение 1−2 дней сохранялась тошнота, у 5 — дискомфорт и умеренные боли в эпигастрии и правом подреберье.
Энтеральное питание восстановлено у 26 больных. На 5 день после установки стента 22 больным был назначен общий стол.
Миграция стента является грозным и трудно контролируемым осложнением. У 2 больных отмечалось смещение непокрытого стента в дистальном направлении, они фиксировались в начальных отделах 12-перстной кишки. У этих больных установлены дополнительные стенты в зону пилородуоденального перехода.
Нами изучены результаты лечения 432 больных раком желудка, осложненным кровотечением за период с 1995 по 2007 г.
Определяющим фактором в клинике желудочных кровотечений и критерием для классификации, а также выбора тактики лечения является объем кровопотери. Мы разделили больных на две группы: 1 — 290 больных с небольшим объемом кровопотери, без гемодинамических нарушений (клинически проявляющимся или не проявляющимся кровотечением, т. е. хроническое, скрытое кровотечение); 2 — 142 больных со значительным объемом кровопотери и нестабильной гемодинамикой (острое, профузное кровотечение).
Большой интерес представляет анализ распространенности опухоли, в первую очередь, глубины инвазии стенки желудка. Анализ показал, что доля случаев инвазии опухолью соседних структур (Т4) в наших наблюдениях составила всего 37%.
Кровотечение также может возникнуть даже при раннем раке желудка или прорастании мышечного слоя, впрочем, частота этих случаев составила по 5% соответственно.
Анализ состояния регионарных лимфатических узлов у больных раком желудка, осложненным кровотечением, показывает, что в большинстве случаев (71%) имеется метастатическое поражение регионарных л/узлов (307 больных: у 107 установлен критерий N1, у 200 — N2).
Кровотечение из опухоли, особенно если оно профузное, является основным фактором, определяющим активную хирургическую тактику, независимо от клинической стадии рака желудка. Надо отметить, что активная хирургическая тактика не только предотвращает смертельный исход от желудочного кровотечения, но и является залогом для полного выздоровления больного от основной болезни, при радикальности операции.
Анализ частоты кровотечения из опухоли желудка в зависимости от формы ее роста показал, что в исследуемой группе преобладают язвенно-инфильтративные (41,2%) и язвенные (33,6%) формы роста опухолей.
Надо отметить, что профузное кровотечение, сопровождающееся гемодинамическими нарушениями, наблюдалось только при язвенных и язвенно-инфильтративных формах роста опухоли.
Многие исследователи обсуждают зависимость кровотечения при раке желудка от локализации опухоли Поражение кардиального или антрального отделов нами выявлено относительно редко (6,25% и 7,4% случаев соответственно), при этом опухоль, локализуясь в анатомически узких отделах желудка, в первую очередь проявляется нарушением проходимости.
Явно преобладали больные с поражением тела желудка (21,06%), в том числе, с тотальным поражением (24,7%). У 107 пациентов выявлен тотальный рак желудка, что означает поражение двух и более половины третьего отдела желудка.
Изучая морфологическую структуру опухоли у больных раком желудка, осложненным кровотечением, следует отметить, тот факт, что в 248 случаях (57,4%) имел место диффузный тип по Лаурену. Аденокарцинома, высокои умерено-дифференцированная (кишечный тип) диагностирована у 167 (38,6%) пациентов.
Обобщая клинико-морфологические особенности рака желудка, осложненного кровотечением, следует отметить, что характерно преобладание больных моложе 60 лет, с поражением более 2 отделов желудка, язвенной и язвенно-инфильтративной формой роста опухоли, частым возникновением кровотечений из области малой кривизны. У большинства пациентов имеется прорастание всех слоев стенки желудка, а также метастазы в регионарные л/узлы; более чем у трети больных выявлены отдаленные метастазы.
Известно, что инфузионно-трансфузионная терапия, проводимая у больных с острыми массивными кровотечениями должна выполнять несколько задач: поддерживать сердечный выброс и достаточную кислородную емкость крови, обеспечивать кислород-транспортную функцию крови, а также стабилизацию системы гемостаза. Оптимальным методом в этой связи считают инфузионную гемодилюцию.
Выбор раствора, используемого для восполнения дефицита ОЦК, должен зависеть от конкретной клинической ситуации, но первостепенное значение имеет быстрота восстановления адекватного артериального транспорта кислорода.
Для более быстрой стабилизации гемодинамики при выраженной гиповолемии следует отдавать предпочтение не кристалловидным, а коллоидным растворам, которые характеризуются следующими качествами:
Коллоидные растворы: 1) концентрация натрия в пределах 130−155 ммоль/л; 2) КОД, обусловленное наличием субстанций большой молекулярной массы; 3) способность удерживать жидкость в сосудистом русле; 4) способность поддерживать или увеличивать ОЦК; 5) более медленное, чем у кристаллоидов, выведение через почки; 6) значительно более продолжительный, чем у кристаллоидов, волемический эффект.
Показания к гемотрансфузии должны быть очень строгими. Это особенно важно в свете последних данных об иммунодепрессивных состояниях. Несмотря на все имеющиеся ограничения к гемотрансфузии, показанием к ее назначению служит значительное уменьшение уровня гемоглобина.
Ориентировочно этот уровень может быть равен 80 г/л, но до недавнего времени показанием к гемотрансфузии считалось снижение уровня гемоглобина крови ниже 100 г/л. Наиболее достоверным обоснованием гемотрансфузии является уровень транспорта кислорода и особенно его потребление тканями.
В настоящее время показания к переливанию эритроцитарной массы значительно сужены, и производится оно с единственной целью — коррекция анемии и улучшение транспорта кислорода; переливание эритроцитарной «профилактически» или с целью восполнения ОЦК не показано.
Анемия, какой степени выраженности требует коррекции трансфузией? Этот вопрос следует решать индивидуально, с учетом исходного и актуального уровня гемоглобина, клинических проявлений гипоксии и показателей оксиметрии и кислотно-щелочного баланса крови. Как правило, острое снижение гемоглобина ниже 8 г/л требует переливания эритроцитарной массы.
Мы проанализировали данные 208 больных, получавших эритроцитарную массу, а также ее количество и время гемотрансфузии за 2 недели до хирургического вмешательства, во время него, и в течение 2 недель после него; 224 пациентам эритроцитарная масса не переливалась. 57 получили одну дозу эритроцитарной массы, 72 больных — 2 дозы, 79 больных — 3 и более дозы.
Больные с острыми желудочными кровотечениями были оперированы в сроки от одного часа до двенадцати часов с момента выявления кровотечения. При этом большая часть больных (44%) оперированы в течение первых 3−6 часов после выявления желудочного кровотечения, около трети больных — в течение первых 3 часов, наименьшую группу составили больные, оперированные в период 6−12 часов от начала кровотечения.
При хронических кровотечениях половина больных оперирована в течение 2 недель, треть больных — в течение недели. Только незначительная часть больных (1,7%) подверглась оперативным вмешательствам позднее 2-недельного срока.
Причинами такого относительно длительного предоперационного периода послужили: необходимость уточнения распространенности опухолевого процесса, плохо корригируемые изменения гомеостаза и необходимость лечения сопутствующих заболеваний. Особое внимание уделялось оценке распространенности процесса — 124 (43%) больным выполнялась диагностическая лапароскопия.
Объемы выполненных оперативных вмешательств представлены в таблице 5.
Таблица 5.
Объемы операции у больных раком желудка в зависимости от характера кровотечения (%).
Объемы операции. | Кровотечение. | ВСЕГО. | ||
острое. | хронич. | |||
Гастрэктомия. | 81 (57%). | 117 (40,3%). | 198 (45,8%). | |
Прокс. резекция. | 19 (13,4%). | 59 (20,3%). | 78 (18%). | |
Дист. резекция. | 31 (21,9%). | 96 (33,2%). | 127 (29,3%). | |
Гастроэнтероанастомозы. | ; | 18 (6,2%). | 18 (4,2%). | |
Перевязка желуд. сосудов. | 11 (7,7%). | ; | 11 (2,5%). | |
ВСЕГО. | 142 (100%). | 290 (100%). | 432 (100%). | |
Анализ резекционных вмешательств при кровотечениях показывает, что гастрэктомии чаще выполнялись при остром кровотечении: 57% против 40,3%. Частота резекций желудка составила 35,2% против 52,4% (разница статистически значима, р=0,02).
Из 403 резекционных вмешательств 217 (53,8%) носили паллиативный характер (включая операций у 165 пациентов с отдаленными метастазами). У 52 больных операция классифицировалась как паллиативная из-за наличия микроили макроскопической остаточной опухоли в зоне операции. Среди паллиативных вмешательств 132 операции классифицировались как R2 (макроскопическая остаточная опухоль), 85 операций — как R1 (микроскопическая остаточная опухоль, элементы опухоли по линии резекции, «радикальная» резекция желудка и отдаленного метастаза и т. д.). Характер резекционного вмешательства (радикальное — R0 или паллиативное — R1 R2) в зависимости от интенсивности кровотечения представлен в таблице 6.
Таблица 6.
Радикальность резекции в зависимости от интенсивности кровотечения.
Объемы резекций. | Кровотечение. | ||
острое. | хроническое. | ||
Радикальные резекции. | 46 (35,1%). | 140 (51,5%). | |
Паллиативные резекции. | 85 (64,9%). | 132 (48,5%). | |
ВСЕГО. | 131 (100%). | 272 (100%). | |
Паллиативные резекции достоверно чаще выполнялись при профузном кровотечении, радикальные — при хроническом (разница статистически значима, р=0,002).
Обсуждая хирургическое лечение рака желудка, осложненного кровотечением, следует остановиться на вопросах, касающихся спленэктомии при раке желудка и показаний к ней. Известно, что спленэктомия при раке желудка должна выполняться и является частью лимфодиссекции D2. В РОНЦ разработана методика сохранения селезенки с выполнением полноценной лимфодиссекции по ходу селезеночных сосудов и в воротах селезенки.
Сохранение селезенки при раке желудка, осложненном кровотечением, целесообразно по нескольким соображениям: во-первых, как богато кровоснабжаемого органа, влечет за собой дальнейшее уменьшение ОЦК, что крайне нежелательно при кровотечении; во-вторых, удаление селезенки, как гемопоэтического органа, затрудняет период реконвалесценции после кровотечения.
Из 276 гастрэктомий и проксимальных резекций в анализируемой нами группе больных спленэктомия произведена у 215, у 62 выполнена «спленосохранная» операция.
Послеоперационная летальность составила 9,8% (14 больных из 142) при профузном кровотечении и 7,5% (22 больных из 290) при хроническом; разница статистически не достоверна (р=0,4).
Мы анализировали также структуру послеоперационных осложнений в зависимости от объема хирургического вмешательства (табл. 7).
Таблица 7.
Послеоперационные осложнения и летальность в зависимости от объема операции (%).
Объемы операции. | Кровотечение. | ||||
острое. | хроническое. | ||||
осложн. | летальн. | осложн. | летальн. | ||
Гастрэктомия. | 27,1±1,8. | 9,8±1,4. | 18,8±2,6. | 7,6±2,3. | |
Прокс. резекция. | 21±1,4. | 5,2±1,6. | 18,6±1,4. | 3,4±1,8. | |
Субтот. резекция. | 16±1,5. | ; | 12,5±1,4. | 3,1±1,5. | |
Нерезекц.операции. | 54,5±2,4. | 45,5±2,4. | 55,5±1,4. | 44,4±2,5. | |
Всего. | 28,2±4,2. | 9,8±1,8. | 22,8±3,2. | 7,5±2,6. | |
Структурный анализ осложнений, в зависимости от вида операции, показал, что в обеих группах преобладали осложнения после гастрэктомий (27,1?1,8% и 18,8?2,6% соответственно).
Самая высокая частота послеоперационных осложнений и летальности отмечена после нерезекционных операций. Летальность составила 45,5% (5 больных) при профузном кровотечении и 44,4% (8 больных) — при хроническом.
Нерезекционные вмешательства выполнены при массивных местно-распространенных нерезектабельных опухолях, так как при возможности резекции предпочтение отдавалось паллиативным резекциям.
Отдаленные результаты лечения у больных, перенесших нерезекционные операции, крайне неудовлетворительные. У 17 выживших больных медиана жизни составила 3,4 мес.; средняя продолжительность жизни — 4,2 мес.
Отдаленные результаты лечения в группе больных, перенесших радикальные гастрэктомии и резекции, изучены у 173 пациентов. Срок наблюдения составил от 3 до 182 мес. Общая 5-летняя выживаемость составила 32,4% после радикальных операций, 3-летняя — 45,3%. Средняя продолжительность жизни составила 33,5 мес.
Монофакторный анализ лечениеи опухоль-зависимых факторов показал, что критерии T, N, возраст старше 50 лет, выполнение сплеэктомии и переливание эритроцитарной массы являются достоверными прогностическими факторами.
Факторный анализ показал прогностическую значимость таких известных опухоль-ассициированных факторов, как глубина инвазии и поражение регионарных лимфоузлов. Так, при глубине инвазии Т1 5-летняя выживаемость составила 71%, при Т3 — 42%, при инвазии соседних структур 5-летний срок наблюдения пережили только 22% больных.
У больных без метастазов в регионарные лимфоузлы 5-летняя выживаемость составила 65,2%, при N1 — 26,7%, при N2 — 9,7%. Выживаемость была достоверно выше у пациентов старше 50 лет — 42,8% против 26,9%.
Спленэктомия достоверно ухудшала прогноз у больных раком желудка, осложненным кровотечением в анализируемой группе. При сохранении селезенки с полноценной диссекцией в воротах 5-летняя выживаемость была достоверно выше, чем при выполнении спленэктомии (42,5% против 15,5%; р<0,05).
Следующий прогностический фактор, достоверно влиявший на выживаемость — переливание эритроцитарной массы, которое в периоперационном периоде имело достоверно неблагоприятное влияние на прогноз: 5-летняя выживаемость составила 36,4% у больных, не получавших трансфузий против 20,5% при переливании эритроцитарной массы.
Таким образом, достоверными прогностическими факторами, влияющими на выживаемость больных раком желудка, осложненным кровотечением, после радикальных операций являются: глубина инвазии опухоли, статус регионарных л/узлов, выполнение спленэктомии. Такие неблагоприятные факторы, как возраст до 50 лет, диффузный тип опухоли по Lauren, объем резекции, острое кровотечение не имели независимого характера.
Паллиативная операция — это вмешательство, основной целью которого является улучшение качества жизни пациента или устранение симптомов при распространенной злокачественной опухоли. Рациональность паллиативных резекций при раке желудка состоит в устранении имеющейся или возможной перфорации опухоли, кровотечения, стеноза выходного или входного отделов желудка, что приводит к повышению чувствительности опухоли к последующей химиотерапии.
Мы проанализировали результаты лечения 967 больных раком желудка, подвергшихся паллиативным (относительно и абсолютно некуративным по JRSGC) резекционным вмешательствам. С целью повышения наглядности анализируемого материала мы разделили все некуративные операции на паллиативные резекции и резекции желудка с синхронной резекцией отдаленных метастазов. Паллиативные резекции, в свою очередь, в зависимости от характера операции, разделены на R1 (опухолевые клетки по линии резекции) и R2 (остаточная опухоль: местная или отдаленный метастаз) резекции.
Некуративные (R1/ R2) резекции выполнены 921 больному, остальным 46 произведены относительно-некуративные резекции (всего 967, в том числе, 921 — после R1 и R2 резекции, и 46 после симультанных операций).
Из 967 больных практически половину составили пациенты с осложненным течением рака желудка — 453(46,8%) больных (табл. 8).
Таблица 8.
Распределение паллиативных резекций при осложненном течении рака желудка.
Течение заболевания. | Количество больных (%). | |
Кровотечение. | 217 (22,4). | |
Стеноз. | 236 (24,4). | |
Не осложненное течение. | 514 (53,2). | |
ВСЕГО. | 967 (100). | |
Таким образом, частота паллиативных резекций у больных раком желудка с осложненным течением (453 из 921) достоверно выше (p=0,0001), чем среди всех больных, оперированных за тот же период (514 из 2085).
Паллиативные куративные (лечебные) резекции выполнены 46 больным, из них 22 выполнена резекция желудка и печени по поводу ее метастатического поражения, у 24 резекция желудка сочеталось с удалением метастатически пораженных яичников.
Как видно из таблицы резекции R2 достоверно чаще выполнялись при локализации опухоли в антральном отделе желудка, а также при тотальном раке желудка. R1 резекции чаще выполнялись у больных с локализацией опухоли в проксимальном отделе желудка (табл. 9).
Таблица 9.
Распространенность опухоли по желудку
Группа R2. | Группа R1. | р | ||
Антральный отдел. | 0,01. | |||
Тело. | 0,1. | |||
Проксимальный отдел. | 0,2. | |||
Кардиальный отдел. | <0,001. | |||
Тотальное поражение. | ||||
Всего. | ||||
При распределении больных согласно гистологической классификации по Lauren, мы пришли к выводу, что кишечный тип опухоли имел место у 242 больных, перенесших R2 резекции и у 236 больных, которым выполнены резекции R1; диффузный тип, соответственно, у 202 и 241 пациента.
Наши наблюдения показывают, что даже при раннем раке желудка возникает необходимость в выполнении паллиативных резекций (7 больных).
Анализ состояния регионарных л/узлов у больных раком желудка, перенесших R2 резекции показал, что метастазы обнаружены в 95,5% случаев, чаще, чем у больных после R1 резекции (57,5%).
В зависимости от наличия отдаленных метастазов (критерий М) больные распределились следующим образом (табл. 10).
Таблица 10.
Распределение больных в зависимости от наличия отдаленных метастазов.
R2. | R1. | p. | ||
М0. | 66(7,1%). | 342(37,1%). | <0,001. | |
М1. | 375(40,7%). | 138(15%). | <0,001. | |
Изучая метастатический потенциал опухоли у больных, подвергавшихся паллиативным резекциям, следует отметить, что наличие отдаленных метастатических очагов диагностировано у 375 (40,7%) больных после R2 резекции, в то время после R1 резекции — у 138(15%) пациентов.
Объемы операции у больных раком желудка, перенесших паллиативные резекции представлены в таблице 11.
Таблица 11.
Объемы паллиативной резекции.
Объем операции. | R2. | R1. | |
ГЭ. | |||
ГЭ с резекцией пищевода. | |||
лапаротомным доступом. | |||
тораколапаротомным доступом. | |||
ДР. | |||
ПР. | |||
лапаротомным доступом. | |||
тораколапаротомным доступом. | |||
ВСЕГО. | |||
Причины выполнения паллиативных операций представлены в таблице 12.
Таблица 12.
Локализация остаточной опухоли
R2. | R1. | P. | ||
Линия резекции. | <0,001. | |||
Лимфоузлы. | <0,001. | |||
Диссеминация по брюшине. | <0,001. | |||
Ложе опухоли. | ||||
Висцеральный метастаз. | <0,001. | |||
Мы провели структурный анализ послеоперационных осложнений в зависимости от объема хирургического вмешательства (табл. 13).
Таблица 13.
Непосредственные результаты хирургического лечения больных раком желудка осложненного декомпенсированным стенозом (n, %, ДИ95).
Характер операции. | П/о осложнения. | Летальность. | |
R2 резекции. | 216 (49%,. ДИ95 — 26,4−62,1%). | 30 (7%,. ДИ95 — 3,7−12,9%). | |
R1 резекции. | 294 (61%,. ДИ95 -33,6−79,4%). | 21 (4%,. ДИ95 -1,2−7,2%). | |
ВСЕГО. | 504 (54,7%,. ДИ95— 22,6−67,4%). | 51 (5,6%,. ДИ95 -2,7−9,8%). | |
В первую очередь следует учитывать, что в группе R1 резекций чаще выполняли гастрэктомию, а также спленэктомию и лимфодиссекцию D2. И второй решающий фактор — это выбор пациентов для R2 резекции. Как уже отмечалось, решение о выполнении R2 резекции часто принималось до операции, соответственно проводился выбор пациентов, имеющих компенсированный соматический статус.
Полученные данные указывают на то, что паллиативные R2 резекции при раке желудка можно выполнять с низкой частотой послеоперационных осложнений и летальностью.
Изучение отдаленных результатов паллиативных резекций имеет большое практическое и научное значение. В отношении паллиативных резекций это утверждение более чем справедливо.
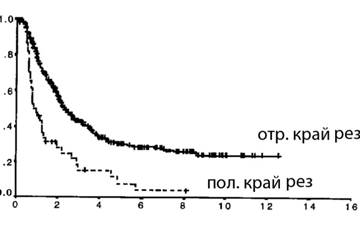
Общая выживаемость после паллиативных резекций по Kaplan-Meier показывает, что продолжительность жизни была достоверно выше в группе больных после R1 резекций, чем после R2 (15,3 месяцев против 8,5 месяцев; p =0.001).
Для выявления факторов, влияющих на выживаемость после паллиативных резекций, выполнен монои многофакторный анализ по Cox.
При монофакторном анализе достоверно на выживаемость влияли следующие факторы: осложненное течение заболевания, наличие висцерального метастаза, R2 резекция, наличие более 1 варианта метастаза (например, метастазы в печень и по брюшине), наличие остаточной опухоли на брюшине, л/узлах и возраст больше 65 лет.
Объемы резекционного оперативного вмешательства, после которых выявлено микроскопическая остаточная опухоль по линии/линиям пересечения органа представлены в таблице 14.
Таблица 14.
Объемы резекций с оставлением микроскопической опухоли по линии пресечения.
Объем операции. | n=369. | |
Гастрэктомия. | 161 (43,6%). | |
Из них тораколапаротомным доступом. | 49 (13,2%). | |
Проксимальная резекция. | 160 (43,3%). | |
Из них тораколапаротомным доступом. | 28 (7,5%). | |
 Дистальная резекция. | 48 (13,0%). | |
В …
Для анализа выживаемость после D2 операций в зависимости от края резекции мы разделили на группы по количеству пораженных л/узлов (до 5 и более 5 узлов), так как именно такая стратификация представляется нам наиболее достоверным и значимым. Количество больных в группе R1 с поражением более 5 л/узлов было 176, в группе R0 — 318. Выживаемость достоверно отличается при поражении до 5 л/узлов: при отсутствии опухоли по линии резекции 5-летняя выживаемость составила 44%, при наличии — 0%, разница статистически значима (p=0,003). При поражении более 5 л/узлов прогностическая значимость края резекции теряется. Многофакторный анализ также подтвердил эту закономерность.
Одномоментная резекция желудка с удалением отдаленных метастазов выполнена у 46 больных раком желудка с метастазами в печени (n=22) и яичники (n=26). Следует подчеркнуть, что здесь рассматриваются только случаи «относительно некуративных» резекций, что подразумевает удаление всех макроскопических проявлений заболевания — как первичного очага с зоной регионарного метастазирования, так и отдаленных метастазов. Распределение больных раком желудка в зависимости от локализации отдаленного метастаза представлено в табл. 18.
Таблица 18.
Распределение оперированных больных в зависимости от локализации отдаленного метастаза.
Локализация метастазов. | Кол-во больных. | |
Печень. | ||
из них: солитарное. | ||
множественное. | ||
Яичники. | ||
из них: одностороннее. | ||
двустороннее. | ||
Всего. | ||
У 8 больных метастазы в печень были диагностированы на дооперационном этапе, у остальных больных — после лапаротомии.
В большинстве случаев (у 9 больных) операция выполнялась при осложненном течении рака желудка (наличии стеноза выходного отдела у 5 и кровотечении у 4. Наличие осложнения рака желудка сыграло решающую роль в выборе тактике лечения у этих больных.
Количество метастазов в печени было 1 у 8 больных, 2 у 5, 3 у 4-х больных, и по 5 — у пяти пациентов. Размеры метастатических узлов колебались от 1 см до 7 см, средний размер — 3 см. Унилобарное поражение установлено у 13 больных, билобарное — у 9.
Хирургическое лечение состояло в дистальной субтотальной резекции желудка (7 пациентов) или гастрэктомии (15 пациентов). Все операции выполнены с лимфодиссекцией D2. Объем резекции печени: левосторонняя гепатэктомия — 5, левосторонняя лобэктомия — 4, атипичные резекции — 13 больных.
Таким образом, в 13 случаях выполнена атипичная резекция печени: резекция обеих долей у 5 больных, резекция правой доли у 5 больных и резекция левой доли — у 3.
Прогностическое значение имели следующие факторы: количество узлов, лобарность поражения и размер узла. Примечательно, что все прогностические факторы являются опухоль-ассоциированными и характеризуют поражение печени. Факторы, характеризующие первичную опухоль, не влияли на прогноз.
Практически у 92% больных в нашей серии выявлены метастазы в регионарные лимфоузлы, однако поражение лимфоузлов второго порядка диагностировано только у троих. Таким образом, «резектабельные» метастазы в печень могут реализоваться даже при N0 стадиях.
За анализируемый период оперировано 24 больных раком желудка с синхронными метастазами в яичники. Мы не исследовали больных с метахронно развившимися метастазами в яичники, а также оперированных пациенток, у которых метастазы Крукенберга сочетались с диссеминацией по брюшине или другими отдаленными проявлениями заболевания.
Макроскопическая картина первичной опухоли в 60% случаев (9 больных) соответствовала язвенно-инфильтративному типу (Borrmann IV).
Рак желудка, метастазирующий в яичники, чаще локализуется в дистальном отделе и имеет язвенно-инфильтративный или инфильтративный характер роста.
При изучении микроскопической формы опухоли выявлено, что больше чем в половине случаев она была представлена перстневидноклеточным раком (8 больных, 53,3%).
Размеры метастатических яичников колебались от 2 до 20 см. Метастазы в яичники имели строение перстневидноклеточного рака в 41,6% случаев (10 больных), низкодифференцированной аденокарциномы с наличием перстневидноклеточного рака — в 20,8% (5 пациенток), аденокарциномы разной степени дифференцировки — 12,5% (3 больных).
Оперативное вмешательство в большинстве случаев заключалось в ампутации матки с придатками. В некоторых случаях применяли экстирпацию матки с придатками, когда у пациентки выявлялась патология шейки матки в виде эрозий.
Больший интерес представляют, несомненно, отдаленные результаты лечения этих больных. Мы сравнили выживаемость после гастрэктомии с удалением придатков с/без матки (1 группа), после удаления яичника (без вмешательства на желудке) (2 группа) и после симптоматической терапии без противоопухолевого лечения (3 группа). Отдаленные результаты изучены у 24 оперированных больных 1 группы. Средний срок наблюдения над больными составил 16 месяцев, минимальный — 3 месяца, максимальный — 33 месяца.
Медиана жизни после одномоментной гастрэктомии с удалением яичника составила 16,3 мес., максимальная продолжительность — 33 мес. Медиана жизни после овариэктомии без вмешательства на желудке составила 13 месяцев, после симптоматического лечения — 6 месяцев.
Разница в продолжительности жизни между 1-й и 3-ей группами статистически достоверна (p=0,03). 1-летняя выживаемость в 1 группе составила 65%, во 2 группе — 56%, в 3 группе — 62%. 2-летняя выживаемость в 1 группе составила 20%, при этом ни одна больная из 2 и 3 группы не пережила 2 летний срок наблюдения.
Известно, что метастазы рака желудка в яичники отличаются выраженной химиорезистентностью, как правило, превышающей таковую у первичной опухоли. По этой причине удаление метастатических яичников при нерезектабельности первичной опухоли следует считать целесообразной.