Фитохимическое изучение Thalictrum Foetidum L. (Василистник вонючий)

Из-за содержания алкалоида фетидина растение имеет гипотензивное действие. В медицинской практике настойку из василистника на 70 °-ном спирте применяют на начальных стадиях гипертонической болезни. Как правило, ее назначают 2−3 раза в день по 15−20 капель. Помимо этого, настойка положительно воздействует на больных стенокардией. Часто в народной медицине василистник употребляют как успокаивающее… Читать ещё >
Фитохимическое изучение Thalictrum Foetidum L. (Василистник вонючий) (реферат, курсовая, диплом, контрольная)
Проведено фитохимическое изучение надземной части Василистника вонючего (Thalictrum foetidum L), собранного в Каркаралинском районе Карагандинской области. Сумма алкалоидов из растительного сырья извлекается методом хлороформной экстракции. Для выделения индивидуальных соединений применен метод колоночной хроматграфии и обработка суммы экстрактивных веществ. На основе апорфиного алкалоида глауцина получены новые производные глауцина. Структуры новых производных алкалоидов идентифицированы с привлечением современных физико-химических методов УФ-, ИКЯМР 1Н, ЯМР 13С-спектроскопии.
Виды рода Ihalictrum L. (Василистник) семейства Ranunculaceae (Лютиковые) характеризуются высоким содержанием алкалоидов изохинолинового ряда, обладающих противокашлевым, противовоспалительным, гипотенизивным, антинаркотическим, антиаритмическим, желчегонным и другими фармакологическими свойствами [1].
Василистник вонючий встречается в Каркаралинском районе, Тарбагатае, Джунгарском Алатау, Заилийском, Кунгей-Алатау, Кетмень, Терскей-Алатау, Киргизском Алатау, Восточном мелкосопоч-нике [2].
Настойка надземной части Василистника вонючего (Thalictrum foetidum L.) применяется в научной медицине в качестве гипотензивного средства при гипертонической болезни I и II стадии [3].
В народной медицине находят применение и другие виды этого рода, в частности, Василистник желтый, Василистник малый и др. Лекарственное значение имеет надземная часть — трава растения. Она содержит 1% флавоноидов, 0,7 — алкалоидов, до 6,5 — сапонинов и дубильных веществ — до 2%. В народной медицине применяют также корни и корневища василистника.
Из-за содержания алкалоида фетидина растение имеет гипотензивное действие. В медицинской практике настойку из василистника на 70 °-ном спирте применяют на начальных стадиях гипертонической болезни. Как правило, ее назначают 2−3 раза в день по 15−20 капель. Помимо этого, настойка положительно воздействует на больных стенокардией. Часто в народной медицине василистник употребляют как успокаивающее средство при неврозах и судорожных состояниях, а также при расстройстве органов пищеварения, заболеваниях желчного пузыря и печени, как кровоостанавливающее средство при наружных и внутренних кровотечениях (легочных, носовых, маточных и др.)[4, 5].
С учетом этого нами было проведено фитохимическое изучение надземной части Василистника вонючего, собранного в Каркаралинском районе Карагандинской области.
В результате проведенных исследований из надземной части Василистника вонючего нами было выделено кристаллическое вещество с т.пл., 115−117 оС. В ИК-спектре данного соединения имеются полосы поглощения в области 2800, 1600, 1583, 1440 и 1318 см-1, характерные для метильных групп, ароматических колец и метиленовых фрагментов.
В ПМР-спектре вещества проявляются сигналы протонов четырех метоксильных групп в виде синглета при 3.59 (3Н) и 3.86 м.д. (9Н, 3 х ОСН3), а также синглет, а при 2.89 м.д. (3Н, N-QT3). В области ароматических протонов Н-3, Н-8, Н-11 наблюдаются синглеты при 6.56, 6.78 и 8.03 м.д.
На основании физико-химических констант, данных ИК-, ПМР-спектров и сравнения литературных данных [6] выделенное вещество идентифицировали как апорфиновый алкалоид глауцина (1).
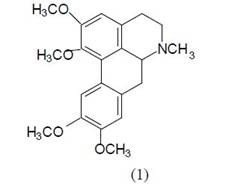
Глауцин, типичный представитель апорфиновых алкалоидов, встречающихся в ряде растений рода Thalictrum L. (Василистник) и Glaucium L. (Мачок), является действующим началом противо-кашлевых средств [7]. Глауцин — один из важных и доступных алкалоидов апорфинового ряда. Несмотря на это химическая модификация глауцина до последнего времени практически не исследовалась.
Нами рассмотрено взаимодействие глауцина с ацетатом ртути, бромистоводородной и йодисто-водородной кислотами, галоидными алкилами, уксусным ангидридом и бромом в обычно применяемых условиях.
Установлено, что взаимодействие глауцина с ацетатом ртути в присутствии NBH4 протекает при комнатной температуре и приводит к удовлетворительному выходу соединения (2).
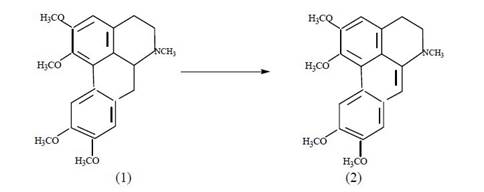
В ИК-спектре соединения (2) имеются полосы поглощения в области 2924, 1613, 1720 и 1462 см-1, характерные для метильных групп, ароматических колец и метиленовых фрагментов.
В ПМР-спектре (2) проявляются сигналы протонов четырех метоксильных групп при 3.85, 3.89, 3.90 и 3.94 м.д. (3Н), а также N-GrI3 при 2.99 м.д. в виде синглета. Метиленовые группы в положениях 4 и 5 дают два триплета при 3.20 и 3.27 м. д (по 2Н, 1=6Гц). В области ароматических протонов Н-3, Н-8, Н-11 наблюдаются однопротонные синглеты при 6.61- 7.0 и 9.00 м.д. василистник медицина гипотензивный Для установления пространственного строения соединения (2) проведено его рентгеноструктур-ное исследование.
Длины связей и валентные углы близки к обычным, за исключением наличия двойной связи С6=С7, которая равна 1,355 А. Цикл С1С2С3С5С14С13 плоский, с точностью ± 0,0028 А. Пипериди-новый цикл С4С5ЩС6С14С15 принимает конформацию почти идеальной софы (АС s 5 = 1.46о) с выходом атома С5 из средней плоскости остальных атомов цикла на 0.64 А. В молекуле (2) метилодида 7-гидроксиглауцина. Цикл С16С8С9С10С11С12 плоский, с точностью ± 0,015 А. Все метоксигруппы лежат в плоскости ароматических ядер, за исключением метоксигруппы при атоме С1, которая развернута перпендикулярно плоскости цикла (торсионный угол С2С101 С17=81,67о).
Таким образом, методом РСА однозначно установлена кристаллическая и молекулярная структура нового производного глауцина, которая имеет строение 6,7-дегидроглауцина (2).
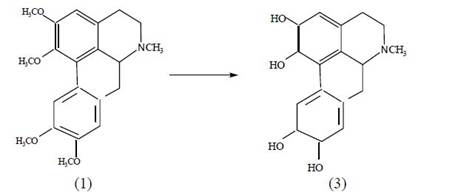
При нагревании глауцина с HBr и HI до 60−70 оС в хлороформе происходит селективное расщепление эфирных связей и образование производного глауцина (3).
ИК-спектр (3) имеет широкую полосу поглощения в области 3300−3600 см-1, характерную для ОН-групп с внутримолекулярными водородными связями, и полосы в области 2899, 2829, 1598 и 1464 см-1, свойственные метильным группам, ароматическим кольцам и метиленовым фрагментам.
Реакции глауцина с CH3I и C2H5I в присутствии К2СО3 приводят к четвертичным аммониевым солям (4,5).
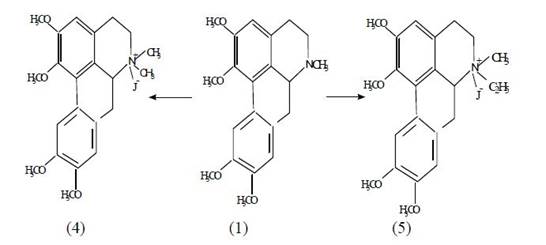
ИК-спектры солей имеют полосы поглощения в области 2930,1600 и 1462 см-1, характерные соответственно для метильных групп, ароматических колец и метиленовых фрагментов.
В ПМР-спектре (4) проявляются сигналы протонов четырех метоксильных групп при 3.72, 3.87, 3.93 и 3.94 м.д. (3Н), а также N-метильных групп при 3.13 и 3.50 м.д. в виде синглета. В области ароматических протонов Н-3, Н-8, Н-11 наблюдаются однопротонные синглеты при 6.93- 7.06 и 8.00 м.д.
Строение молекулы катиона соединения (4) изучено методом рентгеностуктурного анализа.
В связи с разупорядоченностью двух атомов гексадиеновый цикл имеет форму двух зеркально-симметричных полукресел для разупорядоченных частей 1 и 2. В части 1 атомы С (7а) и С (6а 1) выходят в разные стороны из плоскости, в которой лежат остальные атомы гексадиенового кольца (среднеквадратичное отклонение от плоскости 0.013 А), на 0.35 и 0.26 А соответственно; в части 2 атомы С (7а) и С (6а2) отклоняются на -0.35 и 0.67 А соответственно.
Пиперидиновый цикл в разупорядоченной части 2 имеет форму софы с выходом на 0.77 А атома N (62) (среднеквадратичное отклонение остальных атомов цикла от плоскости 0.012 А). В части 1 конформация пиперидинового цикла имеет форму полукресла с сильным искажением в сторону софы — атомы N (61) и С (51) выходят в разные стороны от плоскости остальных четырех атомов (среднеквадратичное отклонение от плоскости 0.016 А) на 0.20 и -0.49 А. Бензольные кольца плоские и лежат практически в одной плоскости: двугранный угол между ними 5.5 (8)°. Метоксигруппы в 2,9,10-положениях лежат практически в плоскости бензольных колец (т.е. имеют заслоненную конформацию), в 1-положении имеет гош-конформацию: торсионный угол С (2)-С (1)-О (1)-С (12) равен 84.4 (2)" 3. Физико-химические константы глауцина и его производных приведены в таблице 1.
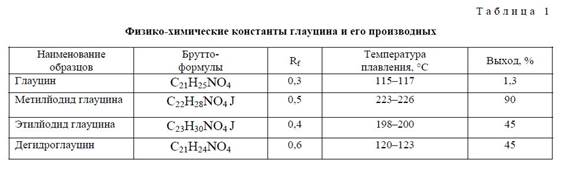
Биологическая активность производных алкалоидов глауцина.
Была изучена антимикробная активность производных глауцина, для определения которой были использованы штаммы грамположительных бактерий Staphylococcus aureus, Bacillm subtilis и грамот-рицательные штаммы Escherichia coli, Pseudomonas aerugiпоsа, а также дрожжевой гриб Сапdida a1bicans (методом диффузии в агар (лунок)).
Экспериментальная часть
Для колоночной хроматографии использовали прокаленный А12Оз (II ст. активности), для ТСХ — пластинки Silufol UV-254 и Silicagel оп А1шшпшп, 20Х, проявитель — пары йода. Температуру плавления определяли на приборе Воейпш. ИК-спектры снимали на Фурье-спектрофотометре Vektor-22 в КВг. Спектры ЯМР 1Н и 13С получены на спектрометрах Вгшкег АС 200 [рабочие частоты 200.13 (1Н) и 50.32 МГц (13С)] и Вгшкег DRX 500 [рабочие частоты 500.13 (1Н) и 125.76 МГц (13С)] для 5%-ных растворов СDC13 или СD3OD.
Хлороформная экстракция: 800 г надземной части воздушно-сухого сырья смачивали 5%-ным раствором соды и исчерпывающе экстрагировали хлороформом. Хлороформный экстракт взбалтывали с 5%-ным раствором серной кислоты. Кислый раствор промывали хлороформом, затем при охлаждении подщелачивали содой, и алкалоиды экстрагировали хлороформом. Получили 12 г (1,3%) суммы экстрактивных веществ (от веса воздушно-сухого сырья). При колоночной хроматографии на оксиде алюминия в соотношении сумма: носитель 1:70 с применением в качестве элюента смеси гек-сан-этилацетат выделили 0,03 г алкалоида глауцина. Т.пл. 115−117 °С.
ИК-спектр (КВг v, см-1): 846, 950, 975, 1005, 1121, 1161, 1200, 1228, 1318, 1392, 1440, 1535, 1595, 1600, 2850, 2930, 2958.
Взаимодействие глауцина с ацетатом ртути
0,1 г глауцина растворяли в 10 мл абсолютного хлороформа. К полученному раствору добавляли 0,012 мл ацетата ртути и 0,009 г боргидрида натрия. Реакцию проводили при комнатной температуре в течение трех часов. Раствор отфильтровали, фильтрат промыли водой, экстрагировали три раза хлороформом и сушили безводным сульфатом натрия. Растворитель упарили, остаток хроматографи-ровали на колонке с окисью алюминия, элюент — гексан. Получили кристаллическое вещество с т.пл. 120−123 °С, выход 45%.
ИК-спектр (КВг v, см 614, 806, 846, 950, 1001, 1030, 1085, 1110 (-СН2), 1121, 1161, 1200, 1228, 1259, 1298, 1332, 1392, 1510 (С-Аг), 1590 (СN), 1637 (С=С), 1758, 2824 (N-OT), 2958 (ОСН3), 3000.
ПМР-спектр (200 МГц, СDС1з, 5, м.д. J/Гц): 3.0 (3Н, с.,СЩ, 3.35 (2Н, тр., J =6, Н-5), 3.87, 3.96,3.99,4.0 (ЗН, с, ОСН3), 6.79, 6.98, 7.1, 7.23 (1Н, с, Н-3, Н-8, Н-11).
Взаимодействие глауцина с бромистоводородной кислотой
0,1 г (0,23 ммоль) глауцина растворили в абсолютном хлороформе, добавили 0,03 мл (0,22 ммоль) этиленгликолевого эфира борной кислоты. Смесь перемешивали при комнатной температуре в течение 10 часов. Осадок отфильтровали, фильтрат упаривали. Получили кристаллическое вещество с т.пл. 236−238 °С, выход 65%.
ИК-спектр (КВг v, см 842, 955, 1001, 1030, 1080, 1120 (СН), 1210(О-СН,-СН2О), 1260, 1300, 1330, 1377 (СН3), 1515 (С-Аг), 1635 (С=О), 1756, 2820 (Ч-СТ), 2960 (ОСН3).
ПМР-спектр (200 МГц, СDС1з, 5, м.д. J/Гц): 3,09 (3Н, с, NСН3); 3,20; 3,62; 4,77; 4,80, 4,85 (по 2Н, м., (О-СН2-СН2-О-)2); 3,76; 3,86; 3,88; 3,96 (3Н, с, ОСН3); 6,66; 6,72; 8,03 (1Н, с, Н3, Н8).
Взаимодействие глауцина с галоидными алкилами
100 мг глауцина гидрбромида растворяли в 10 мл этилового спирта. К полученному раствору добавляли 0,045 мл свежеперегнанного йодистого алкила (метил, этил) и 0,05 мг поташа. Реакционную смесь нагревали в течение 10 часов, по охлаждении осадок отфильтровали, промыли этанолом, объединенные маточные растворы упарили. Остаток растирали с эфиром, выделили алкилиодиды (4,5). Соединение (4) — выход 90%, т.пл. 223−226 °С. Соединение (5) — выход 45%, т.пл. 198−200 °С.
Соединение (4) — ИК-спектр (КВг v, см-1): 790, 892,921,952, 1014, 1038, 1103. 1147, 1171, 1230, 1245, 1269, 1341, 1371, 1397, 1465, 1514, 1579, 1796, 2850, 2940, 2958, 3005, 3500.
ЯМР 1Н (200 МГц, СDC1з 5, м.д. J/Гц): 3.38 (3Н, с., ^СТ), 1,26 (3Н, с.,СТСШ, 1.59 (2Н, м, СН2СН3), 3.10 (2Н, тр., J=10.5, Н-5), 3.70, 3.88, 3.92, 3.95 (3Н, с. ОСН3), 6.67, 7.21, 8.02 (1 Н, с, Н-3, Н-8, Н-9).
Соединение (5) — ИК-спектр (КВг v, см-1): 767, 881, 901, 952, 1004, 1030, 1103, 1147, 1171, 1220, 1245, 1269, 1341, 1371, 1397, 1465, 1514, 1579, 1796, 2850, 2930, 2958, 3005, 3426.
ЯМР 1Н (200 МГц, СDC1з 5, м.д. J/Гц): 3.13; 3.50 (ЗН, с., ^(СНзТ); 2.99 (2Н, тр., J=13.5, Н-5); 3.80 (1 Н, д., 1=5.0, Н-6); 3.72; 3.87, 3.93, 3.94 (3Н. с. ОСН3), 6.93, 7.06, 8.00 (1Н, с, Н-3, Н-8, Н-9).
Результаты исследований антимикробной активности
Культуры выращивали на жидкой среде (МПБ) рН 7,3 ± 0,2 при температуре от 30 до 35 °C в течение 18−20 часов. Культуры разводили 1:1000 в стерильном 0,9%-ном растворе натрия хлорида изотоническом, вносили по 1 мл в чашки с соответствующими элективными питательными средами для изучаемых тест-штаммов и засевали по методу «сплошного газона». После подсушивания на поверхности агара формировали лунки размером 6,0 мм, в которые вносили растворы исследуемых образцов и препараты сравнения по 10 мкл. В контроле использовали 96%-ный этиловый спирт в эквиобъем-ных количествах. Посевы инкубировали при 37 °C, учет растущих культур проводили через 24 часа.
Антимикробная активность образцов оценивалась по диаметру зон задержки роста тест-штаммов (мм). Диаметры зон меньше 10 мм и сплошной рост в чашке оценивали как отсутствие антимикробной активности, 10−15 мм — слабая активность, 15−20 мм — умеренно выраженная активность, свыше 20 мм — выраженная. Каждый образец испытывался в трех параллельных опытах. Статистическую обработку проводили методами параметрической статистики с вычислением средней арифметической и ее стандартной ошибки. Результаты исследования антимикробной активности образцов приведены в таблице 2.
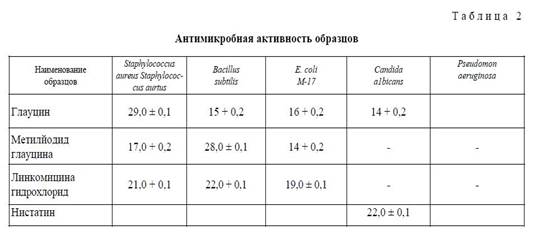
В результате испытаний установлено, что глауцин обладает выраженной антибактериальной активностью к штаммам грамположительных бактерий Staphylococcus aurtus и умеренной — к Bacillus subtilis и к грамотрицательным штаммам Escherihia coli, а также к дрожжевому грибу Candida albi-cans.
Метилйодид глауцина обладает высокой антимикробной активностью в отношении Bacillm subtilis. В отношении S. aureus и Е. соіі данное вещество проявило умеренно выраженную активность.
- 1. АриповаХ.Н. Итоги исследования алкалоидоносных растений. — Ташкент: ФАН, 1993. — 220 с.
- 2. Садритдинов Ф. С., Курмуков А. Г. Фармакология растительных алкалоидов и их применение в медицине. — Ташкент: Медицина, 1980.
- 3. Wu Yang-Ckang, Lu Sneng-Tek. Цитотоксичные апорфиноидные алкалоиды изThalictrum sessile// P — 1988. — № 27. — Р. 1563−1564.
- 4. Sticher О., SteineggerE. Phannakognosie-Phytophannazie, Springer — Beriin: Veriag, 1999. — Р. 540.
- 5. ПолингЛ., Полинг П. Химия. — М.: Мир, 1978. — 164 с.
- 6. Юнусов С., Прогрессов Н. Н. Об алкалоидах Thalictrum minus L.// Журнал органической химии. — 1957. — Т. 22. — № 4. — С. 1047−1055.
- 7. Машковский М. Д. Лекарственные средства. — М.: Новая волна, 1996. — 235 с.