Материалы для создания эндопротезов суставов

Как правило, технический ресурс эндопротезов суставов, установленный путем наблюдений in vivo, значительно меньше ресурса, определенного с помощью механического испытательного оборудования. Тем не менее, различные системы испытаний, имитирующих работу имплантированного эндопротеза, применяются во всех странах-производителях эндопротезов. В России банк данных по трибологическим характеристикам… Читать ещё >
Материалы для создания эндопротезов суставов (реферат, курсовая, диплом, контрольная)
Современная тенденция материаловедения медицинской техники состоит в том, что уменьшается перетекание лучших технических материалов из машиностроения в медицину и начинается целевое создание материалов — аналогов биотканей, предназначенных, прежде всего для использования в эндопротезах.

Современные успехи эндопротезирования являются результатом не только возросшего мастерства хирургов, но и большего понимания того, как ткани организма взаимодействуют с имплантатами. Эндопротезы суставов стали изготавливать из материалов, которые сами, а также продукты их коррозии и изнашивания не вызывают в живых тканях острую реакцию отторжения. Биологическое воздействие организма на имплантированные материалы, обусловливающее их старение, а значит — снижение прочности и ухудшение триботехнических характеристик подвижных сопряжений, происходит в пределах, не приводящих к неплановому отказу эндопротезов.
Ткани живого организма в контакте с инородными материалами формируют поверхность раздела, на которой они могут агрессивно воздействовать на имплантат. Жидкости организма содержат активные биологические вещества, например, ферменты — биологические катализаторы на основе белков, присутствующие во всех живых клетках. Они могут вырабатывать радикалы, разрушающие полимерные имплантаты. Сложные электролиты, входящие в состав биологических жидкостей, инициируют электрохимическую коррозию металлов и могут вызвать растворение керамических материалов. Поэтому немногие материалы остаются нетронутыми после имплантации. В чрeзвычайных случаях организм инициирует комплексные реакции, «атакующие» имплантат в результате чего возникает воспаление.
Регулируя ответ ткани, можно предупредить хронические и неблагоприятные реакции заживающей раны, от которых зависит, приживется ли имплантат.
Ответ можно регулировать путем выбора имплантируемых материалов.
Четыре типа реакций на имплантат приведены в табл.1.
имплантат медицинский эндопротез Таблица 1 Типы локальных реакций, протекающих на границе ткань-имплантат.
Тип. | Реакция имплантат-ткань. | Последствия. | |
Токсическая. | Токсическое повреждение ткани Некроз, деструктивное воспаление, дистрофии и артрофии, дегенерация. | ||
Биоинертная. | Ткань образует вокруг имплантата тонкую неприлипающую фиброзную капсулу. | ||
Биоактивная. | Ткань биологически связана с имплантатом на границе раздела. | ||
Растворение имплантата. | Ткань замещает имплантат. | ||
Тип 1. Необходимо, чтобы имплантат не вызывал токсического действия, убивающего клетки тканей или высвобождающего химические соединения, которые могут мигрировать с кровью, лимфой и тканевыми жидкостями и вызывать системные повреждения организма.
Тип 2. Формирование вокруг имплантата фиброзной капсулы, является одной из самых распространенных реакций живой ткани. Капсула образуется для изоляции и последующего вытеснения чужеродного тела из организма. Эта защитная реакция возникает в результате воспалительного процесса, реагирующего на химическую структуру имплантированного материала.
Если имплантация не осложнена инфекциями, то эта стадия воспалительного процесса заканчивается в среднем через трое суток.
Тип 3. Через границу раздела между имплантатом и тканью образуется связь. Такая структура, называемая «биоактивной» границей раздела, предотвращает массоперенос между тканью и имплантатом. На границе восстанавливается структура исходной ткани. Поскольку система имплантат-ткань находится в состоянии динамического равновесия, этот тип реакции зависит от скорости электрохимических и биологических процессов, протекающих в ней.
Тип 4. Скорость изменения биоактивной границы достаточно быстрая, материал имплантата растворяется (резорбирует) и замещается тканью. Иными словами, резорбируемый материал химически деградирует под действием крови, лимфы, тканевых жидкостей или легко переваривается макрофагами. Продукты деградации нетоксичны и усваиваются клетками.
Биоматериал — нежизнеспособный материал, предназначенный для контакта с живой тканью с целью выполнения функций медицинского назначения. Биоматериал должен быть биосовместимым и может быть биодеградируемым.
Биосовместимость — способность имплантата вызывать адекватную реакцию организма — хозяина в конкретных условиях их взаимодействия. Это — не свойство материала, из которого сделан имплантат, а характеристика системы имплантат-организм, соответствующая определенным условиям их контактирования. Биосовместимость не означает, что имплантант абсолютно не токсичен и не имеет других отрицательных свойств. Это — свойство имплантированного материала вызывать такую реакцию организма, которая позволяет решить поставленную задачу. Биосовместимые материалы взаимодействуют с организмом согласованно и органично, не вызывая заболеваний.
Биодеградируемые материалы при контактировании с живыми организмами частично или полностью растворяются (поглощаются макрофагами, включаются в метаболические или биохимические процессы) и заменяются живой тканью.
Биоустойчивость материалов — свойство, противоположное биодеградируемости — способность материалов противостоять воздействию биологической среды, сохраняя функциональные свойства.
Для характеристики биосовместимых материалов, имплантируемых в костную ткань, используют термины: биотолерантные, биоинертные и биоактивные.
Биотолерантные материалы взаимодействуют с костью посредством дальнего остеогенеза, т. е. они отделяются от костной ткани прорастающим фиброзным слоем.
Биоинертные материалы практически не взаимодействуют с тканями, находящимися с ними в контакте, не вызывают образования явно выраженного фиброзного слоя (толщина капсулы не превышает 50 мкм) и не стимулируют остеогенез. Абсолютно биоинертных материалов не существует, т.к. на границе ткань-имплантат всегда регистрируется биологический отклик, интенсивность которого зависит от многих факторов (табл.2).
Таблица 2 Факторы, влияющие на биологический отклик костной ткани при контактировании с ортопедическим имплантатом.
Реакции со стороны ткани зависят от: | Реакции со стороны имплантата зависят от: | |
Типа ткани. | Состава имплантата. | |
Повреждения ткани. | Фаз в имплантате. | |
Возраста ткани. | Границ между фазами. | |
Циркуляции крови и лимфы в ткани. | Структуры поверхности. | |
Движения ткани на границе с имплантатом. | Электрохимических реакций. | |
Соответствия места установки имплантата анатомо-физиологическим критериям. | Точности установки имплантата. | |
Механической нагрузки на ткань. | Интенсивности нагрузок. | |
Общих реакций организма (иммунологических, аллергических, нейроэндокринных). | Выполнения функций организмом. | |
Биоактивные материалы вызывают биологический отклик в организме, обусловливающий интеграцию материала и организма. Они предназначены для связывания с биологическими системами, имея целью повышение эффективности лечения, образование или замещение любой ткани или органа, для выполнения тех или иных функций организма. Все биоактивные имплантаты, применяемые в травматологии и ортопедии, объединяет наличие на их поверхности карбонатного слоя, эквивалентного по составу и структуре минеральной фазе кости. Такой слой имеет структуру поликристаллических агломератов, в состав которых при контактировании с костью включаются коллагеновые фибриллы.
Надежность имплантатов — актуальная проблема материаловедения медицинской техники. Она возникла в 50-е годы, когда эндопротезирование тазобедренного сустава стало массовой операцией, вошедшей в повседневную практику многих клиник. В отличие от лекарств, прием которых возможен практически в любое время, регулирование механической системы эндопротеза можно осуществить только путем хирургического вмешательства. Поэтому от эндопротезов суставов требуется безотказная, без ремонта, работа в течение многих лет. Это значит, что прочность и износостойкость материалов, из которых выполнены эндопротезы, не должны сильно изменяться в агрессивном биологическом окружении.
В современных эндопротезах суставов применяют все типы конструкционных материалов: металлы, полимеры, керамику и композиты на их основе. Последние используют, в основном, как биоподражательные материалы, имитирующие структуру и механические свойства естественных тканей. Это является отражением тенденции, возникшей в начале 1990;х годов по инициативе всемирно известных центров, занятых разработкой биоматериалов, — Университета Торонто, Института Medical and Dental Engineering в Японии, IRC в Лондоне. Она состоит в том, что развитие эндопротезирования суставов на современном этапе базируется на использовании материалов нового поколения, разработанных специально для применения в медицине в качестве имплантатов. Период, когда имплантаты изготавливали из лучших технических материалов, заимствованных из электронной техники, точного приборостроения, военно-промышленного комплекса, уходит в прошлое.
Как правило, технический ресурс эндопротезов суставов, установленный путем наблюдений in vivo, значительно меньше ресурса, определенного с помощью механического испытательного оборудования. Тем не менее, различные системы испытаний, имитирующих работу имплантированного эндопротеза, применяются во всех странах-производителях эндопротезов. В России банк данных по трибологическим характеристикам эндопротезов тазобедренного сустава создается в Центральном НИИТО им. Н. Н. Приорова. В Англии жизненный путь всех имплантированных в этой стране эндопротезов контролирует Department of Health’s Medical Devices Agency. Эта же организация проводит имитационные испытания всех конструкций эндопротезов суставов, используемых в ортопедии. Английский Department of Trade and Industry с конца 1990;х годов финансирует программы, направленные на улучшение механических испытаний и прогнозирование технического ресурса эндопротезов суставов. Европейским сообществом приняты три документа (European Medical Devices Directives), имеющие силу закона для стран ЕЭС. Они содержат требования к материалам для эндопротезов суставов, позволяющие свести к минимуму риск для здоровья и безопасности пациентов. Материалы и эндопротезы, отвечающие этим требованиям, несут маркировку «СЕ» как знак их высокого качества и одобренного статуса. Высокий уровень специальных требований к материалам для эндопротезов, недостижимый для традиционных материалов, применяемых в машиностроении и связанных с ним отраслях современной техники, все чаще обусловливает разработку биоматериалов на заказ. Именно такие материалы — индивидуально сконструированные композиты, функциональные полимеры, биоподражательные и биоактивные покрытия на металлических имплантатах и др. — определяют сегодняшний уровень материалов для эндопротезов суставов.
К настоящему времени ортопедия накопила опыт применения в эндопротезах суставов практически всех конструкционных полимерных материалов, которыми располагает техника. Однако нашли постоянное применение только три типа полимеров: сверхвысокомолекулярный полиэтилен (СВМПЭ), полиметилметакрилат (ПММА) и силиконовая резина. СВМПЭ, который предложил использовать в эндопротезах еще Дж. Чанли, до сих пор остается непревзойденным материалом трения в парах с металлами и керамикой из-за in vivo присущих этому материалу износостойкости, инертности продуктов изнашивания, низкого коэффициента трения и свойства самосмазывания. ПММА, являющийся основой костного цемента, также был впервые применен Чанли при эндопротезировании суставов. Из силиконовых эластомеров изготавливают имплантаты в виде гибких стержней, выполняющих функции мелких суставов на пальцах рук и ног.
Сверхвысокомолекулярный полиэтилен получают путем полимеризации мономеров этилена по специальной технологии. Рост длины молекулярных цепей при полимеризации может сопровождаться их ветвлением с образованием боковых звеньев. Полиэтилены низкой плотности (молекулярная масса 30 000−40 000) имеют много боковых звеньев, и соответственно, значительный свободный объем. Полиэтилены высокой плотности (50 000−600 000) и СВМПЭ (молекулярная масса 3 000 000 и выше) имеют очень мало боковых звеньев.
Согласно действующему в США стандарту марки СВМПЭ, используемые для изготовления эндопротезов, имеют плотность 0,930−0,944 г/см3, предел текучести — 19 МПа, предел прочности при растяжении — 27 МПа, относительное удлинение при разрыве — 200%.
Некоторые технологические и физико-механические характеристики СВМПЭ, выпускаемого фирмой Хёхст (GmbH Hoechst AG, Германия) для изготовления эндопротезов суставов, более прочны, чем американские, и стойки к ударным нагрузкам. Эти свойства сохраняются в широком интервале температур, т.к. при кристаллизации из расплава надмолекулярные образования СВМПЭ оказываются связанными между собой «проходными» макромолекулами и физическими узлами (зацепление макромолекул).
Полимерные детали эндопротезов суставов длительно работают под нагрузкой. По триботехническим характеристикам СВМПЭ близок к таким антифрикционным полимерам, как фторопласты и полиамиды. Износостойкость СВМПЭ вдвое превышает износостойкость всех прочих марок полиэтилена. Продукты изнашивания СВМПЭ не вызывают резко отрицательную реакцию мягких тканей, как, например, продукты изнашивания фторопластов. Тем не менее, они не всегда положительно воспринимаются организмом и могут вызвать появление гранулем вокруг частиц инородного тела.
В 1997 г. в Интернете появились сообщения, что швейцарская фирма Зульцер (Sulzer Orthopedics Ltd.), являющаяся одним из крупнейших в мире производителей биоматериалов и медицинских имплантатов, в содружестве с Главной больницей и Институтом технологии Массачузетса (США) разработали и представили на рынок новый тип СВМПЭ для узлов трения эндопротезов. Его получают следующим образом. Заготовки деталей эндопротезов в виде стержней, дисков или пластин, например, из Hostalen GUR, подвергают высокоэнергетической обработке электронными лучами (10 МэВ), а затем отжигу при температуре 125о С (температура плавления СВМПЭ — 137оС). В результате макромолекулы соединяются поперечными связями, и материал приобретает сшитую структуру, которая обеспечивает: 1) более высокую стойкость к старению в биологических жидкостях in vivo, 2) улучшение деформационно-прочностных параметров, 3) увеличение износостойкости имплантатов. После триботехнических испытаний эндопротезов тазобедренного сустава на имитаторе (20 млн. циклов нагружения, что соответствует 20 годам эксплуатации имплантированного эндопротеза) износ вкладыша, выполненного из сшитого СВМПЭ, незначителен. Новообразованная фирма Sulzer Medica USA рекламирует сшитый СВМПЭ как лучший на сегодняшний день полимерный материал трения для эндопротезов суставов.
Полиметилметакрилат составляет основу ортопедического костного цемента.
В клиники его поставляют в виде порошкообразного и жидкого компонентов (2:1 по массе), которые смешивают для приготовления цементной пасты. Порошок (диаметр частиц 30−150 мкм) состоит из ПММА или его сополимера со стиролом, а также из небольшого количества инициатора полимеризации (пероксид бензоила) и, если необходимо, рентгеноконтрастных добавок (сульфат бария). В состав жидкости входят мономер (метилметакрилат), ингибитор (гидрохинон) и активатор (диметил-р-толуол) полимеризации. Ингибитор препятствует полимеризации мономера во время хранения, а активатор инициирует его полимеризацию после смешения с порошком.
При смешении компонентов мономер размягчает частицы полимера, образуя гель. Диметил-р-толуол в жидкой фазе реагирует с порошком пероксида бензола, вследствие чего образуются свободные радикалы бензола. Радикалы взаимодействуют с мономером, разрушая двойные связи в метилметакрилате, что инициирует его полимеризацию. Молекулярная масса ПММА, образовавшегося в этом процессе, больше, чем ПММА, содержащегося в порошке. Некоторое количество мономера испаряется при смешении компонентов цемента, а min испарению соответствует соотношение порошка и жидкости 2:1 по массе. Около 2,5% непрореагировавшего мономера может находиться в цементе в течение 200 суток после отверждения. Мономер оказывает легкое токсическое действие на компоненты сыворотки крови, замедляя ее бактериостатическое действие (препятствующее размножению бактерий).
Отвержденный цемент представляет собой композит, состоящий из твердых частиц порошкового компонента, связанных заполимеризованным мономером, в котором содержатся пузырьки воздуха. Состав и пористость композита определяются маркой цемента и технологией его приготовления. Когда цементную пасту подвергают центрифугированию, пористость композита снижается, а прочность — значительно увеличивается.
Вязкость пасты определяет степень заполнения цементом зазоров между имплантатом и костью. Цементная паста является неньютоновской жидкостью, вязкость которой зависит от скорости сдвига, т. е. она становится более текучей, когда нагнетается в зазор с высокой скоростью и под большим давлением. Когда цементирование осуществляют с помощью специального инструмента (цементного пистолета) паста течет быстрее и лучше заполняет зазоры.
Цементы разных марок имеют различную стойкость к истиранию. По снижению износостойкости костные цементы располагаются в ряд:
CMW (Англия) > Implast (Германия) > акрилоксид (Россия) > Sulfix -6 (Швейцария) > Simpleх Surgical Plain (Англия) > Palacоs (Германия).
Силиконовый эластомер — кремнийорганический полимер, обладающий каучукоподобными свойствами, имеет структурную формулу В низкомолекулярной форме он представляет собой силиконовую жидкость. Основу силиконовых эластомеров, применяемых для изготовления эндопротезов, составляют макромолекулы полидиметилсилоксана (R = R' = - CH3, молекулярная масса — 750 000), содержащие некоторое количество метилвинилсилоксановых звеньев (R' = - CH = CH2), способных образовывать поперечные связи. Это связующее наполняют вспененным кремнием, имеющим большую удельную площадь поверхности (400 м2/г), а затем вулканизируют в присутствии катализаторов (редких металлов и пероксидов). Плотность поперечных сшивок между макромолекулами после вулканизации — одна на 325 атомов кремния. Конечный продукт имеет вид гигантской трехмерной молекулы, из которой удаляют летучие остатки.
Типичные механические характеристики силиконового эластомера марки Dow 372 Silastic (США): предел прочности при растяжении — 9,57 МПа, модуль упругости — 350 МПа, относительное удлинение при разрыве — не менее 400%. После 1,5 лет экспозиции in vivo прочность имплантатов снизилась на 7%, удлинение — на 10%, модуль упругости увеличился на 8% .
Отказы силиконовых эндопротезов суставов первоначально связывали с адсорбцией силиконами липидов (жиров и жироподобных веществ) из тканей, контактирующих с имплантатами, что сопровождалось обесцвечиванием тканей. Изменение конструкции гибкого искусственного сустава сняло проблему адсорбции. Главной причиной отказов силиконовых эндопротезов межфаланговых суставов кисти в настоящее время считают прогрессирующий ревматоидный артрит, приводящий к дегенерации фаланг. Острые кромки фаланг оказывают режущее действие на силиконовые имплантаты при сгибании — разгибании пальцев.
Узкая номенклатура полимерных материалов для эндопротезирования обусловливает необходимость ее расширения.
Керамика Хотя некоторые виды керамических материалов используются в медицине более 25 лет, широкое применение керамики для изготовления эндопротезов суставов началось только в 90-е годы ХХ в. [36]. В ортопедии имеется положительный опыт использования в эндопротезах следующих видов керамики: на основе оксида алюминия Al2O3, оксида циркония ZrO2 и на основе фосфатов кальция — Сa3(PO4)2 и Сa5(PO4)3OH (гидроксиапатит). Привлекательными свойствами керамики являются высокая химическая стабильность, твердость, незначительная деформация под нагрузкой, износостойкость, выносливость и отсутствие проблем со старением в биологическом окружении. Фосфатную керамику относят к биоактивным, медленно растворимым in vivo материалам, в которые врастает костная ткань. Главным недостатком керамики считают ее хрупкость, и поэтому не всегда предсказуемое поведение керамических имплантатов под нагрузкой.
Алюминиевая керамика один из широко применяемых материалов медицинской техники. Она характеризуется очень высокой прочностью при сжатии (предел прочности — 4500 МПа, модуль упругости — 380 ГПа), в то время как показатели прочности при изгибе (предел прочности — 550 МПа) и растяжении — гораздо ниже. Биологический ответ in vivo на имплантаты из алюминиевой керамики минимален. Снижение механических характеристик, зарегистрированное при моделировании влияния биологического окружения in vivo на прочность керамики, объясняют проникновением растворов в поры недостаточно плотного имплантата.
С позиций дислокационной теории прочности хрупкое разрушение керамики объясняется ростом имеющихся в образце трещин, вследствие отсутствия у их вершин локальных зон пластической деформации. В отличие от металлов, при растяжении которых края трещин округляются из-за пластического течения всего образца, керамика практически не деформируется, края трещин в ней остаются острыми, и при нагружении образца трещина растет в длину.
Имплантаты из алюминиевой керамики получают по технологии порошковой металлургии спеканием при 1600 оС заготовок, спрессованных из порошка Al2O3. В качестве добавки, улучшающей спекание, применяют магнезию MgO. Порошок Al2O3 мелкого помола должен иметь min количество примесей, т.к. только чистая керамика обеспечивает требуемую степень биосовместимости. Такие примеси, как силикаты, щелочные оксиды и известковые включения образуют на границах зерен стекловидную фазу с низкой химической стабильностью. Появление стекловидной фазы уменьшает показатели предельной и усталостной прочности имплантатов. Одной из лучших марок алюминиевых керамик для эндопротезов суставов считают Biolox® производства фирмы CeramTec (Германия).
Типичные детали эндопротеза тазобедренного сустава, выполняемые из керамики — шаровая головка бедренного и вкладыш тазового компонентов. Сферические поверхности трения этих деталей подвергают чистовой обработке с помощью алмазного инструмента. После такой обработки узел трения эндопротеза хорошо смачивается синовиальной жидкостью и имеет низкий коэффициент трения.
Детали эндопротезов, выполненные из керамики, обычно стерилизуютоблучением или обработкой паром в автоклаве. До сих пор нет подтверждения того, что при стерилизации происходит старение алюминиевой керамики или снижение технического ресурса алюмокерамических имплантатов. Согласно стандарту их можно стерилизовать столько раз, сколько необходимо. Цвет имплантатов из алюминиевой керамики — белый или слоновой кости — после стерилизацииоблучением приобретает коричневатый оттенок. Интенсивность изменения цвета зависит от температуры и длительности стерилизации. Утверждается, что явления, ответственные за изменения цвета имплантатов, не связаны с ухудшением механических или химических характеристик алюминиевой керамики.
Циркониевая керамика — материал, полученный спеканием порошкообразного оксида циркония ZrO2. Размер зерна циркониевой керамики (0,5 мкм) меньше, чем алюминиевой. Это обусловливает лучшую полируемость и высокую износостойкость циркониевых имплантатов.
Кристаллическую структуру циркониевой керамики стабилизируют введением 3−9% магнезии MgO или оксида иттрия Y2O3. Благодаря высоким механическим свойствам керамика марки ZIOLOX® forte, Y-TZP (стабилизированная Y2O3, с тетрагональной решеткой, циркониевая, поликристаллическая) широко применяется при производстве эндопротезов. Ее более ранним аналогом является керамика марки Mg-PSZ (partially stabilized zirconia — частично стабилизированная двуокисью магния керамика на основе оксида циркония). Обе марки выпускаются фирмой CeramTec, Германия.
Введение
стабилизаторов преследует следующую цель. Исходный ZrO2 может находиться в трех кристаллических фазах — моноклинной, тетрагональной и кубической. Превращения фаз, происходящие при остывании спеченного имплантата, сопровождаются изменениями их объема и образованием трещин. Добавки стабилизаторов инициируют оптимальное протекание фазовых превращений. В вершинах трещин возникают локальные напряжения сжатия, препятствующие росту трещин.
Циркониевая керамика уступает алюминиевой по параметрам прочности при сжатии, но значительно прочнее ее при изгибе. Ее модуль упругости при сжатии выше, чем у сплавов Co-Cr. Спекание имплантатов методом «горячего» изостатического прессования (ГИП) позволяет повысить их плотность и механические свойства. Биологический ответ на имплантаты из циркониевой керамики такой же спокойный, как и на имплантаты из алюминиевой. Испытания in vivo показали, что эндопротезы из циркониевой керамики сохраняют биосовместимость в течение десятков лет. Статистика свидетельствует, что надлежащим образом изготовленные керамические детали эндопротезов, несмотря на хрупкость керамики, достаточно надежны. Их отказы из-за поломок случаются гораздо реже, чем по другим причинам.
В 1996 г. английское Агентство по изделиям медицинской техники (Medical Device Agency, MDA) опубликовало отчет, где сообщалось, что стерилизация увеличивает вероятность поломки шаровых головок, изготовленных из циркониевой керамики. Отмечено, что вызванное стерилизацией ухудшение качества обработки головок привело к повышению износа сопряженных деталей трения, выполненных из СВМПЭ. По мнению Агентства, стерилизация паром должна быть исключена из практики подготовки имплантатов из ZrO2.
Цвет цирконо-оксидных имплантатов — сероватый — становится розово-серым после г-облучения. Методами спектроскопии показано, что изменение цвета обусловлено стимулированными облучением электронными переходами на локальных дефектах кристаллической решетки ZrO2.
Сырье для циркониевой керамики в основном добывается в Южной Африке и Австралии. Некоторые из видов этого сырья содержат радиоактивные примеси (уран и торий). После того, как это было обнаружено, производители эндопротезов стали использовать очищенное сырье, и проблема радиоактивности циркониевой керамики была снята. Сырье для алюминиевой керамики не содержит радиоактивных примесей.
Керамика на основе фосфата кальция CaP характеризуется самой высокой среди технических материалов степенью биосовместимости. Ее химическая структура подобна структуре эндогенной (образовавшейся внутри организма) кости, поэтому вокруг имплантата не образуется фиброзная капсула, отсутствуют воспаление и реакция организма на инородное тело, имплантат не оказывает токсического действия на ткани и находится в тесном контакте с костью. Керамика на основе фосфата кальция взаимодействует с контактирующей с ней костной тканью, образуя химические связи.
В ортопедии нашли применение два кальциево-фосфатных керамических материала: на основе фосфорнокислого кальция Ca (PO4)2 и на основе гидроксиапатита Ca5(PO4)3OH. Они оба биоактивны и хорошо воспринимаются организмом in vivo. Наибольшее сходство с естественной костной тканью имеет химическая и кристаллическая структура гидроксиапатита.
Скорость растворения фосфатной керамики в биологических жидкостях in vivo достаточно высока и зависит от удельной поверхности имплантатов. Ca (PO4)3 растворяется в кислых средах в 12,3 раза быстрее, а в щелочных — в 22,3 раза быстрее, чем гидроксиапатит. Поскольку прочность блочных образцов фосфатной керамики невысока, последнюю применяют преимущественно в виде покрытий на металлических деталях эндопротезов. В этом качестве более предпочтителен гидроксиапатит, который лучше взаимодействует с костной тканью и медленнее растворяется in vivo, обеспечивая благоприятные условия для передачи нагрузки от эндопротеза на костно-мышечный аппарат.
Нанесение фосфатно-керамических покрытий на детали эндопротезов осуществляют методом плазменного напыления в регулируемых газовых средах, например Ar/H2 или Ar/N2. Порошковые частицы керамики увлекаются потоком газа, расплавляются в плазме, движутся к подложке и осаждаются на ней в виде покрытия. Под действием температуры плазмы керамические частицы частично разлагаются, поэтому микроструктура, фазовый состав, кристалличность, содержание гидроксилов, молярное отношение Ca / P покрытия существенно отличаются от состава исходной керамики и зависят от параметров напыления. При температуре 1400 oС в отсутствие воды гидроксиапатит разлагается:
2Сa5 (PO4)3 OH = 2Сa3 (PO4)2 + Сa4 P2O9 + H2O.
Толщина покрытий на металлических деталях эндопротезов должна быть оптимизирована по критериям прочности и времени растворения фосфатной керамики in vivo. Тонкие покрытия (до 10−15 мкм) имеют высокие показатели адгезионной и механической прочности, но растворяются в короткие сроки после имплантации. Более толстые покрытия обеспечивают длительное контактное взаимодействие с костной тканью, но могут разрушаться под сдвиговой нагрузкой, приводя к расшатыванию эндопротеза. Оптимальная толщина покрытий составляет 50−100 мкм.
К сожалению, в литературе можно найти очень мало информации о физико-химических характеристиках как исходных порошков фосфатной керамики, так и конечных биосовместимых покрытий, тем более, в зависимости от технологических параметров их формирования. Эта информация, как правило, является конфиденциальной, содержащей секреты (know-how) производителей эндопротезов. Знание этих секретов позволяет устранить отказы эндопротезов, вызванные недостаточной биосовместимостью покрытий и прочностью фиксации эндопротезов при имплантации.
Композиты Композиционные материалы или композиты представляют собой многофазные системы, которые состоят их двух или более компонентов (фаз), сохраняющих индивидуальность (структуру и свойства) своего вещества в составе композита. На рисунке схематически показана структура композиционного материала. Компонент, непрерывный в объеме композита, называют матрицей или связующим.
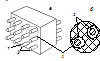
Рис. 1 Схема композиционного материала: 1 — матрица, 2 — армирующие компоненты, 3 — переходный слой на границе раздела компонентов
Другие, чаще всего, упрочняющие или армирующие компоненты распределены в матрице в определенном порядке. Переходные поверхностные слои расположены на границах раздела матрицы и других компонентов. Свойства вещества переходного слоя (третьей фазы) отличаются от свойств основных фаз. Переходный слой определяет прочность сцепления (адгезию) матрицы и других компонентов и в большой мере — служебные свойства композита и их постоянство во времени. При механическом нагружении композита напряжение достигает max значений на границах раздела компонентов.
Главная цель применения композитов в эндопротезах суставов — обеспечить эластичность имплантатов, адекватную эластичности костной ткани. Несмотря на значительные успехи в разработке и использовании металлических имплантатов, клинический опыт показал несостоятельность попыток придать им необходимую эластичность. Все известные сегодня эластичные конструкции закрепляемых в кости металлических деталей эндопротезов (ножки в виде пучков сходящихся или расходящихся стержней, имеющие специальный профиль, рассеченные ножки и др.) подвержены раннему разрушению. Кроме того, металлы не воспринимаются живым организмом как биосовместимые материалы. Даже при отсутствии острой первичной реакции на инородное тело, организм отвечает на установку металлического имплантата дистрофией контактирующих с ним костных и мягких тканей, отрицательной реакцией на продукты изнашивания металлов, а в отдаленные сроки после эндопротезирования неизбежно инициирует коррозию деталей эндопротезов из неблагородных металлов.
Углеродные композиты, применяемые в эндопротезах, содержат углеродные волокна как армирующие элементы углеродных матриц.
Чаще всего заготовку эндопротеза формуют из высокомодульных углеродных волокон или нитей, используя методы ткачества, послойной укладки скрепленных прошивкой углеродных тканей, лент или пучков углеродных волокон. Матричную композицию вводят в заготовку путем пропитки или осаждают на волокнах в виде покрытий.
В качестве исходных пропиточных составов применяют карбонизирующиеся фенольные или фурфуроловые смолы, а также пеки из каменноугольной смолы или нефти (карбонизация — повышение содержания углерода в органическом веществе, происходящее под действием тепла, света, ионизирующих излучений и т. п.). Пропитанную и отвержденную заготовку подвергают карбонизации, нагревая до 650−1100 оС в вакууме или инертной (азотной) газовой среде. Выход углерода (кокса) из синтетических смол составляет 70−75%, из каменноугольных — 50−65%. После этого коксовую матрицу графитизируют путем нагревания до 2600−2700 оС. С целью повышения плотности композита эти технологические циклы (пропитку, отверждение, карбонизацию, графитизацию) повторяют. Окончательную термообработку проводят для удаления летучих продуктов, завершения процессов структурообразования и снижения остаточных напряжений в заготовке.
Осаждение матричного материала на углеродных волокнах осуществляют газофазным методом. Для этого через нагретый до 1500 оС углеродный каркас продувают метан или природный газ. На волокнах каркаса осаждаются углеродные покрытия толщиной до 1 мм, которые затем подвергают графитизации. При комбинировании газофазного осаждения и пропитки смолой достигаются наибольшие плотность и прочность композита. В зависимости от особенностей технологии, исходного материала матрицы, порядка укладки углеродного волокнистого каркаса и других факторов, механические свойства эндопротезов можно регулировать в широких пределах.
Углеродная матрица композитных эндопротезов имеет высокую усталостную прочность и хорошо полируется. Износостойкость эндопротезов значительно повышается с увеличением плотности углеродной матрицы. Проблемой является низкая износостойкость углеродных эндопротезов при абразивном изнашивании, которую частично решают путем нанесения газофазных углеродных покрытий на поверхности трения. Биологический ответ организма на углеродные композиты не зависит от технологии их формирования. Углеродные частицы износа, которые накапливаются в лимфоузлах, не вызывают отрицательных реакций организма. За время наблюдения от 8 до 12 недель в контакте кости и углеродного имплантата не образовывалась фиброзная капсула, а кость врастала в микропоры (50−150 мкм) имплантата.
Государственный научно-исследовательский институт конструкционных материалов на основе графита (НИИГрафит) в Москве разработал и выпускает углеродные материалы типа ИНТОСТ для эндопротезов. Материал ИНТОСТ-3 получают путем газофазного нанесения углеродных покрытий на ультрадисперсные частицы непрокаленного кокса, находящиеся в псевдоожиженном слое, последующего прессования частиц в форме и карбонизации заготовок.
Углеродный материал ИНТОСТ-4 имеет сквозные поры диаметром 18−100 мкм. Его используют в качестве заместителей костных дефектов и для изготовления деталей эндопротезов коленного сустава, входящих в костно-мозговой канал. После имплантации костная ткань врастает в микропоры, обеспечивая фиксацию эндопротеза при отсутствии некроза (омертвения) окружающих тканей.
Полимерные композиты состоят из углеродных армирующих длинных или коротких волокон, заключенных в полимерную матрицу. Короткие волокна придают матрице меньшую прочность, чем длинные, но обеспечивают возможность переработки композитов в изделия высокопроизводительными методами экструзии и литья под давлением. Детали эндопротезов из композитов, содержащих углеродные волокна, формуют «горячим» прессованием стопки листов, которые состоят из пропитанных полимерным связующим углеродных волокон (препреги) или из чередующихся углеродных и полимерных волокон. Направления углеродных волокон в каждом слое параллельны или составляют некоторый угол с осью формуемой детали эндопротеза (от 0 до 90о). Заготовка образуется в результате сплавления полимерного связующего, содержащегося в разных слоях.
Полимерные армированные углеволокнами композиты для эндопротезов американского производства изготавливают на матрицах из полисульфонов или полиэфиркетонов. Последние имеют поликристаллическую структуру и химически более стойки, чем полисульфоны, имея одинаковые механические свойства. Структура полисульфонового армированного углеволокнами эндопротеза представлена на рисунке. Ножка эндопротеза состоит из композитного сердечника в виде пучка однонаправленных углеродных волокон в полисульфоновой матрице. Сердечник окружен оплеткой из углеродных волокон, и эта система капсулирована в оболочке из полисульфона. Поперечные размеры ножки согласованы с размерами костно-мозгового канала, в который будет имплантирован эндопротез.
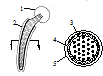
Рис. 2 Схема композитного эндопротеза тазобедренного сустава: 1 — головка, 2 — ножка, 3 — сердечник, 4 — оплетка, 5 -оболочка
НИИГрафит выпускает предназначенный для изготовления эндопротезов суставов композит ИНТОСТ-1, состоящий из коротких углеродных волокон и полиамидной матрицы. Его модуль упругости вдвое ниже, чем у костной ткани, но предел прочности при изгибе достаточно высок — 300 МПа. Благодаря низкому модулю упругости контактные напряжения на границе кость-композит распределяются равномерно и при бесцементной фиксации эндопротеза не вызывают резорбцию окружающих тканей. Из материала ИНТОСТ-1 изготавливают ножки эндопротезов тазобедренного, пястно-фалангового, межфаланговых суставов, фиксаторы для лечения переломов шейки бедра и длинных костей.
Биоткани имеют достаточно стабильную структуру, которая не повреждается практически до разрушения. Это подтверждает высказанную ранее мысль, что биоткани и металлы — принципиально разные материалы.
Самые твердые из анализируемых материалов — керамика и углерод. Они же вместе с металлами являются самыми прочными, гораздо прочнее биотканей. Это никак не умаляет достоинств искусственных материалов, т.к. прочность конструкций, к которым относятся эндопротезы, никогда не бывает излишней. Тем не менее, биоткани, значительно уступающие искусственным материалам по прочности, образуют естественные суставы, с которыми по трибологическим параметрам не могут сравниться никакие технические узлы трения, в том числе, искусственные суставы. Это — самая большая проблема эндопротезирования суставов.
Таким образом, анализ данных приводит к выводу о несовершенстве технических материалов как аналогов биотканей. Первые служат лишь для восприятия и передачи механических нагрузок, вторые являются управляемыми биологическими системами, свойства которых зависят от распределения биопотенциалов и наполнения биологическими жидкостями. Создание подобных систем с использованием в качестве компонентов технических материалов — благородная цель разработчиков искусственных суставов.