Влияние специализированного белково-углеводного продукта, обогащенного витаминами и минеральными веществами, на состояние больных с желудочно-кишечной патологией и остеопенией

Таким образом, включение в диету больных продукта, содержащего наряду с другими минеральными веществами (цинк, марганец, медь) кальций, несколько улучшало состояние костной ткани пациенток. Очевидно, для предотвращения снижения минеральной плотности костной ткани необходим постоянный или длительный прием высоких доз кальция (500 мг/сут) в сочетании с витаминно-минеральными комплексами, что… Читать ещё >
Влияние специализированного белково-углеводного продукта, обогащенного витаминами и минеральными веществами, на состояние больных с желудочно-кишечной патологией и остеопенией (реферат, курсовая, диплом, контрольная)
Аннотация
Включение в диетотерапию пациенток с заболеваниями желудочно-кишечного тракта и остеопенией в течение 6 мес специализированного продукта, содержащего 50% от рекомендуемого суточного потребления кальция, 20% белка, 11 минеральных веществ и 11 витаминов в дозах, составляющих 17−60% от рекомендуемого суточного потребления, сопровождалось увеличением минеральной плотности костной ткани, но не ликвидировало существующий дефицит витаминов В2 и Б. Полученные данные обосновывают целесообразность разработки и включения в диетотерапию специализированных продуктов с заданным химическим составом, предназначенных для конкретной категории больных.
Ключевые слова: специализированный белково-углеводный продукт, заболевания желудочно-кишечного тракта, остеопения, витамины Редуцированные щадящие диеты, составленные на основе тщательно измельченных и термически обработанных обедненных микронутриентами блюд, у лиц с заболеваниями желудочно-кишечного тракта (ЖКТ) могут приводить к полигиповитаминозным состояниям [4] и снижению массы тела. Поскольку недостаточное потребление витаминов, кальция и других минеральных веществ является алиментарным фактором риска развития остеопороза [2, 13, 23], пациенты с резекцией желудка и (или) тонкой кишки относятся к группе риска развития этого заболевания [12, 25]. Дефицит витамина D и пониженная минеральная плотность костной ткани у больных гастроэнтерологического профиля, в том числе у перенесших операционное вмешательство на органах пищеварения, выявляются чаще, чем у пациентов с другой патологией [10−12, 15, 16, 19, 22, 24] .
Поскольку недостаточная обеспеченность витаминами и минеральными веществами служит в основном отражением общих дефектов питания, а не результатом нарушения процессов всасывания и усвоения веществ в организме [4], обусловленного характером заболевания, обогащение рациона больных необходимо для ликвидации алиментарного дефицита указанных нутриентов. Для этих целей чаще всего используются препараты кальция или комбинированные препараты, содержащие соли кальция органического и неорганического происхождения (нередко в сочетании с витамином D), а также сочетание кальция и полусинтетического кальцитонина. В настоящее время очень большое значение уделяется сбалансированному потреблению кальция и фосфора в составе специализированных пищевых продуктов. Однако принципиальным остается вопрос, может ли потребление подобных продуктов ликвидировать у пациентов с заболеваниями органов ЖКТ дефицит кальция, позитивно влиять на плотность костной ткани и предупреждать ее уменьшение.
В настоящее время на потребительском рынке представлен целый ряд специализированных продуктов для энтерального питания с заданным химическим составом.
В задачу данного исследования входила оценка эффективности использования в диетотерапии пациентов с заболеваниями ЖКТ и остеопенией одного из таких специализированных продуктов, содержащих белок, витамины, кальций и другие минеральные вещества.
Работа выполнена в НИИ питания РАМН. В исследование (продолжительностью 6 мес) были включены 27 женщин с заболеваниями ЖКТ, у которых, по данным остеоденситометрии, была выявлена остеопения шейки бедренной кости и (или) тела позвонков поясничного отдела позвоночника (показатели по Т-критерию от -1,0 до -2,4 SD). Большинство больных (свыше 70%) составили пациентки, перенесшие гастрэктомию по поводу заболевания желудка. В число обследованных были включены пациентки после различной по протяженности резекции тонкой кишки, больные, страдающие язвенной болезнью двенадцатиперстной кишки вне стадии обострения, хроническим панкреатитом, синдромом раздраженного кишечника. Длительность основного заболевания составляла от 6 мес до 12,9±3,4 года, индекс массы тела больных в среднем равнялся 21,2±0,8 кг/м2. Все женщины находились в периоде постменопаузы, длительность менопаузы составила 15,9±2,0 года. У всех пациенток, помимо основного заболевания, имелась сопутствующая патология эндокринной или опорно-двигательной системы, которая, однако, не была превалирующей и не требовала соответствующей медикаментозной терапии. Медикаментозная терапия основных заболеваний включала ферментные и антацидные препараты.
Все пациенты дали письменное информированное согласие на участие в исследовании. Критерии исключения: наличие в анамнезе мочекаменной болезни, непереносимость препаратов кальция, аллергические реакции на прием поливитаминных комплексов. Больные, включенные в исследование, методом случайной рандомизации были разделены на 2 группы без достоверных различий по возрасту обследованных и выраженности остеопатии.
Больные основной группы дополнительно к основному высокобелковому рациону получали специализированный продукт (СП) ванильное (свидетельство госрегистрации № 77.99.19.4.У.3956.4.05 от 13.04.2005) и/или шоколадное (№ 77.99.19.3.У.7477.7.05 от 06.07.2005). Химический состав этого СП приведен в нашей более ранней работе, посвященной использованию данного продукта у больных с сердечнососудистыми заболеваниями, ожирением и остепенией [6]. Продукт предназначен для оптимизации питания в качестве дополнительного источника белка, витаминов и минеральных веществ. Обследованные с заболеваниями ЖКТ и остеопенией принимали СП в виде напитка, приготовленного путем смешивания или взбивания 32 г сухой смеси (2 мерные ложки) с 240 мл холодной кипяченой воды, обезжиренного молока или другого напитка. Продолжительность приема СП составила 6 мес, причем в течение 1-го месяца больные находились в стационаре Клиники лечебного питания НИИ питания РАМН, а остальные 5 мес — в домашних условиях.
Суточная доза СП обеспечивала поступление около 20% от рекомендуемого суточного потребления белка, около 50% кальция, 30% фосфора, 10−25% калия и магния, 15−75% микроэлементов, около 100% биотина и от 17 до 60% различных витаминов (всего — 11).
Из 16 пациенток, первоначально включенных в основную группу, закончили исследование 12 (средний возраст — 62,7±2,7 года, длительность менопаузы — 15,0±2,7 года, минеральная плотность костной ткани — 0,863±0,030 г/см2, Т-критерий — -1,8±0,1). Две участницы в ходе исследования отказались от дальнейшего участия (без указания объективных причин); у одной пациентки, у которой в качестве побочного действия наблюдалось вздутие живота, прием продукта был отменен, одна больная была исключена из дальнейшего обследования из-за развития инсульта. У остальных пациенток нежелательных последствий от употребления продукта не наблюдалось.
Группу сравнения составили 11 пациенток, не получавших в течение всего срока обследования СП и другие препараты кальция и (или) витамины (средний возраст больных — 66,4±2,2 года, длительность менопаузы — 18,5±2,3 года, минеральная плотность костной ткани — 0,818±0,037 г/см2, Т-критерий —2,2±0,3).
Плотность костной ткани головки бедренной кости и тела позвонков поясничного отдела позвоночника оценивали с помощью двухэнергетической рентгеновской абсорбциометрии на денситометре «Lunar» (США), рассчитывая величину Т-критерия. Об обеспеченности витаминами судили по их концентрации в сыворотке крови [14]. Витамин С (аскорбиновую кислоту) определяли методом визуального титрования реактивом Тильманса; витамин В2 (рибофлавин) — титрованием рибофлавинсвязывающим апобелком; витамин, А (ретинол) и витамин Е (токоферолы) — методом ВЭЖХ, витамин D — 25-гидроксивитамин D3 (25-ОН D3) — иммуноферментным методом. Уровень витамина в крови меньше нижней границы нормы [14] относили к недостаточной обеспеченности. В качестве маркеров костного метаболизма определяли концентрацию остеокальцина и паратгормона (ПТГ) в сыворотке крови иммуноферментным методом, используя для этого реактивы фирмы «Nordik Bioscience Diagnostics» (Великобритания) и «Diagnostics system laboratories» (США). Магний в сыворотке крови определяли на биохимическом анализаторе Konelab (Финляндия).
Фактическое питание больных в домашних условиях изучали с помощью компьютерной программы «Анализ состояния питания человека» (версия 1.2 НИИ питания РАМН, 2003;2005) [7].
Обследование больных с помощью биохимических методов проводили трижды: до начала приема, через 3 мес и 6 мес приема продукта. Денситометрическое исследование у пациенток осуществляли дважды — перед началом приема продукта (в сентябре-октябре) и после его окончания (в марте-апреле).
Поскольку исследуемые выборки из-за малого объема не соответствовали нормальному распределению, анализ полученных данных проводили по непараметрическому критерию Манна-Уитни. Достоверность разности выборочных долей, а также при нормальном распределении достоверность различия средних показателей определяли по f-критерию Стьюдента.
Анализ фактического питания пациенток в домашних условиях (табл. 1) показал, что достоверных различий между рационами больных основной группы и группы сравнения не было. Отклонения от норм рационального питания в обеих группах носили однонаправленный характер.
Средняя энергетическая ценность рационов каждой группы находилась в пределах нормы, содержание в рационе общего количества жира превышало рекомендуемое на 40%. Рационы содержали недостаточное количество пищевых волокон. У 50−58% пациенток обеих групп содержание белка в рационах не достигало рекомендуемой нормы. Потребление кальция у больных обеих групп приближалось в среднем к рекомендуемому уровню, а фосфора — превышало рекомендуемую норму в 1,4−1,5 раза. Вследствие этого отношение Са: Р существенно отличалось от оптимального (1:1) [8, 9, 17], составляя 1:1,4−1:1,6. Расчетная оценка потребления витаминов показала, что поступление витамина С превышало рекомендуемый уровень для здоровых людей в 1,4−1,8 раза. Потребление витаминов, А и группы В у больных обеих групп в среднем не достигало рекомендуемых норм.
На рис. 1 содержание некоторых нутриентов в домашних рационах представлено в виде звездчатой диаграммы. Каждая ось соответствует потреблению конкретного витамина, минерального вещества или белка. Контур внутреннего многоугольника соответствует рекомендуемому уровню потребления того или иного нутриента, а пространство внутреннего многоугольника отражает недостаточное поступление нутриентов с рационом. Прием СП позволил увеличить среднее потребление витаминов А, В1, В2 и магния до рекомендуемого уровня. Кроме того, включение в диету СП увеличило поступление кальция у лиц с исходно пониженным его потреблением (800 мг/сут) и позволило достоверно (р<0,05) повысить соотношение Са: Р в рационе с 0,62±0,05 до 0,81±0,04, приблизив его к оптимальному. Таким образом, модификация рациона состояла в повышении потребления белка, витаминов, кальция, других минеральных веществ.
Включение СП в рацион сопровождалось уменьшением (р<0,10) в 4,5 раза числа пациенток, у которых содержание белка в рационе не достигало рекомендуемого уровня (рис. 2). Число лиц с недостаточным потреблением кальция и железа среди пациенток этой группы уменьшилось в 2−2,3 раза. Лица с пониженным потреблением фосфора перестали выявляться вовсе. Количество обследованных с адекватным потреблением витаминов А, В2, ниацина и магния увеличилось в 1,5−1,6 раза, витамина В1 — в 1,7 раза.
Таблица 1. Пищевая и энергетическая ценность суточного рациона питания больных в домашних условиях.
Показатель. | Основная группа (л=12). | Группа сравнения (л=11). | |||
М±т | % отклонения. | М±т | % отклонения. | ||
Калорийность, ккал. | 2455±304. | — 2±12. | 2390±291. | — 4±12. | |
Белок, г. | 78,0±8,3. | 4±11. | 79,3±8,1. | 6±11. | |
Жир, г. | 119,2±15,9. | 44±19. | 115,5±17,7. | 39±21. | |
Углеводы, г. | 252±36. | — 31±10. | 240±25. | — 34±7. | |
Пищевые волокна, г. | 9,4±2,0. | — 66±7. | 7,1 ±1,6. | — 74±6. | |
Натрий, г. | 3,6±0,3. | 49±12. | 3,3±0,3. | 37±14. | |
Калий, мг. | 4038±852. | 62±34. | 3329±699. | 33±28. | |
Магний, мг. | 365±53. | — 9±13. | 329±52. | — 18±13. | |
Фосфор, мг. | 1361 ±168. | 51 ±19. | 1361 ±167. | 51 ±19. | |
Кальций, мг. | 889±159. | — 13±15. | 992±170. | — 3±17. | |
Кальций/Фосфор | 0,62±0,05. | 0,69±0,05. | |||
Железо, мг. | 17,9±2,4. | 19±16. | 15,3±2,0. | 2±14. | |
Витамин А, мг. | 0,81±0,18. | — 19±18. | 0,82±0,22. | — 18±22. | |
Витамин В1, мг. | 1,2±0,2. | — 21±13. | 1,0±0,2. | — 32±12. | |
Витамин В2, мг. | 1,4±0,2. | — 25±12. | 1,4±0,2. | — 22±12. | |
Ниацин, мг. | 16,2±2,1. | —19±11. | 15,1 ±2,0. | —25±10. | |
Витамин С, мг. | 128±21. | 83±29. | 97±22. | 39±31. | |
Переносимость СП была удовлетворительной. Аллергических реакций не наблюдалось. 10 из 12 пациенток основной группы отметили улучшение общего самочувствия. За время наблюдения масса тела пациенток основной группы и группы сравнения не изменилась.
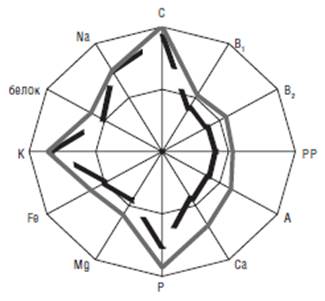
Рис. 1. Содержание нутриентов (в % от РНП) в исходном рационе (пунктирная линия) и с включением СП (сплошная линия) пациентов в домашних условиях
Критериями оценки эффективности использования СП служили показатели обеспеченности больных витаминами и доля лиц с недостаточностью этих микронутриентов, а также уровень маркеров костного метаболизма в сыворотке крови и величина минеральной плотности костной ткани. диетотерапия остеопения продукт витамин На первом этапе в динамике было исследовано влияние приема СП на витаминный статус пациентов. Как видно из данных табл. 2, в исходном периоде у больных обеих групп отмечалась достаточно хорошая обеспеченность витамином С: среднее его содержание в сыворотке крови больных соответствовало оптимальной обеспеченности (>0,7 мг/дл). Дефицит этого витамина (уровень в крови <0,4 мг/дл) выявлен только у одной пациентки из группы сравнения, а концентрация вблизи нижней границы нормы — у 18−25% обследованных. Через 3 мес приема СП концентрация аскорбиновой кислоты в сыворотке крови больных в среднем достоверно (р<0,05) увеличилась и вплоть до 6 мес приема сохранялась на этом уровне. К концу срока наблюдения у одной пациентки уровень аскорбиновой кислоты превысил верхнюю границу нормы.
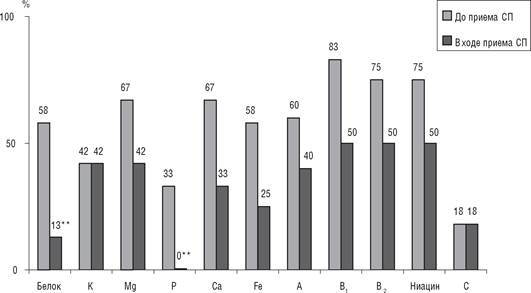
Рис. 2. Относительное количество (в %) больных, у которых потребление нутриентов не достигало рекомендуемого уровня до и после включения в рацион СП.
Примечание. * - р<0,10.^.
Таблица 2. Влияние введения специализированного продукта в диетотерапию женщин с заболеваниями желудочно-кишечного тракта и остеопенией на обеспеченность витаминами и минеральную плотность костной ткани в динамике.
Показатель. | Группа сравнения. | Основная группа. | |||||||||
Исходное обследование (М±т) | % лиц с уровнем ниже нормы. | через 6 мес (М±т) | % лиц с уровнем ниже нормы. | Исходное обследование (М±т) | % лиц с уровнем ниже нормы. | через 3 мес (М±т) | % лиц с уровнем ниже нормы. | через 6 мес (М±т) | % лиц с уровнем ниже нормы. | ||
f-критерий. | — 2,2±0,3. | — 2,3±0,2. | — 1,8±0,1. | ; | ; | — 1,6±0,2. | |||||
— 3,8 — -1,1. | — 3,8 — -1,1. | — 2,4 — -1,1. | СОо" 11СчГ1. | ||||||||
С, мг/дл. | 0,83±0,13. | 0,70±0,06. | 0,67±0,05. | 0,99±0,07*. | 1,00±0,11*. | ||||||
0,25−1,70. | 0,4−1,00. | (0,40−1,00). | 0,50−1,40. | 0,50−2,00. | |||||||
А, мкг/дл. | 52,7±2,2. | 63,5±9,2. | 63,7±7,0. | 71,2±7,4. | 67,6±5,6. | ||||||
44,5−61,5. | 38,7−120,7. | 34,1−120,7. | 42,1−125,4. | 42,5−97,8. | |||||||
Е, мг/дл. | 1,3±0,1. | 1,2±0,1. | 1,1±0,1. | 1,2±0,1. | 1,2±0,1. | ||||||
0,8−1,7. | 0,8−1,6. | 0,7−1,7. | 0,6−1,8. | 0,7−2,0. | |||||||
В2, нг/мл. | 4,5±0,8. | 4,9±0,5. | 6,3±0,7. | 7,3±1,6. | 7,0±1,4. | ||||||
1,1 -9,2. | 3,0−8,6. | (2,8−12,4). | 0,7−21,8. | 0,7−19,7. | |||||||
25-ОН D3, нмоль/л. | 72,3±10,9. | 57,0±4,8. | 67,6±5,5. | ; | ; | 52,9±2,9*. | |||||
21,9−155,0. | 40,4−96,4. | 40,4−96,7. | 28,4−62,4. | ||||||||
У больных из группы сравнения изменений концентрации аскорбиновой кислоты в сыворотке крови не произошло. Таким образом, несмотря на низкое содержание витамина С в СП (17% от рекомендуемой нормы потребления — РНП), продолжительный прием этого продукта позволил оптимизировать обеспеченность витамином С всех пациенток, за исключением одной больной, перенесшей за 1 нед до окончания исследования острое респираторное заболевание. Полученные результаты согласуются с данными о том, что хотя недостаточность витамина С и ликвидируется быстрее, чем дефицит других витаминов, однако при его низких дозах для оптимизации С-витаминного статуса требуется значительное время [5].
При первичном обследовании все больные были хорошо обеспечены витамином А: средняя концентрация ретинола в сыворотке крови находилась в пределах нормы (см. табл. 2). Дефицит витамина, А не обнаруживался. Лишь у одной пациентки с синдромом нарушенного пищеварения и всасывания после гастроэктомии была выявлена маргинальная обеспеченность (его уровень в крови варьировался от 30 до 35 мкг/дл). После включения в диетотерапию СП, суточная доза которого содержала 38% от РНП витамина А, маргинальная обеспеченность ретинолом перестала выявляться. При этом средняя концентрация ретинола в сыворотке крови пациентов практически не изменилась.
Содержание витамина Е (см. табл. 2) у больных обеих групп при первичном обследовании находилось на оптимальном уровне (норма — 0,8−1,5 мг/дл). После приема СП, суточная доза которого содержала 50% от РНП витамина Е, его концентрация у больных основной группы не изменилась. Лишь у одной пациентки с синдромом нарушенного пищеварения и всасывания после гастроэктомии, имевшей маргинальную обеспеченность витамином А, выявлялся сниженный уровень токоферолов в сыворотке крови, который не повысился в ходе употребления СП. Таким образом, поскольку исходно пациентки были хорошо обеспечены жирорастворимыми витаминами, А и Е, повышения их уровня в сыворотке крови у большинства обследованных при приеме СП не происходило.
Среднее содержание витамина D в исходном периоде у больных обеих групп находилось на оптимальном уровне (норма — 47,7−144 нмоль/л). Однако оказалось, что хотя средние концентрации 25-ОН Dз не различались, дефицит витамина D у пациентов группы сравнения выявлялся в 2,3 раза чаще, чем в основной группе, т. е. по обеспеченности больных этим витамином группы оказались неравноценны. В конце исследования средняя концентрация витамина D в сыворотке крови больных обеих групп понизилась (см. табл. 2), оставаясь в пределах нормы, однако количество пациенток с недостатком этого витамина в основной группе увеличилось. Таким образом, дополнительный прием небольшой дозы витамина D (25% от РНП), содержавшейся в СП, не позволил предотвратить сезонное ухудшение обеспеченности организма этим витамином. Это согласуется с данными исследований, проведенных в Германии, в ходе которых было установлено, что сезонное снижение уровня витамина D в сыворотке крови можно предотвратить ежедневным приемом в период с октября по март по 500 МЕ витамина D в сочетании с 500 мг кальция [18].
При первичном обследовании выяснилось, что средняя концентрация рибофлавина в сыворотке крови у больных обеих групп находилась (см. табл. 2) вблизи нижней границы нормы (5 нг/мл). Известно, что для достоверного повышения уровня рибофлавина в крови при дополнительном приеме витамина В2 в дозе около 50% от РНП требуется 2−4 мес [5]. Содержание витамина В2 в СП составляло 33% от РНП. В результате модификации рациона поступление этого витамина по-прежнему не достигало рекомендуемой нормы у половины обследованных (см. рис. 2). Повидимому, это и стало причиной несущественного влияния приема СП на рибофлавиновый статус больных. Положительная динамика наблюдалась только у 3 обследованных с исходным дефицитом витамина В2. У 4 пациенток (с адекватной обеспеченностью этим витамином), показатели оставались в пределах нормы. Число лиц с дефицитом витамина В2 сохранилось, при этом средняя концентрация рибофлавина у больных не изменялась (см. табл. 2).
Суммируя полученные результаты (рис. 3), можно сделать вывод, что включение СП в диету больных с заболеваниями ЖКТ и остеопенией сопровождается достоверным увеличением концентрации витамина С в крови. Однако улучшения обеспеченности обследованных пациентов витаминами, А и Е не наблюдается, что, очевидно, объясняется исходно оптимальным уровнем этих витаминов в сыворотке крови. Вследствие низкого содержания в СП витаминов В2 и D (25−33% от РНП) улучшения обеспеченности ими указанных больных также не наблюдалось. Таким образом, для улучшения витаминного статуса пациентов с заболеваниями ЖКТ и остеопенией целесообразно использовать пищевые продукты, обогащенные витаминами, или витаминно-минеральные комплексы с более высоким содержанием витаминов группы В и витамина D.
Использование в диете СП, в составе которого содержится магний в дозе 25% (от РНП), не повлияло на его концентрацию в сыворотке крови пациенток: 0,89±0,04 ммоль/л, исходного — 0,92±0,04 ммоль/л.
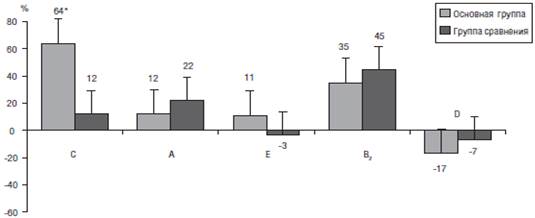
Рис. 3. Изменение концентрации витаминов в сыворотке крови (в % от исходного уровня) через 6 мес приема СП, содержащего витамины в дозе 17−60% от РНП
Примечание. * - р<0,05 изменения показателя в группе сравнения.
При этом дефицит магния у двух пациенток, перенесших резекцию тонкой кишки, сохранялся.
Известно, что при прогрессировании остеопороза у женщин в постменопаузе увеличивается резорбция костной ткани за счет повышения в сыворотке крови концентрации ПТГ, которая может возрастать при дефиците витамина D, избыточном потреблении фосфора и натрия. Однако прием больными СП в наших наблюдениях не сопровождался изменением в сыворотке крови концентрации ПТГ, составившей 54,5±7,8 пг/мл (в начале исследования — 56,0±4,0 пг/мл). Лишь у двух обследованных пациенток сохранился повышенный уровень ПТГ, в то время как у большинства он определялся в пределах нормы (16−62 пг/мл).
Учитывая, что уровень остеокальцина в сыворотке крови рассматривается в качестве одного из наиболее информативных маркеров костеобразования, у больных, принимавших СП, этот показатель определяли в динамике. У 4 из 11 обследованных концентрация остеокальцина в сыворотке крови оставалась в пределах нормы во все сроки наблюдения. У двух пациенток первоначально повышенная концентрация остеокальцина заметно понизилась, приблизившись к верхней границе нормы. У одной больной, перенесшей субтотальную резекцию желудка за год до начала исследования, исходно существенно повышенное содержание этого белка сохранялось.
Проведенная оценка изменения индивидуальных показателей ПТГ и остеокальцина (в % от исходного уровня) показала, что введение СП в диету больных основной группы обусловливаетснижение у них в сыворотке крови концентрации ПТГ на 3,4% и остеокальцина на 4,7%, что свидетельствует о положительном влиянии включения данного продукта в диету больных.
На следующем этапе оценивали влияние включения СП в диету больных на минеральную плотность костной ткани. Для этого сравнивали изменения индивидуальных значений минеральной плотности костной ткани в абсолютных и относительных величинах ^-критерий). Изменения рассчитывали как разницу между величиной в начале исследования и через 6 мес (с учетом знака — для критерия) относительно исходного уровня (по модулю — для Г-критерия). Повторное обследование, проведенное через 6 мес, показало, что изменения состояния костной ткани в группах носят разнонаправленный характер (рис. 4). Если у обследованных, не получавших СП, минеральная плотность костной ткани понизилась на 3,37%, а величина Г-критерия — на 9,4%, то прием СП сопровождался положительной динамикой этих показателей. По сравнению с исходными значениями среднее повышение минеральной плотности костной ткани составило 0,32%, критерий был в пределах — 6,5%. Дальнейшее возрастное понижение минеральной плотности костной ткани и значения критерия наблюдалось у половины пациентов группы сравнения, тогда как при употреблении СП снижение минеральной плотности выявлялось у Белова К.Ю. Оценка эффективности различных видов профилактики постменопаузального остеопороза: Автореф. дис. … канд. мед. наук. — Ярославль, 2005. — 22 с.
Беневоленская Л.И. // Остеопороз и остеопатии. — 1998. — № 1. — С. 4−7.
Коденцова В.М., Вржесинская О.А. // Вопр. питания. — 2003. — № 4. — С. 3−8.
Коденцова В.М., Вржесинская О.А. // Вопр. питания. — 2005. — Т. 74, № 4. — С. 41−45.
Коденцова В.М., Вржесинская О.А. // Вопр. питания. — 2006. — № 1. — С. 30−39./4 обследованных. По сравнению с контролем минеральная плотность костной ткани не претерпела заметных изменений у большего.
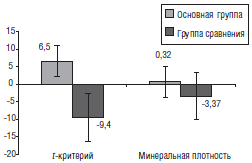
Рис. 4. Среднее изменение (в % от исходного уровня) минеральной плотности костной ткани и критерия через 6 мес у больных обеих групп числа лиц, принимавших СП (у 6 из 12 против 3 из 11).
Таким образом, включение в диету больных продукта, содержащего наряду с другими минеральными веществами (цинк, марганец, медь) кальций, несколько улучшало состояние костной ткани пациенток. Очевидно, для предотвращения снижения минеральной плотности костной ткани необходим постоянный или длительный прием высоких доз кальция (500 мг/сут) в сочетании с витаминно-минеральными комплексами, что согласуется с данными литературы [9, 21]. Высокое содержание кальция в СП приводит к сдвигу соотношения Са: Р в рационе больных в сторону более оптимального. Известно, что в качестве дополнительного источника кальция чаще всего используется его карбонат, для растворения и последующего усвоения которого требуется соляная кислота. Усвоение же растворимых органических солей и фосфатов не зависит от количества желудочного сока и его кислотности. В составе продукта содержится целый ряд растворимых солей кальция, что важно для пациентов, перенесших гастрэктомию. К тому же кислотный остаток этих солей (органические кислоты, аминокислоты) включается в метаболизм (цикл Кребса и т. д.). Полученные результаты согласуются с данными других авторов о повышении минеральной плотности костной ткани при дополнительном приеме кальция (600−1000 мг/сут) в сочетании с витамином D или микроэлементами в течение 1−2 лет [1, 20]. Кроме того, благоприятное влияние СП на состояние больных с заболеваниями ЖКТ и остеопенией могло оказать дополнительное поступление 15 г белка в сочетании с комплексом протеолитических ферментов, поскольку исходно у 58% обследованных потребление белка не достигало рекомендуемой нормы. Включение СП в диету повысило у 87% больных содержание белка в рационе до рекомендуемого уровня (см. рис. 2).
Заключение
В заключение отметим, что в рационе у 75−83% пациенток с заболеваниями ЖКТ и остеопенией обнаружено недостаточное содержание витаминов группы В (В1, В2 и ниацина), у 67% - кальция и магния, у 58−60% - белка, железа и витамина А, у 33−42% - фосфора и калия, у 18% - витамина С. У половины обследованных выявлен пониженный уровень в сыворотке крови витамина В2 и у 12% - витамина D при адекватной обеспеченности витаминами А, Е и С. Включение в диетотерапию пациенток с заболеваниями ЖКТ и остеопенией СП, содержащего 500 мг кальция, 11 минеральных веществ и 11 витаминов в дозах, составляющих 17−60% от суточной РНП, сопровождается увеличением минеральной плотности костной ткани, но не ведет к ликвидации имеющегося дефицита витаминов В2 и D. Полученные данные обосновывают целесообразность разработки СП с заданным химическим составом, предназначенных для конкретной категории больных, и включения этих продуктов в диету.
- 1. Коденцова В.М., Вржесинская О. А., Светикова А. А. и др. // Вопр. питания. — 2008. — № 6. — С. 44−52.
- 2. Мартинчик А. Н., Батурин А. К. и др. // Вопр. питания. — 1998. — № 3. — С. 8−13.
- 3. Нормы физиологических потребностей в пищевых веществах и энергии для различных групп населения СССР. — М.: Министерство здравоохранения СССР, 1991. — С. 10.
- 4. Оберлис Д, Харланд Б., Скальный А. Биологическая роль макрои микроэлементов у человека и животных. — СПб.: Наука, 2008. — 544 с.
- 5. Рекомендуемые уровни потребления пищевых и биологически активных веществ. Методические рекомендации МР 2.3.1.1915;04. — М.: Госсанэпиднормирование Российской Федерации, 2004. — 36 с.
- 6. Светикова А.А., Коденцова В. М., Вржесинская О. А. и др. // Вопр. питания. — 2008. — Т. 77, № 2. — C. 32−35.
- 7. Светикова А.А., Коденцова В. М., Вржесинская О. А. и др. // Вопр. питания. — 2008. — Т. 77, № 1. — С. 20−25.
- 8. Спиричев В.Б. // Вопр. питания. — 2003. — № 1. — С. 34−43.
- 9. Спиричев В. Б, Коденцова В. М., Вржесинская О. А. и др. Методы оценки витаминной обеспеченности населения. Учебнометодическое пособие. — М.: ПКЦ Альтекс, 2001. — 68 с.
- 10. Спиричев В. Б, Сергеев И.Н. Витамин D. // Теоретические и клинические аспекты науки о питании: Сборник / Под ред. М. Н. Волгарева. — М., 1087. — Т. 8. — С. 210−215.
- 11. Bikle Daniel D. // J. Bone Miner. Res. — 2007. — Vol. 22. — P. 50−54.
- 12. Guthbertson D.H. // Nutr. Diet. — 1973. — Vol. 18. — P. 69−91.
- 13. Meier C., Woitge H.W., Witte K. et al. // J/ Bone Miner. Res. — 2004. — Vol. 19. — P. 1221−1230.
- 14. Southerland J.C., Valentine J.F. // Curr. Gastroenterol. Rep. — 2001. — Vol. 3, N 5. — P. 399−407.
- 15. Storm D., Eslin R., Porter E.S. et al. // J. Clin. Endocrinol. Metab. — 1998. — Vol. 83. — P. 3817−3825.
- 16. Strasse L., Saltman P, Smith K.T. et al. // J. Nutr. - 1994. — Vol. 124, N 7. — P. 1060−1064.
- 17. Ulivieri F.M., Lisciandrano D., Ranzi T. et al. // Am. J. Gastroenterol. — 2000. — Vol. 95, N 6. — P. 1491−1494.
- 18. Ulivieri F.M., Piodi L.P., Taioli E. et al. // Osteoporos. Int. — 2001. — Vol. 12, N 5. — P. 343−348.
- 19. Vestergaard P. // Eur. J. Gastroenterol. Hepatol. — 2003. — Vol. 15, N 8. — P. 851−856.
- 20. Williams S.E., Seidner D.L. // Gastroenterol Clin. North. Am. — 2007. — Vol. 36, N 1. — P. 161−190.