Теплотворная способность горючих материалов

Различают высшую Hв и низшую Hн теплотворные способности. Высшая теплотворная способность в отличие от низшей включает теплоту фазовых превращений (конденсации, затвердевания) продуктов сгорания при охлаждении до комнатной температуры. Таким образом, высшая теплотворная способность — это теплота полного сгорания вещества, когда физическое состояние продуктов сгорания рассматривается при комнатной… Читать ещё >
Теплотворная способность горючих материалов (реферат, курсовая, диплом, контрольная)
Под теплотворной способностью понимают теплоту полного сгорания единицы массы вещества. В ней учитываются потери тепла, связанные с диссоциацией продуктов сгорания и незавершенностью химических реакций горения. Теплотворная способность — это максимально возможная теплота сгорания единицы массы вещества.
Определяют теплотворную способность элементов, их соединений и топливных смесей. Для элементов она численно равна теплоте образования продукта сгорания. Теплотворная способность смесей является аддитивной величиной и может быть найдена, если известна теплотворная способность компонентов смеси.
Горение происходит не только за счет образования оксидов, поэтому в широком смысле можно говорить о теплотворной способности элементов и их соединений не только в кислороде, а и при взаимодействии с фтором, хлором, азотом, бором, углеродом, кремнием, серой и фосфором.
Теплотворная способность является важной характеристикой. Она позволяет оценить и сравнить с другими максимально возможное тепловыделение той или иной окислительно-восстановительной реакции и определить по отношению к нему полноту протекания реальных процессов горения. Знание теплотворной способности необходимо при выборе компонентов топлив и смесей различного назначения и при оценке их полноты сгорания.
Различают высшую Hв и низшую Hн теплотворные способности. Высшая теплотворная способность в отличие от низшей включает теплоту фазовых превращений (конденсации, затвердевания) продуктов сгорания при охлаждении до комнатной температуры. Таким образом, высшая теплотворная способность — это теплота полного сгорания вещества, когда физическое состояние продуктов сгорания рассматривается при комнатной температуре, а низшая — при температуре горения. Высшую теплотворную способность определяют сжиганием вещества в калориметрической бомбе или расчетным способом. Она включает в себя, в частности, теплоту, выделяющуюся при конденсации паров воды, которая при 298 К равна 44 кДж/моль. Низшую теплотворную способность рассчитывают без учета теплоты конденсации паров воды, например по формуле.
 (1.90).
(1.90).
где % Н — процентное содержание водорода в топливе.
Если при значениях теплотворной способности указывается физическое состояние продуктов сгорания (твердое, жидкое или газообразное), в этом случае индексы «высшая» и «низшая» обычно опускаются.
Рассмотрим теплотворную способность углеводородов и элементов в кислороде, отнесенную к единице массы исходного горючего. Низшая теплотворная способность отличается от высшей у парафинов в среднем на 3220−3350 кДж/кг, у олефинов и нафтенов — на 3140−3220кДж/кг, у бензола — на 1590 кДж/кг. При экспериментальном определении теплотворной способности следует иметь в виду, что в калориметрической бомбе вещество сгорает при постоянном объеме, а в реальных условиях — часто при постоянном давлении. Поправка на разность условий горения составляет для твердого топлива от 2,1 до 12,6, для мазута — около 33,5, бензина — 46,1 кДж/кг, а для газа достигает 210 кДж/м3. Практически эту поправку вводят только при определении теплотворной способности газа.
У парафинов теплотворная способность уменьшается с увеличением температуры кипения и увеличением отношения С/H. У моноциклических алициклнческих углеводородов это изменение значительно меньше. В ряду бензола теплотворная способность возрастает при переходе к высшим гомологам за счет боковой цепи. Двуядерные ароматические углеводороды имеют более низкую теплотворную способность, чем ряд бензола.
Всего лишь несколько элементов и их соединений имеют теплотворную способность, превышающую теплотворную способность углеводородных горючих. К числу этих элементов относятся водород, бор, бериллий, литий, их соединения и несколько элементорганических соединений бора и бериллия. Теплотворная способность таких элементов, как сера, натрий, ниобий, цирконий, кальций, ванадий, титан, фосфор, магний, кремний и алюминий, лежит в пределах 9210−32 240 кДж/кг. У остальных элементов периодической системы теплотворная способность не превышает 8374 кДж/кг. Данные по высшей теплотворной способности различного класса горючих приведены в табл. 1.18.
Таблица 1.18
Высшая теплотворная способность различных горючих в кислороде (отнесенная к единице массы горючего) [36][1]
Вещество. | Hв. | |
кДж/моль. | кДж/г. | |
Водород. | 286,020. | 142,98. |
Оксид углерода. | 283,137. | 10,05. |
Графит. | 393,68. | 32,68. |
Метан. | 890,930. | 55,73. |
Этан. | 1560,88. | 51,92. |
Пропан. | 2220,30. | 50,37. |
н-Бутан. | 2880,26. | 49,61. |
изо-Бутан. | 2873,44. | 49,48. |
н-Пентан. | 3511,50. | 48,73. |
н-Гексан. | 4165,82. | 48,40. |
н-Гептан. | 4820,39. | 48,19. |
н-Октан. | 5474,41. | 47,97. |
н-Декан. | 6783,16. | 47,72. |
н-Додекан. | 8091,95. | 47,56. |
н-Гексадекан. | 10 708,08. | 47,31. |
Этилен. | 1401,93. | 50,24. |
Ацетилен. | 1300,50. | 49,82. |
Циклопентан. | 3293,08. | 47,00. |
Циклогексан. | 3922,52. | 46,68. |
Бензол. | 3269,80. | 41,87. |
Толуол. | 3912,56. | 42,53. |
Этилбензол. | 4576,30. | 43,16. |
Метанол. | 727,00. | 22,69. |
Этанол. | 1367,66. | 29,73. |
Бериллии. | 66,49. | |
Бор | ; | 58,62. |
Литий. | ; | 43,12. |
Алюминий. | ; | 30,98. |
Кремний. | 32,24. | |
Магний. | ; | 24,70. |
Фосфор | ; | 24,28. |
Титан. | ; | 19,68. |
Кальций. | 15,91. | |
Цирконий. | ; | 12,14. |
Гидрид бериллия. | ; | 75,36. |
Диборан. | 74,53. | |
Пснтаборан. | 69,92. | |
Метаадиборан. | ; | 58,20. |
Этилдиборан. | 56,94. | |
Для жидких углеводородов, метанола и этанола теплотворная способность приведена для жидкого исходного состояния.
Теплотворная способность некоторых горючих была рассчитана на ЭВМ. Она составляет для магния 24,75 и алюминия 31,08 кДж/кг (состояние оксидов — твердое) и практически совпадает с данными табл. 1.18. Высшая теплотворная способность парафина C26H54, нафталина С10H8, антрацена С14Н10 и уротропина C6H12N4 составляет соответственно 47,00, 40,20, 39,80 и 29,80, а низшая — 43,70, 39,00, 38,40 и 28,00 кДж/кг.
В качестве примера, применительно к ракетным топливам, приведем теплоты сгорания различных элементов в кислороде и фторе, отнесенные к единице массы продуктов сгорания. Теплоты сгорания рассчитаны для состояния продуктов сгорания при температуре 2700 К и приведены на рис. 1.25 и в табл. 1.19.
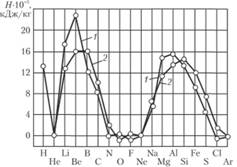
Puc. 1.25. Теплота сгорания элементов в кислороде (1) и фторе (2), рассчитанная на килограмм продуктов сгорания.
Как следует из приведенных данных, для получения максимальных теплот сгорания наиболее предпочтительны вещества, содержащие водород, литий и бериллий, а во вторую очередь — бор, магний, алюминий и кремний. Преимущество водорода вследствие малого молекулярного веса продуктов сгорания очевидно. Следует отметить преимущество бериллия вследствие большой теплоты сгорания.
Есть возможность образования смешанных продуктов сгорания, в частности газообразных оксифторидов элементов. Поскольку стабильными обычно являются оксифториды трехвалентных элементов, большинство оксифторидов не эффективны как продукты сгорания ракетных топлив из-за большого молекулярного веса. Теплота сгорания с образованием COF2 (г.) имеет промежуточное значение между теплотами сгорания СO2 (г.) и CF4 (г.). Теплота сгорания с образованием SO2F2 (г.) больше, чем в случае образования SO2 (г.) или SF6; (г.). Однако в большинстве ракетных топлив содержатся элементы с большой восстанавливающей способностью, которые предотвращают образование подобных веществ.
При образовании оксифторида алюминия AlOF (г.) выделяется меньше тепла, чем при образовании оксида или фторида, поэтому он не представляет интереса. Оксифторид бора BOF (г.) и его тример (BOF)3 (г.) являются довольно важными компонентами продуктов сгорания ракетных топлив. Теплота сгорания с образованием BOF (г.) имеет промежуточное значение между теплотами сгорания с образованием оксида и фторида, по оксифторид термически более стабилен, чем каждое из этих соединений.
Таблица 1.19
Теплоты сгорания элементов (в МДж/кг), отнесенные к единице массы продуктов сгорания (Т = 2700 К).
Элемент. | H | ||
ОКСИД. | фторид. | оксифторид. | |
Водород. | 13,44. | 13,48. | 3,02. |
Литий. | 18,55. | 12,98. | 1,00. |
Бериллий. | 23,95. | 16,75. | |
Бор | 12,65. | 16,66. | 13,19. |
Углерод. | 8,96. | 10,38. | 9,67. |
Азот. | ; | 1,76. | 1,34. |
Кислород. | — 0,58. | ||
Фтор | — 0,59. | ; | ; |
Натрий. | 6,36. | 6,70. | |
Магний. | 14,91. | 11,89. | ; |
Алюминий. | 16,15. | 14,27. | 9,42. |
Кремний. | 15,11. | 15,49. | ; |
Фосфор | 9,96. | 12,52. | |
Сера. | 4,64. | 8,29. | 8,38. |
Хлор | — 0,84. | 1,76. | 0,21. |
Цирконий. | 8,88. | 10,06. | ; |
При образовании нитридов бериллия и бора выделяется достаточно большое количество тепла, что позволяет отнести их к важным компонентам продуктов сгорания ракетных топлив.
В табл. 1.20 приведена высшая теплотворная способность элементов при взаимодействии их с различными реагентами, отнесенная к единице массы продуктов сгорания. Теплотворная способность элементов при взаимодействии с хлором, азотом (кроме образования Ве3N2 и BN), бором, углеродом, кремнием, серой и фосфором значительно меньше теплотворной способности элементов при взаимодействии с кислородом и фтором. Большое разнообразие требований, предъявляемых к процессам горения и реагентам (по температуре, составу, состоянию продуктов сгорания и др.), делает целесообразным использование данных табл. 1.20 при практической разработке топливных смесей того или иного назначения.
Таблица 1.20
Высшая теплотворная способность элементов (в МДж/кг) при взаимодействии с кислородом, фтором, хлором, азотом, отнесенная к единице массы продуктов сгорания
Элемент. | HB. | |||
оксид. | фторид. | хлорид. | нитрид. | |
Н. | 15,9. | 13,5. | 2,5. | 10,5. |
С. | 9,0. | 10,4. | 0,84. | -. |
Вe. | 24,0. | 21,4. | 6,3. | ; |
В. | 18,0. | 16,7. | 3,8. | 10,0. |
Li. | 20,1. | 23,0. | 9,7. | 5,7. |
А1. | 16,2. | 16,3. | 5,0. | 6,7. |
Si. | 15,1. | 15,5. | 3,8. | 5,4. |
Mg. | 15,1. | 17,6. | 6,7. | 4,6. |
Р. | 10,9. | 12,5. | 2,5 PCl3. | 5,4 TiN. |
Ti. | 11,7. | 13,4. | 4,2. | ; |
Са. | 11,3. | 15,5. | 7,1. | 2,9. |
Zr. | 8,8. | 11,3. | 4,2. | 3,3 ZrN. |
V. | 8,4. | ; | ; | 3,8. |
Nb. | 6,7 NbO2. | 13,4. | 7,1. | 2,2 NbN. |
Сг. | 7,5 Cr2O3. | -. | -. | 0,84. |
?n. | 5,4. | -. | -. | -. |
Na. | 6,7. | -. | ||
- [1] См. также: Joulin С., Clavin Р. Op. cit.