Приложение второго закона термодинамики к физико-химическим процессам

Следовательно, при абсолютном нуле температур в идеальном кристалле наблюдается полный порядок, его энтропия равна нулю. В реальных кристаллах всегда есть примеси, дефекты решетки, поэтому даже при низких температурах энтропия твердого тела не равна нулю. С ростом температуры энергия системы возрастает, так как увеличивается мера беспорядка. Для любого вещества энтропия возрастает в ряду… Читать ещё >
Приложение второго закона термодинамики к физико-химическим процессам (реферат, курсовая, диплом, контрольная)
Процессы разделяют на обратимые, необратимые и равновесные. Обратимый процесс не вызывает изменений параметров и в системе, и в среде при его свершении, необратимый — изменяет и систему, и окружающую среду. Обратимый процесс обычно приравнивают к равновесному. Изучение систем с учетом фактора времени осуществляется термодинамикой необратимых процессов.
Формулировки второго закона термодинамики.
М. В. Ломоносов: «Теплота не может переходить сама собой от более холодного тела к более теплому»; Клаузиус: «Не может быть процесса, результат которого есть переход от менее нагретого к более нагретому телу». Со статической точки зрения: самопроизвольные процессы протекают от менее вероятных к более вероятным.
Подобно тому, как первое начало термодинамики вводит функцию состояния — энтальпию, внутреннюю энергию, второе начало вводит новую функцию состояния — энтропию.
Энтропия (по Клаузиусу) — способность к превращению, и связывают ее с приведенной теплотой Q/T. Рост энтропии означает переход системы из состояния большей степени упорядоченности в менее упорядоченное состояние, энтропия системы будет уменьшаться, если система с меньшей степенью упорядоченности переходит в более упорядоченную.
Следовательно, при абсолютном нуле температур в идеальном кристалле наблюдается полный порядок, его энтропия равна нулю. В реальных кристаллах всегда есть примеси, дефекты решетки, поэтому даже при низких температурах энтропия твердого тела не равна нулю. С ростом температуры энергия системы возрастает, так как увеличивается мера беспорядка. Для любого вещества энтропия возрастает в ряду твердое — жидкое — газообразное. Например, энтропии льда, воды и пара соответственно равны: 39,3; 69,9; 188,7 ДжДмольК).
Для обратимого процесса приращение энтропии определяется отношением бесконечно малого количества теплоты, сообщенной системе, к температуре:

Изменение теплоты связано с молярной теплоемкостью dQ = CpdT. Тогда.

Из уравнения (22) видно, что размерность энтропии совпадает с размерностью теплоемкости: ДжДмоль-К). В результате интегрирования по температуре от 298 К до Т получаем.

Значения 5°298, коэффициентов а, Ь, с находят в справочниках термодинамических величин. Энтропия системы — величина аддитивная, поэтому для расчета энтропии химических реакций необходимо вычислить алгебраическую сумму энтропии реагирующих веществ: 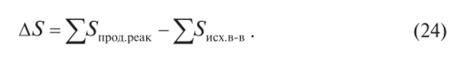
Тогда общее уравнение для расчета энтропии реакции примет вид:
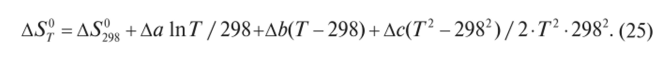
Из второго начала термодинамики следует, что если система изолирована, то при протекании в ней обратимых процессов энтропия не изменяется, при необратимых процессах — растет.
Если необратимый процесс приводит изолированную систему в состояние равновесия, то ее энтропия достигает максимума.
Следовательно, энтропия является критерием направленности процесса AS > 0 и критерием равновесия AS = 0, если AS < 0 — процесс в изолированной системе невозможен. Однако в отдельных частях неизолированной системы процессы как обратимые, так и необратимые могут протекать и с уменьшением энтропии.
В общем виде изменение энтропии определяют при переходе из состояния А в состояние В как.
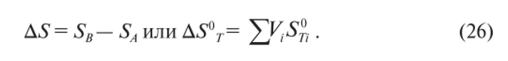
Изменения энтропии, связанные с фазовыми переходами, — модификационные превращения, плавление, сублимация и др., — поскольку эти превращения протекают при постоянной температуре, вычисляют по справочным значениям теплоты этих превращений и температур, например:
