Механизм окислительной конденсации метана

Исследование взаимодействия N20 с F-центрами на MgO после облучения показало, что при этом возникает несколько сигналов ЭПР, соответствующих О" на разных поверхностных центрах. Это связано с образованием разных дефектов с разным распределением зарядов между атомами. Обычно говорят о центрах Mgf^, т. е. о координационно ненасыщенных ионах Mg на поверхности. По данным, такие F-центры ответственны… Читать ещё >
Механизм окислительной конденсации метана (реферат, курсовая, диплом, контрольная)
Активные центры
Дырочные центры О" .
Общепринято, что активация метана заключается в отщеплении от него атома водорода. Вероятнее всего, этот процесс должен происходить с участием исходных центров катализатора, обладающих свободнорадикальными свойствами. Таким центром в оксидах является дырочный кислород О-, образующийся при захвате регулярным ионом оксидной решетки О2' положительного заряда — «дырки». Получается парамагнитный ион-радикал О-, обнаруживаемый в спектрах ЭПР. Детали ЭПР-спектров О" см. в нашей статье [233]. Наиболее распространенный путь образования О": стабилизация Овблизи катионной вакансии, т. е. V-центр, когда дырка на р-орбитали кислорода притягивается катионной вакансией, имеющей эффективный отрицательный заряд. В решетках, содержащих тетраэдрические анионы, Овозникает на одном из атомов кислорода, входящих в тетраэдрический анион, например WO4, SiOj". Для того чтобы получить чистый сигнал О", производят разложение N20:

или разложение N20 с участием поверхностной анионной вакансии (Fцентра):

Исследование взаимодействия N20 с F-центрами на MgO после облучения показало, что при этом возникает несколько сигналов ЭПР, соответствующих О" на разных поверхностных центрах. Это связано с образованием разных дефектов с разным распределением зарядов между атомами. Обычно говорят о центрах Mgf^, т. е. о координационно ненасыщенных ионах Mg на поверхности. По данным [234], такие F-центры ответственны за активацию метана на MgO. В работе [235] изучили различные образцы MgO, полученные разложением Mg (OH)2 или сжиганием магниевой ленты. Наиболее селективны в окислительной конденсации метана образцы, полученные разложением Mg (0H)C03, в которых больше всего образуется граней (111). Иногда появляются сообщения, что и двухзарядный координационно ненасыщенный кислород Огс~5 может быть активен в окислительной конденсации [236−238]. Квантовохимический расчет ab initio [239] показал, что тетракоординированный атом О на MgO (001) неактивен в расщеплении СН4, а трехкоординированный атом О отщепляет Н от СН4; потенциальный барьер в последнем случае близок к барьеру для свободнорадикального центра.
Значительно больше дырочных центров О- регистрируется методом ЭПР в Li/MgO [234−236, 240−243], в котором в процессе приготовления часть ионов Mg2+ замещена ионами Li+. При этом кислородная вакансия [ ] расположена рядом с атомом лития: Li+[ ]" или же образуется ион-радикал Li±0~. Число таких активных центров, по данным ЭПР, значительно меньше общего содержания лития. Количество активных кислородных центров, определенное по количеству поглощенного кислорода на образце 5% Li/MgO, восстановленном Н2 или СН4, было равно 5,5 • 1018 ат./м2, что соответствовало покрытиям, близким к монослою, и составляло всего 1% от общего количества лития. Но если бы все ионы О", доступные для восстановления, были расположены на поверхности, их наблюдение методом ЭПР было бы невозможно из-за взаимодействия между ними. В форме Li+O" методом ЭПР наблюдается лишь малая часть активных центров в Li/MgO (~0,03% введенного лития).
Изучение электропроводности Li/MgO [153] показало, что при низких температурах (400°С) проводимость осуществляется протонами и зависит от Рн2о* Это означает, что вакансия Li+[ ] заполнена водой:
О- … Li+[ ] + Н20 —> НО … LiOH. При 500−700°С электропроводность смешанная: протонная и дырочная, и лишь при 800−900°С электропроводность — чисто дырочная, не зависит от РНг0, но зависит от Р02.
Подвижные дырки И образуются при захвате кислорода вакансией около Li: Li+[ ] + 1/202 = Li+0_ + h. Образованные таким образом Li+0″ и являются активными центрами.
Согласно [236], добавление Li к MgO ведет к агломерации зерен MgO. Получаются дислокации, по которым происходит сегрегация ионов Li+. На основе корреляции каталитических и люминесцентных свойств Li/MgO был сделан [244] вывод, что литий способствует формированию на MgO активной грани (111), в то время как на чистом MgO образуется в основном неактивная грань (100).
Пленки MgO и Li/MgO, напыленные в вакууме на Мо (100), были изучены Гудманом и соавт. [24] методами спектроскопии Оже и HREELS (энергетические потери электрона с высоким разрешением) и как катализаторы окислительной конденсации метана. Каталитическая активность коррелировала не столько с содержанием Li на поверхности, сколько с концентрацией поверхностных F-центров, образование которых облегчено в присутствии лития. Поверхностные F-центры находятся в равновесии с объемными F-центрами. Максимальная их концентрация (1019 см-3) была намного выше концентрации Li-центров. На основании этих данных авторы [245] считают, что активные центры — не Li+0″, а вакансии! ]о".
Теоретические расчеты [246] показали, что отщепление атома Н от СН4 на селективном катализаторе Li/MgO имеет очень низкий потенциальный барьер — 17−25 кДж-моль, по другим данным [247] - 70 кДж/моль. И та и другая величина значительно ниже экспериментально наблюдаемой величины энергии активации образования радикала СН3 на Li/MgO — около 105 кДж/моль [241]. Реакция — слабо эндотермическая (~5 кДж/моль). Барьер образуется за счет взаимодействия СН4 с катионной вакансией и ионом О". На чистом же MgO этот барьер равен 290 кДж/моль.
Избыток Li-содержащей фазы в Li/MgO в условиях реакции образует фазу Li2C03, которая покрывает поверхность MgO и отравляет ее. Авторы [248] ставят вопрос, не является ли MgO простым носителем для Li-содержащей фазы. Однако, по-видимому, это не так. Активность Li2C03 и LiOH много ниже активности Li/MgO. По мере протекания реакции эта избыточная фаза удаляется, вероятно, в форме LiOH, и катализатор теряет способность к прочной адсорбции С02. После этого на поверхности MgO остаются только центры Li+0″ [127].
Хатчингс и соавт. [132] обратили внимание на то, что О- на Li/MgO, полученный из N20, при низкой температуре был более активен в окислении метана, чем О", образованный из 02. При высоких же температурах наблюдался обратный эффект. На основании этого результата авторы [132] пришли к заключению о существовании двух поверхностных форм OJ. Низкотемпературная форма проводит глубокое окисление СН4, а высокотемпературная ведет окислительную конденсацию.
В опытах по восстановлению решетки [249] показано, что кислород в Li/MgO обладает высокой подвижностью в условиях окислительной конденсации метана при 730 °C. Li способствует быстрому обмену между поверхностью и объемом, между О" и О2-. Обменная емкость по кислороду составляла 2,4−4,0 • Ю20 атомов О/г катализатора, а период обмена — 150 ч. Высокая подвижность кислорода в Li/MgO была найдена и в экспериментах по изотопному обмену 1802 с решеткой [250]. По данным измерения электропроводности MgO и Li/MgO [251], в образовании дырочных центров, ответственных за селективную активацию метана, принимают участие поверхностные ОН-группы:

На других оксидах также возможно образование О" за счет термически активированного переноса электрона от аниона кислорода О2- к катиону металла или за счет вакансии, соседней с кислородным центром. Мы уже упоминали, что оксиды с малой шириной запрещенной зоны и с дырочной проводимостью могут быть активаторами С-Н-связи: дырка образуется в 2р-зоне кислорода путем перехода электрона на вакантную орбиталь металла [231].
Как было показано выше, литий повышает активность и селективность многих оксидных катализаторов окислительной конденсации. Однако не во всех оксидах Li может входить в решетку. Люминесцентным методом показано, что Li* и Na* могут входить в решетки MgO и СаО, но не могут, например, замещать La3* в решетке La203 [252].
В катализаторе 15% Na20/MgO образование ионной пары Na*0″ предположено Лансфордом и соавт. [13, 158]. Такой центр образуется по реакции:
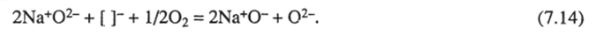
Возникает вопрос о возможности образования иона О- в оксидах, не содержащих оксидов щелочных металлов. В работе Института химической физики [61, 253] была обнаружена корреляция активности и селективности в окислительной конденсации метана с содержанием Nd203 в нанесенных Nd/MgO-катализаторах. На рис. 7.10 приведены спектры ЭПР нанесенных Nd203/La203 и Nd203/MgO-кaтaлизaтopoв. В первых из них наблюдается узкий сигнал, соответствующий изолированным ионам Nd3*. Что касается Nd203/Mg0, то в них даже при очень малых концентрациях Nd203 (0,3%) наблюдается широкий сигнал, соответствующий фазе Nd203 и, кроме того, — узкий сигнал изолированных ионов Nd3* на MgO. Активность в образовании (^-углеводородов коррелирует с широким сигналом. Этот результат можно объяснить тем, что активным центром является дырочный центр О", образующийся при внедрении Mg2* в решетку Nd203 (но не наоборот — не Nd3* в MgO, как можно было бы думать на основании соотношения концентраций). Дальнейшее исследование Nd303/MgO методом электронной микроскопии высокого разрешения [254] показало, что на поверхности MgO образуется шесть видов Nd203 в виде малых кластеров и микрокристалликов. Активность в окислительной конденсации коррелирует с количеством разупорядоченных пленок Nd203. Разупорядоченность, по-видимому, вызвана внедрением MgO в Nd203.
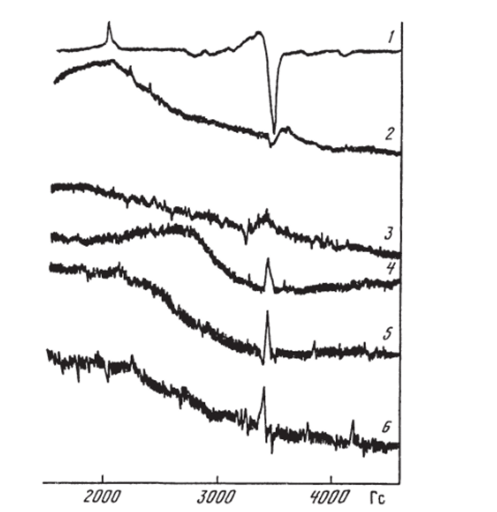
Рис. 7.10. ЭПР-спсктры образцов Nd/La203 (1 и 2) и Nd/MgO (3−6) с различной концентрацией Nd.
Концентрация Nd (в ат.%): 1 — I; 2 — 10; 3 — 3 • 10″3; 4 — 3- 10″2; 5−0,3; 6−3.
В Nd203, La203, Sm203, в отличие от MgO и СаО, дырочные центры О" образуются и в отсутствие примесей за счет равновесия с кислородом газовой фазы. При РОг<0'1 кПа они при температурах катализа вакантны, а при PQl >0,1 кПа — заняты кислородом [19]. В оксидах Се02, Рг6Оп и ТЬ407 они постоянно свободны, но эти оксиды ведут глубокое окисление.
В разделе 7.3 мы упоминали, что замещение 02 на N20 в качестве окислителя метана в большинстве случаев привело к уменьшению селективности и скорости окислительной конденсации. Заметное увеличение скорости реакции на PbO/MgO при переходе от 02 к N20 могло быть связано с образованием О" [38]. В этом катализаторе наблюдали также образование парамагнитного центра РЬ04 [23]. При взаимодействии с метаном он исчезает.