Клеточный уровень воздействия

При прохождении через ткани, расположенные до опухоли, потери энергии корпускулярной частицей на ионизацию невелики. Поэтому появляется возможность значительно повысить эффективность (по сравнению с фотонным излучением) облучения глубоко расположенных опухолей, а также значительно усилить повреждающий эффект их облучения (биологическая эффективность у ионов углерода в конце пробега выше в 3+5… Читать ещё >
Клеточный уровень воздействия (реферат, курсовая, диплом, контрольная)
Изменения химической структуры атомов и молекул под влиянием облучения ведут к развитию в клетках биохимических реакций, не свойственных им в нормальном состоянии. Развивающиеся биохимические изменения весьма разнообразны, и значение их для жизни клетки неодинаково. Нарушаются окислительные процессы, белковый, жировой, углеводный обмены, инактивируются ферменты.
Клеточный уровень воздействия включает в себя все нарушения и процессы, обусловленные изменениями функциональных свойств облученных клеточных структур. Количество клеток с радиационными повреждениями в облученной популяции находится в прямой зависимости от дозы облучения, блокирования процессов физиологической регенерации, жизнестойкости организма. Изменения на клеточном уровне приводят к нарушению наследственных структур, угнетению кроветворения, подавлению сперматогенеза, т. е. влияют на весь механизм жизнедеятельности организма многоклеточных и высших животных.
Рентгеновские и гамма-лучи взаимодействуют с биологической тканью в основном по механизму Комптона, образуя высокоэнергетичные электроны отдачи, которые пересекают клетку и вызывают ионизацию по своему треку, выбивая орбитальные электроны из критически важных молекул в клетке (прямое действие) или из молекул воды, расположенных на расстояниях в 34−5 нм от критической молекулы (косвенное действие). Прямые и косвенные эффекты генерируют высокореакционноспособные кислород и азот-содержащие продукты (свободные радикалы), которые диффундируют, вызывая новые биологические повреждения.
Хорошо известно, что с ростом поглощенной дозы рентгеновского или гамма-излучения, выживаемость клеток млекопитающих падает, причём тем круче, чем больше линейная передача энергии, ЛПЭ, излучения (рис. 4).
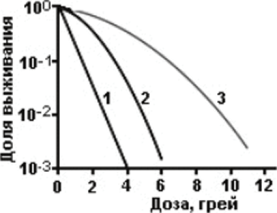
Рис. 4. Зависимости доли выживших клеток млекопитающих от дозы излучений, обладающих различной ионизирующей способностью: 1 — высокое ЛПЭ (а-частицы), 2 — промежуточное ЛПЭ (15 МэВ нейтроны) и 3 — низкое ЛПЭ (250 кэВ рентгеновское излучение).
Повреждения внутриклеточных структур изменяет метаболические процессы в клетках, следствием чего является появление новых нарушений уже после окончания воздействия радиации. Например, нарушения строения нуклеотидов и их последовательностей в ДНК и РНК ведут к дефициту' необходимых для нормальной жизнедеятельности продуктов матричного синтеза, а также к наработке несвойственных клетке, чужих для неё продуктов. Нарушение структуры ферментов приводит к замедлению ферментативных реакций, накоплению аномальных метаболитов, часть которых имеют свойства радиотоксинов. В результате возникают серьёзные нарушения жизнедеятельности, и даже табель клетки. Однако возникшие повреждения могут быть «залечены» с восстановлением нормальной жизнедеятельности клетки. Чем выше доза облучения, тем больше возникает первичных повреждений и тем меньше возможность их полного восстановления. Повреждение и гибель клеток лежат в основе развития поражения тканей, органов и всего организма при радиационных воздействиях.
В результате прямого и косвенного воздействия излучений не только изменяются сами биомолекулы, но меняется скорость реакций, протекающих с участием ферментов.
Некоторые радиационно-биохимические изменения появляются уже после воздействия малых доз, другие — лишь в результате воздействия средних или высоких доз излучений. При воздействии радиации прежде всего повреждаются нуклеиновые кислоты. Углеводный обмен веществ устойчив к облучению: его изменения после облучения становятся заметными лишь при дозах 504−200 Гр. Нарушение клеточного дыхания наблюдается в результате воздействия ещё больших доз.
Среди молекулярных повреждений особое место занимает радиационное поражение ДНК — основной мишени при действии радиации на клетки. Если повреждения молекул других типов могут быть скомпенсированы за счёт оставшихся неповрежденными молекул белков, полисахаридов и т. п., то в случае ДНК такой путь исключен. Однако в случае ДНК в неделящихся клетках, повреждение каких-то участков её цепи может и не сказаться на жизнедеятельности этих клеток. Для делящихся клеток повреждения ДНК существенны. Если в результате облучения возникли повреждения ДНК, то нормальная репликация осуществиться не может. Эта форма гибели клеток называется репродуктивной гибелью.
Количество повреждений ДНК, возникающих в результате облучения, достаточно велико. Так, например, при облучении в дозе 1 Гр в каждой клетке человека возникает юоо одиночных и 1004−200 двойных разрывов. Каждое из этих событий могло бы иметь фатальные последствия, если бы не существовало системы, способной ликвидировать большинство возникших повреждений ДНК. Существование в клетках механизмов и ферментных систем, обеспечивающих восстановление начальных повреждений ДНК, обусловлено необходимостью поддержания стабильности генома, восстановления от постоянно возникающих повреждений ДНК в результате воздействия радиационного фона, присутствия в среде мутагенов, нарушений, случайно возникающих в процессе жизнедеятельности клеток.
Еще одним результатом лучевого повреждения ДНК является возникновение наследуемых повреждений генетического материала — мутаций, следствием которых может быть злокачественное перерождение соматических клеток (клетки тела) или дефекты развития у потомства. Вызванная облучением дестабилизация ДНК, процесс репарации её повреждений могут способствовать внедрению в геном клетки или активации онковирусов, ранее существовавших в геноме в репрессивном состоянии.
Другая мишень действия радиации на клетки — внутриклеточные мембраны. Активация под влиянием облучения реакций свободнорадикального перекисного окисления липидов приводит к деструктивным изменениям мембран, к нарушениям активного транспорта веществ через мембраны, снижению ионных градиентов в клетке, к выходу' ферментов из мест их локализации, поступлению их в ядро и, как следствие этого, к дезорганизации ядерных структур и гибели клетки. По этому типу могут погибать как иеделящиеся, так и делящиеся клетки.
На клеточном уровне под влиянием облучения выявляются замедление клеточного деления, образование хромосомных аберраций, возникновение микроядер. Гибель клетки может происходить по апоптотическому и некротическому путям. Большая часть клеток погибает до вступления клеток в митоз. Апоптотическая гибель клеток характерна для лимфоцитов, причём при небольших дозах облучения. Угнетение клеточного деления относится к функциональным клеточным нарушениям и носит обратимый характер. При воздействии больших доз клеточное деление полностью прекращается, что приводит к бесплодию человека.
Важным для радиационных онкологов является «коммунальный эффект», или «эффект свидетеля». Эффект, обнаруженный не только в культуре клеток, но и в тканях, состоит в поражении клеток, наступающем после облучения других клеток, находящихся в составе одной ткани.
Наиболее известная реакция клеток на облучение — задержка клеточного деления: при увеличении дозы увеличивается продолжительность задержки деления каждой облученной клетки. На отдельных стадиях клеточного цикла наблюдается разное время задержки деления.
Рассмотрим теперь особенности воздействия ионного облучения на нормальные и опухолевые клетки. Такой анализ интересен для развития лучевой медицины, в которой появилось новое направление — ионная терапия, основанная на облучении больных тканей тяжёлыми частицами — ионами (гелия, углерода и др.) и протонами.
При прохождении через ткани, расположенные до опухоли, потери энергии корпускулярной частицей на ионизацию невелики. Поэтому появляется возможность значительно повысить эффективность (по сравнению с фотонным излучением) облучения глубоко расположенных опухолей, а также значительно усилить повреждающий эффект их облучения (биологическая эффективность у ионов углерода в конце пробега выше в 3+5 раз, чем у у-квантов). Поэтому ионная терапия даёт высокий показатель излечиваемости пациентов. Кроме того, ионная терапия позволяет резко уменьшить количество сеансов облучения. Опухоли, для лечения которых требуется 30 сеансов у-излучения, с помощью углеродной терапии могут излечиваться всего за несколько облучений.
Воздействие ионизирующего излучения на биологическую систему зависит не только от выделенной в макроскопическом объёме энергии — дозы, но и в значительной степени от микроскопического характера энерговыделения или от плотности потерь энергии. Относительная биологическая эффективность (ОБЭ) определяет степень усиления биологических эффектов, произведенных частицами с большими линейными потерями энергии (ЛПЭ), по сравнению со слабоионизирующими излучениями, при одной и той же дозе облучения. ОБЭ зависит от типа частиц и их энергии, от пробега в тканях, от уже поглощенной дозы, от типа опутсоли, от способности клеток к «ремонту'» (в том числе от фазы клеточного цикла) и от содержания кислорода в опухоли (OER).
Вероятность уничтожения опухолевых клеток зависит от способности организма «залечивать» нанесенные повреждения. Несколько удалённых нарушений в структуре ДНК могут быть «залечены». Однако при локальных многократных нарушениях в одной структуре ДНК вероятность правильного восстановления резко уменьшается, и клетка погибает.
Различают три основных вида разрывов молекул ДНК, возникающих при ионизирующем облучении: одиночные, двунитевые и кластерные разрывы. Одиночные разрывы не приводят к поломкам молекулы ДНК, так как разорванная нить прочно удерживается на месте водородными, гидрофобными и другими видами взаимодействий с противоположной нитью ДНК и, кроме того, структура довольно хорошо восстанавливается мощной системой репарации.
При дозах до 20 Гр двойные разрывы являются следствием одновременного повреждения обеих нитей ДНК. С увеличением дозы облучения возрастает вероятность перехода одиночных разрывов в двойные, так как увеличивается возможность того, что независимые разрывы в противоположных цепях возникают друг против друга. При действии излучений с небольшой плотностью ионизации (уи рентгеновское излучение) 204-юо одиночных разрывов вызывают один двойной.
Плотно ионизирующие излучения приводят к большому числу двойных разрывов. Уже при дозе 1 Гр в каждой клетке человека повреждается 5000 оснований молекул ДНК, возникает юоо одиночных и 104-Ю0 двойных разрывов. Кластерными разрывами называются сочетания разрывов нитей и оснований в пределах 14−2 витков ДНК. Такие разрывы наблюдаются при облучении живых тканей частицами тяжелее гелия.
Эффективность летального действия излучений на клетки различных тканей организма (радиочувствительность клеток) обусловливается двумя факторами различной природы: физическим факгором — величиной поглощённой энергии в генетических структурах и факгором биологической природы — эффективностью работы систем восстановления повреждённых генетических структур. Молекулярными повреждениями, лежащими в основе клеточной гибели, являются двунитевые разрывы (ДР) ДНК, в то время как однонитевые разрывы эффективно восстанавливаются клетками различного происхождения. Для протонов соотношение выхода ДР ДНК и однонитевых разрывов составляет от i: io и более. Ионизирующие излучения с разной величиной ЛПЭ вызывает не только различное количество ДР ДНК, но и изменяет качество таких повреждений, характеризуемое по особенностям возникающих концевых групп ДР ДНК (а, значит, и способности репарационных систем к восстановлению), различно. Клетке, облученной радиацией с высоким ЛПЭ, необходимо производить длительную обработку мест разрывов с участием многих репарационных ферментов.
С ростом ЛПЭ частиц количество индуцируемых ДР ДНК возрастает и достигает максимума при ЛПЭ, равных — 200 кэВ/мкм. При этом, в области ЛПЭ частиц, равных ~ 1504−200 кэВ/мкм, образуются «кластерные» ДР ДНК, включающие в себя множественные разрывы ковалентных связей во фрагменте ДНК при прохождении тяжёлой заряженной частицы. Репарация таких ДР крайне затруднительна. Именно этими обстоятельствами обусловлена высокая биологическая эффективность тяжёлых заряженных частиц с указанными величинами ЛПЭ.
При лучевой терапии, сопровождающейся разрывами ДНК, происходит прямое и/или косвенное воздействие элементарных частиц или ионов на ДНК раковых клеток (рис. 4, п.1).
Механизм репарации живых клеток включает в себя несколько этапов: l) идентификация повреждения и определение его типа; 2) активация ферментов, которые или напрямую преобразуют повреждение до исходного состояния, или (если прямое восстановление невозможно) вырезают поврежденный участок, формируя брешь. В последнем случае прибавляются еще 2 этапа: 3) синтез нового участка молекулы ДНК (взамен поврежденного) и 4) его встраивание в брешь.
Репарация однонитевых разрывов ДНК вызывается в ответ на действие ионизирующей радиации. Она обеспечивается последовательным действием ферментов. Восстановление такого разрыва идёт с использованием в качестве матрицы неповрежденной комплементарной цепочки ДНК. Двунитиевые разрывы молекулы ДНК являются самым опасным для клетки типом повреждений ДНК. Они, как правило, приводят к развитию генетической нестабильности, появлению мутаций и хромосомных аберраций и последующей гибели клеток.
Успехи радиационной терапии, использующей излучения с малыми ЛПЭ, в онкологии связаны со способностью нормальных тканей к восстановлению ДНК после облучения, при одновременной плохой восстанавливаемости раковых клеток. Это — «терапевтические» излучения. Излучения с высоким ЛПЭ (например, высокоэнергетичные ионы углерода) необратимо разрушают двойные спирали ДНК как в раковых, так и в здоровых клетках — «хирургические» излучения. Поэтому медицинское применение радиации с высоким ЛПЭ возможно только при точном наведении излучения на цель.