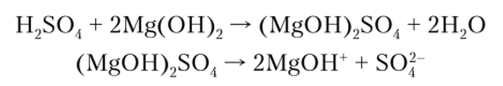Кислотно-основная ионизация.
Нейтрализация

Кислоты, у которых имеется больше одного ионизируемого протона (H2S04, H2S, Н3Р04, Н2С03 и т. д.), называются многоосновными. Диссоциация таких кислот осуществляется в несколько стадий. Такой процесс называется ступенчатой диссоциацией. Например, для угольной кислоты выражения для констант равновесия запишутся так: Реакция нейтрализации между сильными кислотами и сильными основаниями (щелочами… Читать ещё >
Кислотно-основная ионизация. Нейтрализация (реферат, курсовая, диплом, контрольная)
Электролитическая диссоциация гидроксидов зависит от природы и полярности связей. Так, в гидроксиде ЭОН диссоциация может протекать в двух направлениях:
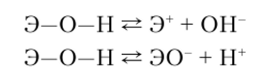
Так как полярность связей определяется сродством к электрону, электроотрицательностью, размерами и зарядом ионов, то щелочные, щелочноземельные металлы, а также переходные элементы в низших степенях окисления (о степенях окисления подробнее см. в гл. 9) образуют ионы сравнительно большого размера и с малым зарядом. По этой причине связь Э—О обладает малой прочностью и диссоциация ЭОН идет преимущественно по типу оснований, т. е. с отщеплением гидроксид-аниона.
По мере возрастания степени окисления увеличивается заряд Э, и поэтому диссоциация идет преимущественно по типу кислот, т. е. с отщеплением иона водорода. Происходит это по той причине, что связь Э—О становится более прочной, а связь О—Н ослабевает вследствие смещения электронной плотности к атому кислорода. Если же прочность связей Э—О и О—Н сравнительно одинакова, то диссоциация гидроксида ЭОН может протекать как, но типу оснований, так и по типу кислот, т. е. гидроксид является амфотерным.
Внутри периодов наблюдаются другие закономерности. Так, в третьем периоде от натрия к хлору радиусы ионов уменьшаются, а степень окисления в соединениях типа ЭОН возрастает от +1 до +7. В связи с этим поляризующее действие ионов элементов возрастает слева направо. Поэтому гидроксид NaOH обладает типичными основными свойствами, в то время как НСЮ4 является типичной кислотой. Если элемент образует различные гидроксиды в зависимости от степени окисления (например, 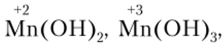
 , то в соединениях с низшими степенями окисления элемента более выражены основные свойства, а в соединениях с высшими степенями окисления преобладают кислотные свойства. Следовательно, с возрастанием степени окисления и уменьшением ионного радиуса основные свойства гидроксидов ослабевают, а кислотные увеличиваются.
, то в соединениях с низшими степенями окисления элемента более выражены основные свойства, а в соединениях с высшими степенями окисления преобладают кислотные свойства. Следовательно, с возрастанием степени окисления и уменьшением ионного радиуса основные свойства гидроксидов ослабевают, а кислотные увеличиваются.
Для двух типов реакции вещества ЭОН запишем выражение для константы диссоциации (ионизации):
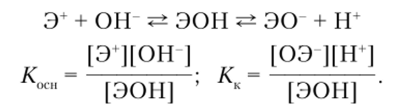
Исходя из уравнения реакции найдем отношение /Сосн к Кк:

Из уравнения (8.11) следует, что если Косп/Кк 1, то диссоциация в растворе идет по основному типу, поэтому концентрация ионов ОН больше концентрации гидратированных ионов Н+. Наоборот, когда К(>а1/Кк 1, то диссоциация протекает по кислотному типу, а в растворе концентрация гидратированных ионов Н( будет больше, чем ионов ОН. Если же Коси/Кк ~ 1, то диссоциация может одновременно протекать как по основному, так и по кислотному типу, что указывает на амфотерность гидроксида.
Кислоты, у которых имеется больше одного ионизируемого протона (H2S04, H2S, Н3Р04, Н2С03 и т. д.), называются многоосновными. Диссоциация таких кислот осуществляется в несколько стадий. Такой процесс называется ступенчатой диссоциацией. Например, для угольной кислоты выражения для констант равновесия запишутся так:
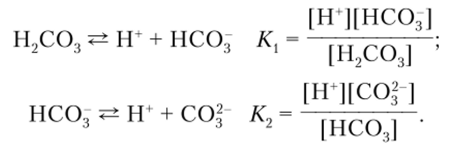
Таким образом, значение К может быть определено для каждой стадии диссоциации. Полная константа определяется из уравнения.

Реакция нейтрализации между сильными кислотами и сильными основаниями (щелочами) протекает так, что изменение AG реакции соответствует протеканию одного и того же процесса: 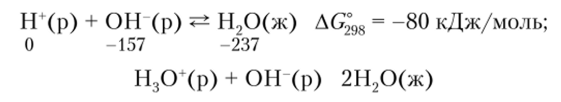
Реакции нейтрализации, в которых одно из исходных веществ является слабым электролитом и одно из образующихся веществ — малодиссоциирующим соединением, протекают не до конца. При этом они доходят до состояния равновесия, при котором получающаяся соль сосуществует с кислотой. В реакциях нейтрализации, варьируя эквивалентными количествами кислоты и основания, можно получать соли различных типов.
Если образование соли представить в виде схемы.
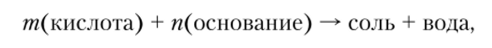
где тип — соответствующие эквивалентные количества кислоты и основания, то исходя из соотношения этих соединений имеем соли:
т = п — образуются средние соли.
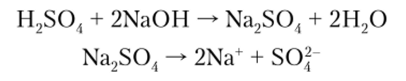
т> п — образуются кислые соли:
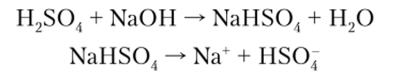
т<�п — образуются основные соли: