Хроматометрическое титрование.
Хроматометрическое и фотометрическое определение железа в железной руде
Э (K2Cr2O7) = M (K2Cr2O7)/6 = 49 г/моль Бихромат калия способен окислять многие неорганические и органические вещества: Fe2+, Mn2+, Mn3+, V4+, W3+, Mo5+, Te4+, сульфит, дитионат, гексацианоферрат (II), арсенит, иодид, спирты, гидрохинон, глицерин, аскорбиновую кислоту, тиомочевину и др. Ред-окс-реакции с участием бихромата протекают относительно медленно. Скорость реакций заметно повышается… Читать ещё >
Хроматометрическое титрование. Хроматометрическое и фотометрическое определение железа в железной руде (реферат, курсовая, диплом, контрольная)
Теоретические основы метода
Титриметрический (объемный) анализ объединяет группу методов количественного химического анализа, основанных на процессе титрования. Он заключается в измерении объема раствора реагента, израсходованного на эквивалентное взаимодействие с определяемым веществом. По концентрации и объему раствора реагента вычисляют содержание определяемого вещества. Титриметрический метод анализа применим для определения средних и больших содержаний веществ (свыше 1%).
Реакции, используемые в титриметрии, должны удовлетворять следующим основным требованиям:
- — реакция должна протекать количественно, т. е. константа равновесия реакции должна быть достаточно велика;
- — реакция должна проходить быстро;
- — реакция не должна осложняться протеканием побочных реакций;
- — должен существовать способ определения окончания реакции.
В зависимости от типа реакции, которая лежит в основе определения, различают следующие методы титриметрического анализа: кислотно-основное, окислительно-восстановительное, осадительное и комплексиметрическое.
Титрование можно проводить из отдельных навесок и пипетированием. В первом случае титруют все количество определяемого вещества. При пипетировании исследуемый раствор (или навеску вещества) количественно переносят в мерную колбу, доводят водой до метки и тщательно перемешивают. Далее из мерной колбы отбирают пипеткой несколько проб раствора (аликвоты) для параллельных титрований.
В данной работе используется один из видов окислительно-восстановительного титрования (редоксометрии) — дихроматометрия.
Хроматометрией называют метод объемного анализа, основанный на использовании в качестве титранта — окислителя дихромата калия или (реже) хромата калия. Иногда вместо указанных реагентов применяют трехокись хрома (хромовый ангидрид), который растворяют в ледяной уксусной или концентрированной серной кислоте.
Обычно титрование проводят в сернокислой, солянокислой или фосфорнокислой средах. Применение дихроматометрического метода основано на реакции окисления—восстановления хрома:
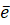
Cr2O72- + 14H+ + 6 = 2Cr3+ + 7H2O.
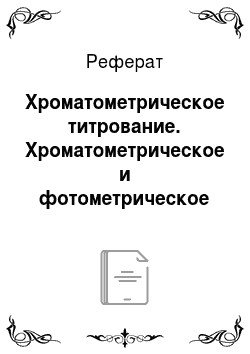
Нормальный окислительно-восстановительный потенциал этой системы E0Cr2O72-/2Cr3+ равен +1,36 В, т. е. соединения Сr6+ обладают большей окислительной способностью, чем элементарный йод, но меньшей, чем перманганат. Из приведенного выше уравнения реакции следует, что эквивалент бихромата калия равен его молекулярному весу, деленному на 6:
Э (K2Cr2O7) = M (K2Cr2O7)/6 = 49 г/моль Бихромат калия способен окислять многие неорганические и органические вещества: Fe2+, Mn2+, Mn3+, V4+, W3+, Mo5+, Te4+, сульфит, дитионат, гексацианоферрат (II), арсенит, иодид, спирты, гидрохинон, глицерин, аскорбиновую кислоту, тиомочевину и др.
Методы определения конечной точки титрования. Для фиксирования конечной точки титрования в методе дихроматометрии применяют различные способы.
- 1) Безындикаторный метод основан на наблюдении за окраской титруемого раствора, вызываемой избытком реагента. При этом зеленый цвет, присущий ионам Cr3+, переходит в желто-зеленый. Иногда изменение окраски раствора вызывается окислением окрашенного определяемого вещества, меняющего окраску при действии бихромата (например, синее индиго меняет окраску на желто-коричневую).
- 2) Индикаторный метод основан на применении внутренних ред-окс-индикаторов (дифениламин, дифениламинсульфокислота, фенилан-траниловая кислота), хемилюминесцентных индикаторов, а также внешних индикаторов (лейкометиленовый голубой).
- 3) Инструментальные методы (потенциометрический, кондуктометрический, высокочастотный, амперометрический и др.).
Преимущества хроматометрического метода и его недостатки.
- 1. Бихромат калия легко получить в химически чистом состоянии. Стандартный раствор бихромата калия готовят по точной его навеске (первичный стандарт). Это позволяет использовать бихромат калия в качестве установочного вещества при определении титров других стандартных растворов, например для установки стандартных растворов тиосульфата, титана и т. п.
- 2. Растворы очень устойчивы. Титр бихромата калия не изменяется в течение долгого времени даже под влиянием различных факторов (температуры, действия кислорода или двуокиси углерода воздуха и т. д.).
- 3. Титрование бихроматом калия можно проводить в солянокислой среде, тогда как титрование перманганатом в присутствии Cl- связано с окислением его в элементарный хлор.
- 4. В отличие от более слабых окислителей, каким является, например, йод, бихромат способен окислять многие органические соединения.
- 5. Титрование бихроматом в среде концентрированной фосфорной кислоты (для уменьшения потенциала системы), предложенное индийским ученым Гопало, позволяет проводить дифференцированное титрование двухи трехкомпонентных смесей катионов, например, Fe2+ + V4+, Mn2+ + V4+, Fe2+ + V4+ + Mn2+ и т. п.
Недостатки метода:
- 1. Бихромат калия менее сильный окислитель, чем перманганат и поэтому он использовался относительно меньше, чем перманганат. Однако в настоящее время бихромат приобретает все более широкое применение.
- 2. Ред-окс-реакции с участием бихромата протекают относительно медленно. Скорость реакций заметно повышается в сильно кислых средах, так как окислительно-восстановительный потенциал системы возрастает по мере увеличения концентрации ионов водорода.
- 3. Конечную точку титрованию по изменению окраски раствора, вызываемой избытком реагента, относительно трудно установить, поэтому титрование проводят предпочтительно индикаторным способом.
Определение содержания железа (II) бихроматометрией.
Определение железа (II) хроматометрическим методом основано на прямом титровании ионов железа (II) стандартным раствором бихромата в сернокислой или солянокислой среде в присутствии фосфорной кислоты:
6Fe2+ + Cr2O72- + 14H+ + 6 = 6Fe3+ + 2Cr3+ + 7H2O.
Фосфорную кислоту прибавляют для того, чтобы связать в комплекс образующиеся ионы железа (III), что благоприятствует титрованию:
6Fe3+ + 12PO42- = 6[Fe (PO4)2]3-.
В качестве индикатора используют дифениламин (ДФА).