Законы адсорбции.
Хроматографический адсорбционный анализ

При разборе качественного и количественного экспериментального материала по явлениям поглощения углем или же какими-либо иными веществами, с целью установить законы адсорбции, нужно принимать во внимание, что последняя нередко сопровождается и усложняется явлениями другого, главным образом химического, порядка. Животный и растительный уголь, поглотительные свойства которого до сих пор… Читать ещё >
Законы адсорбции. Хроматографический адсорбционный анализ (реферат, курсовая, диплом, контрольная)
При разборе качественного и количественного экспериментального материала по явлениям поглощения углем или же какими-либо иными веществами, с целью установить законы адсорбции, нужно принимать во внимание, что последняя нередко сопровождается и усложняется явлениями другого, главным образом химического, порядка. Животный и растительный уголь, поглотительные свойства которого до сих пор преимущественно исследовались, едва ли может считаться способным входить в реакцию с большинством веществ, предлагаемых ему для адсорбции, но зато он обладает каталитическими свойствами, на целый ряд которых указывают, например, Cazeneuve (90), Freundlich (стр. 11): окисление муравьиной, лимонной и миндальной кислот, а также глицерина, гидролиз GI и Вг (образование НС1 и НВг), этерификация кислот в спиртовом растворе.
Выяснить законы адсорбции можно, следовательно, только при работе с неподдающимися подобным изменениям веществами или при возможном ограничении продолжительности отдельных опытов.
Такие условия наиболее осуществлены в исследованиях Ostwald’a, Lachaud’a, Lagergren’a, Van Bemmelen’a (07), Freundlich’a и Losew’a (06—07). Названными трудами несомненно устанавливается, что адсорбционное поглощение — явление определенного равновесия, легко устанавливающегося с одной, как и с другой стороны, причем адсорбируемое вещество распределяется в известной пропорции между растворителем и адсорбентом. Опыты производились обыкновенно следующим образом: в определенный объем раствора известной концентрации вводится определенное количество порошкообразного, очищенного посредством соляной кислоты и высушенного угля (костяного, кровяного, древесного, сахарного и пр.). Смесь подвергается повторному встряхиванию, и через некоторое время после того, как адсорбент отстоялся, жидкость декантируется и в ней определяется, химическим или спектроколориметрическим путем, концентрация растворенного вещества.
Быстрота п о г л о ще н и я. Адсорбционное равновесие достигается быстро. По Lagergien’y (стр. 9) оно устанавливается в течение 9 часов; такую же цифру дает Van Bemmelen (стр. 345); Lachaud получает равновесие в течение 30—40 минут; Freundlich встряхивает смесь несколько раз в руке и ставит затем в термостат для отстаивания. Данные Кгоескег’э, по которым адсорбция брома углем длится 22 дня, Lagergren справедливо объясняет вмешательством побочных процессов (образование НВг).
Davis, исследовавший в прошлом году адсорбцию иода растительным углем, нашел, что течение ее распадается на два фазиса. В первом она идет очень быстро, но затем продолжается медленно в течение недель и месяцев. Это последнее поглощение автор старается объяснить, допуская диффузию иода в само вещество углевых крупинок. Подобное допущение делает Travers (06) для адсорбции газов; едва ли, однако, в опытах Davis’a не играют роли побочные химические процессы.
Ход адсорбционного поглощения (углем) был исследован Lagergren’oM для щавелевой и янтарной кислот. Он выражается удовлетворительно формулой.
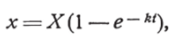
где X — количество вещества, поглощенного по достижении равновесия, х—количество вещества, поглощенного во время t от начала опыта, а k постоянная.
Следовательно, поглощение, сначала быстрое, асимптотически замедляется, приближаясь к пределу.
Lagergren (стр. 34) отмечает, что, согласно теории, поглощение должно было бы происходить моментально, ввиду незначительности тех молекулярных расстояний, на которых происходит конденсация вещества. Наблюдаемую же на деле длительность процесса он объясняет пористостью углевых частичек, которая не допускает моментального смачивания раствором всей внутренней поверхности частичек.
Формула равновесия. Выше названные исследования новейшего времени доказали, что в адсорбционных равновесиях, устанавливающихся между определенным адсорбентом и определенным веществом, растворенным в определенной жидкости, количество поглощенного вещества при данной массе адсорбента и данной температуре зависит исключительно от концентрации остающегося в растворе вещества. Если назвать условно концентрацией поглощенного вещества (с') весовое соотношение его к адсорбенту, то соотношение с' к концентрации с остающегося в растворе вещества не есть постоянная, что соответствовало бы закону Henry, но выражается формулой 
где k—непостоянная, зависящая от с и величина которой уменьшается, когда с возрастает.1 Соотношение соответствует адсорбционному коэффициенту Ostwald’a (Band II, 252).
Следовательно, адсорбционные коэффициенты наиболее значительны при слабых концентрациях, и количество поглощенного вещества возрастает с концентрацией последнего в растворе, но менее быстро, постепенно приближаясь к пределу, определяемому коэффициентом растворимости. Что касается определения функциональной зависимости k от с, то было предложено несколько формул, наиболее удачной из которых является, повидимому, показательная функция Freundlich’a.
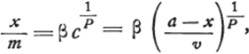
где v—объем жидкости, а — количество растворенного вещества (в начале опыта), х — количество поглощенного вещества, т — количество адсорбента, (3 и р — постоянные, зависящие от природы растворенного вещества и адсорбента, а также от температуры.[1][2]
При возрастающей температуре коэффициенты адсорбции падают; влияние это, впрочем, незначительно (Lagergren,. Freundlich). Подобное же влияние температуры наблюдается и для адсорбции газов (Dewar, 04).
Вышеприведенная формула непригодна для водных растворов сильно диссоциированных веществ (Freandlich). а также для коллоидальных растворов, как показывают опыты Van Bemmelen’a (00) над поглощением гидрозоля As2S3 углем и наблюдения Lachaud над поглощением таннина и декстрина из водных растворов. Ниже известной концентрации поглощение является полным, без распределения между адсорбентом и средой.
При поглощении некоторых базических красок углем и прядильными волокнами наблюдается разложение краски, причем пигментное основание поглощается, а кислота остается количественно в растворе. Здесь нет надобности принимать химического взаимодействия между адсорбентом и пигментом или гидролитического расщепления последнего в растворе (Freundlich u. Losew).
Наблюденное Кгоескег’ом наступление щелочной реакции в растворах нейтральных солей при адсорбции углем Lagergren объясняет освобождением из угля следов щелочей, удерживаемых в нем примешанной кргмнекислотой.
Зависимость величины адсорбции от природы адсорбента. Величина адсорбции (? в предыдущей формуле) для каждого отдельного поглощаемого вещества зависит от природы употребляемого адсорбента; под словом же природа здесь понимается сложный комплекс физико-химических свойств адсорбирующих зернышек, их химическое строение, вес, величина, поверхность.
Расчленить этот комплекс, выяснить функциональное соотношение между его составными факторами и величинами адсорбции до сих пор не удалось, и к решению этой задачи серьезно даже еще не приступали. Можно лишь отметитьфакт, что вещества, которые, подобно углю или гидрогелям, благодаря своему состоянию крайней раздробленности представляют наибольшую «внутреннюю» поверхность, обладают наибольшей поглотительной способностью.
Другой вопрос, относящийся сюда,—следующего рода. Если мы для какого-нибудь адсорбента определим величины адсорбции для ряда растворенных веществ и соединим полученные числа в кривую, то будет ли последняя параллельна такого же рода кривым, установленным для иных адсорбентов, являясь характерной для данной серии растворенных веществ, независимо от природы адсорбента? На этот вопрос имеются противоречивые ответы.
Lachaud нашел для нескольких сортов угля, что упомянутые кривые не только не параллельны, но даже могут пересекаться. С другой стороны, Freunddch и Losew, работая с углем и прядильными волокнами, установили для нескольких анилиновых красок полный параллелизм кривых. Очевидно, вопрос требует дальнейшей разработки.
Зависимость величины адсорбции от природы растворенного вещества. Из довольно многочисленных числовых определений новейших авторов по величинам адсорбции различных растворенных веществ не удалось вывести общих законов зависимости этих величин от природы поглощаемых веществ. В числе частичных подмеченных закономерностей можно указать на наблюдения Lachaud над поглощением углем солей салициловой кислоты; величина адсорбции (не перечисленная, впрочем, на эквиваленты) возрастала с молекулярным весом. Очень сильную адсорбцию нашел Freundlich для ароматических кислот и для галоидов, очень слабую для минеральных солей. Показатель.
у в приведенной на стр. 80 формуле колеблется по Фрейндлиху между величинами 0.2 и 0.5, независимо от природы растворителя, растворенного и адсорбента. Для исследованных ими анилиновых красок Freundlich и Losew нашли еще меньшие адсорбционные показатели, причем для Kristallviolet.
— оказался даже величиной отрицательной.
В опытах Lagergren’a обнаружилась для некоторых солей (NaCI, KCI, NH4CI, NH4Br, MgCI2) отрицательная адсорбция, т. е., вместо конденсации, разрежение растворенного вещества на поверхности адсорбента (уголь и каолин). Но Freundlich не мог подтвердить существование этого явления.
Зависимость величины адсорбции от природы растворителя. По наблюдениям Freundlich’а, произведенным, впрочем, лишь над немногими веществами, адсорбция в органических растворителях менее значительна, чем в воде. По теоретическим соображениям можно предполагать, что величина адсорбции одного и того же вещества в разных растворителях будет тем значительнее, чем худшим растворителем является жидкость для данного вещества.
Подобное предположение оправдывается для поглощения иода углем из воды и из спирта (Kroecker). Тем не менее, по наблюдениям Walker’a и Appieyard’a, шелк поглощает пикриновую кислоту из спиртового раствора, но не принимает ее из бензола или четыреххлористого углерода, хотя бензол является худшим растворителем данной кислоты. Замечательно и то, что предварительно окрашенный пикриновою кислотою шелк не обесцвечивается бензолом или четыреххлористым углеродом.
Адсорбция из смешанных растворов. Вопрос об адсорбции из смешанных растворов почти еще не исследован. Из сопоставления данных старой литературы, сделанного Van Bemmelen’oM, видно, что из разбавленных растворов отдельные составные поглощаются независимо, пропорционально их частным коэффициентам. В концентрированных же растворах наступают физические и химические взаимодействия, систематически еще не изученные, причем наблюдаются явления замещения. Lachaud нашел, что прибавление небольшого количества салициловой кислоты к раствору декстрина вполне устраняет поглощение последнего углем.
Явления адсорбционного замещения. Явления замещения поглощенных из раствора веществ были неоднократно наблюдаемы: так, Van Bemmelen (80) нашел, что А1С13, поглощенный гидрогелем кремнистого ангидрида, H2S04, удерживаемая красным гидрогелем окиси марганца, и СаСЦ, адсорбированный гидрогелем окиси хрома, могут быть удалены растворами КС1 или Кг504.
Quincke (02) видел, что растворенный К2С03 вытесняется СаС12 с поверхности стекла. Подробное исследование этого темного еще вопроса можно найти у Van Bemmelen’a (00). Ему же посвящена диссертация Imass’a (99).
Адсорбция растворителя. Явлению конденсации на поверхности твердых тел подлежат не только растворенные вещества, но и растворитель. Доказательства существования адсорбции растворителя следующие.
Твердые тела в очень измельченном виде поглощают пары растворителей (как и вообще газы). Точно исследовано поглощение водяных паров стеклом (Bunsen, 85), глиной, окисями железа и кобальта, древесным углем (МОИегErzbach, 86); поглощение паров бензола и сероуглерода — глиной и окисью железа (Miiller-Erzbach, 89.).
Поглощение паров связано, разумеется, с понижением их напряжения в паросодержащей среде, и понижение это тем более значительно, чем меньше насыщен поглотитель (Bunsen, 85, Muller-Erzbach, 85). К тому же результату пришел Van Bemmelen (93, 97), исследуя испарение воды из разных гидрогелей при определенных напряжениях паров в окружающей атмосфере.
При смачивании нерастворимых порошкообразных веществ наблюдается выделение теплоты. Это явление («effet Pouillet»), открытое сначала при смачивании водою, имеет место при других жидкостях: спирте, сероуглероде, эфире, бензоле, керосине, глицерине, маслах (Pouillet, Maschke, Meissner, Marini, 98).
Вышеприведенные факты указывают на то, что слои жидкости, прилегающие к поверхности смачиваемого ею твердого тела, находятся под давлением, результирующим от сил притяжения между твердым телом и жидкостью.
Принимая в расчет радиус сферы действия молекулярных сил (50 ру. по Quincke), площадь поверхности поглощающего тела и наблюденные Bunsen’oM (83) и Cuappuis (81) величины поглощения газов стеклом и углем, можно попытаться вычислить плотность адсорбированных газов и соответственные давления. Подобные расчеты, сделанные Bunsen’oM для С02 поглощаемой стеклом, произвел Lagergren (99, II) для давления, существующего в слоях жидкости, смачивающей уголь, и определил его в несколько тысяч атмосфер. Возражение Ostwald’a (00), что при увеличенном давлении на жидкость напряжение ее паров возрастает, между тем как адсорбированная вода обладает уменьшенным против нормального давлением паров, представляется мне несостоятельным как основанное на следующем недоразумении.
То, что называется напряжением паров какой-нибудь жидкости, есть, строго говоря, давление насыщенных паров ее в тонком, непосредственно к поверхности жидкости прилегающем слое безвоздушного пространства.
Величина этого напряжения зависит, между прочим, от высоты столба паров, давящих на жидкость, т. е. зависит вообще от давления, испытываемого жидкостью. Таким образом, напряжение паров всего значительнее в непосредственном соседстве с жидкостью и уменьшается постепенно в вышележащих слоях. С этой неоднородностью столба паров над жидкостью можно в обыкновенных условиях не считаться, так как могущие происходить отсюда погрешности бесконечно малы. Так, например, можно считать, что при введены какой-нибудь жидкости в торричелиеву пустоту, истинное напряжение ее паров определяется степенью падения уровня ртути.
Совсем иначе при определении напряжения паров жидкости адсорбированной. Здесь, хотя и на незначительном протяжении, жидкость и ее пары находятся под влиянием молекулярного притяжения адсорбента, величина которого обратно пропорциональна 4-й степени расстояния (Sutherland), а потому является громадной. Поэтому в столбе паров, лежащем на слое адсорбированной жидкости, поскольку этот столб еще находится в сфере действия молекулярного притяжения адсорбента, давление будет чрезвычайно быстро изменяться, уменьшаясь по мере удаления от поверхности адсорбирующего тела и становясь, наконец, равным тому давлению, которое господствует в окружающей среде и которое мы измеряем, ошибочно думая, что оно представляет давление паров адсорбированной жидкости. Последнее гораздо значительнее.
Такие же ошибочные результаты мы получили бы, если, желая определить напряжение паров воды, поместили бы последнюю на дне вертикальной, длиною в несколько километров трубки, а давление паров, по установлении равновесия, измеряли бы на верхнем конце.
Таким образом исчезает кажущееся противоречие между теорией конденсации жидкостей на поверхности смачиваемых ими тел и термодинамически доказанным законом, по которому давление увеличивает напряжения паров жидкостей.
Несколькими авторами были сделаны попытки определить толщину капиллярного слоя воды, адсорбированной из влажного воздуха на поверхности стеклянной ваты или осажденного кремнезема. Parks (03) помещал в камеру, насыщенную водяными парами, определенное количество стеклянной ваты, площадь поверхности которой была вычислена и, посредством взвешивания ваты, наблюдал прирост количества адсорбированной воды. Вычисление дало максимальную величину в 134 yf. при 12—15°С.
В адсорбции воды стеклом замешаны и химические явления: а именно — растворимость стекла в этой жидкости (ср. Warburg u. Ihmon, 86). Интересны поэтому вычисления, которые сделал Parks относительно толщины капиллярного слоя воды, удерживаемого кремнеземом, основываясь на числовых данных Martini (00) и Bellati и Finazzi (02) о выделении теплоты при смачивании кремнезема водою. Вычисления эти приводят к величинам того же порядка, что и специально для занимающей нас цели поставленные опыты Paiks’a. Результаты этого автора совпадают тоже в достаточной степени с определениями Barns’а (02) относительно размеров водяного слоя, сгущающегося на пыльных ядрах.
При адсорбции жидкостей на поверхности твердых тел наблюдаются явления замещения. Уже Chevreul (66) заметил, что масло (прованское) вытесняет воду, пропитывающую свинцовые белила, и, наоборот, вытесняется водою из глины каолина.
Quincke (77) определил для стекла следующий ряд замещения: сероуглерод, керосин, прованское масло, спирт, скипидар, вода, ртуть. Каждый из членов этого ряда вытесняет послед> ющие и вытесняется предыдущими.
Порядок замещения зависит, впрочем, от твердого тела: вода вытесняет спирт с поверхности животного пузыря, но вытесняется им с поверхности каучука. МйИег-Erzbach (02) установил, что водяные пары вытесняют адсорбированные глиной пары сероуглерода.
- [1] Утверждение Schmidt’a, что при адсорбции КС1 посредством аморфнойкремнекислоты k есть постоянная, неосновательно. Приведенные им числовые данные, несомненно, показывают, что k, хотя и в незначительнойстепени, постоянно уменьшается при возрастающей концентрации солевогораствора.
- [2] Freundlich предложил еще иную формулировку — функция), нанесовершенство которой указывает McBain. С настоящей формулой хорошо согласуются экспериментальные данные, полученные Pelet et Grand (07) и Mojoin et Pelet (08).