Система Si — С, свойства и политипизм карбида кремния

Несмотря на то, что изучение политипизма началось более 50 лет назад именно с исследования карбида кремния, тем нс менее, его природа до настоящего времени не установлена, хотя существует ряд теорий и гипотез. Рассмотрим некоторые из них. Одна из первых теорий политипизма в SiC, предложенная Франком (дислокационная теория), базируется на определяющей роли винтовых дислокаций в формовании… Читать ещё >
Система Si — С, свойства и политипизм карбида кремния (реферат, курсовая, диплом, контрольная)
Первый вариант диаграммы состояния Si — С (рис. 1.1) был опубликован Н. Н. Новотным с сотрудниками в 1954 году [103]. Затем эта диаграмма была дополнена И. С. Брохиным и В. Ф. Функе [6, 7] и В. Ф. Книппенбергом [126] (рис. 1.2).
Из диаграммы (рис. 1.2, а) следует, что в системе существует три конденсированные фазы — углерод, кремний и карбид кремния, который не имеет области гомогенности (г.е углерод и кремний практически не растворяются в SiC). При температурах 1681 и 3073К наблюдаются нонвариантные точки, отражающие соответственно трехфазные равновесия Ж + а + SiC иЖ + SiC + С. При температуре 3100 ± 100 К SiC разлагается по псритсктичсской реакции на графит и раствор углерода в кремнии. 11а диаграмме определены также двухфазные области: Ж + С, Ж + SiC, SiC + С, а — SiC и Si + SiC. Однако концентрационные границы диаграммы областей существования жидких и твердых растворов, а также двухфазных полей точно не определены.
![Диаграмма состояния Si - С по [103].](/img/s/8/34/1394234_1.png)
Рис. 1.1. Диаграмма состояния Si — С по [103]: а — по данным Н. Н. Новотнова; б — по данным И. С. Брохина и В. Ф. Функе.
![Диаграмма состояния Si - С по [6, 7, 126, 163].](/img/s/8/34/1394234_2.png)
Рис. 1.2. Диаграмма состояния Si — С по [6, 7, 126, 163]: а — при атмосферном давлении; б — при повышенном давлении Ссйкх и Слек [163] исследовали равновесие в системе SiC — С при давлении 100 атм. Как видно из рис. 1.2, трехфазные равновесия с повышением давления (рис. 1.2, б) отодвигаются в область более высоких температур, и образуется область расплава, в которой имеет место полная взаимная растворимость обоих компонентов. Температура кипения этого расплава имеет минимум, отвечающий, по-видимому, азеотропной смеси Si-ж — СЖ;
Фаза SiC не имеет конгруэнтной точки плавления; она перитектически разлагается на 1рафит и богатый кремнием расплав при повышеном давлении (см. рис. 1.2, б) и на графит и газовую фазу при атмосферном давлении (рис. 1.2, а). Инконгруэнтный характер испарения подтверждается результатами масс-спектрографического анализа газовой фазы над SiC [105]. Температура полного диссоциативного испарения SiC согласно данным [26] и [163] находится в пределах 3033 чЧ-3103К.
На рис. 1.3 приведен более поздний вариант диаграммы состояния системы SiC — С, согласно данным работы [146]. Сплавы исследовали методом дифференциального термического анализа, металлографии и рентгенофазового анализа. Как видно из рис. 1.3, жидкая фаза имеет протяженную область концентраций и соединение SiC образуется по перитектической реакции при температуре 2445 °C (2818К); в жидкости, принимающей участие в реакции, содержится 27% (ат.) С. Значение температуры этой реакции 2835 °C (3108К), приведенной в работе [164], завышено.
Температура эвтстики (Si) + SiC, согласно [146] составляет 1404 ± 5 °C (1678 ± 278 К), а состав эвтектической точки отвечает 0,75 ± ± 0,5% (ат.) С. Наиболее вероятным значением, по-видимому, является нижнее 0,25% (ат.) С, с учетом данных работы [14], в которой показано, что Si при температуре 1973 К и выдержке 1 час растворяет 0,27% (ат.) С в контакте с сажей и всего лишь 0,05% (ат.) С — в контакте с графитом. Замедленным растворением графита в жидком кремнии обусловлено получение завышенного коэффициента распределения С между твердой и жидкой фазами при эвтектической температуре в работе [143] 0,07 и 0,1 [119]. Согласно данным [146], едва ли можно считать окончательно установленной растворимость С в Si в твердом состоянии. Наиболее приемлемым представляются данные работ [143, 88]: согласно [143] растворимость С в твердом Si при эвтектической температуре составляет 7 • 10 '4 % (ат.) по данным радиоактивационного анализа монокристаллов, полученных методом Чохральского, после зонной плавки в различных режимах. С этим значением удовлетворительно согласуется значение 9 • КГ4 (аг.) С, полученное экстраполяцией на эвтектическую температуру данных о растворимости С в Si в области температур 1423 — 1623 К [88]:
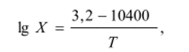
где Л'- С, % (ат.); Т- температура, К.
![Диаграмма состояния системы SiC - С по [146].](/img/s/8/34/1394234_4.png)
Рис. 1.3. Диаграмма состояния системы SiC — С по [146].
Карбид кремния существует в двух модификациях: кубической (р — SiC) со структурой типа сфалерита (символ Пирсона с F8, пр. гр. F 43т), а = 0,43 596 нм и гексагональной (а — SiC) со структурой вюрцита (символ Пирсона ИР4, Р6 $тс, [146], для которой характерно явление политигшзма (а = 0,3078 нм, с = п ? 0,2518 нм, где п — число слоев в элементарной ячейке). Согласно данным работы [146], при температуре выше 2273 К р — SiC монотонно переходит в, а — SiC, в то время как по данным авторов [164] р — SiC термодинамически стабилен при всех температурах вплоть до инконгруэнтного плавления. Разница в энтальпии ри амодификаций SiC при 298, 16 К составляет.
250,8 Дж/моль, в энтропии — 0,125 Дж/(моль • град), а переход (3 — Si С в aSiC сопровождается изменением объема па 0,06%.
До последнего времени температурой образования (3 — SiC считали или температуру начала взаимодействия Si и С, равную 1470 ч- 1670 К, или температуру взаимодействия Si02 с С — 1770 К. Однако в отдельных случаях, позже, Р — SiC был получен из легкоплавких расплавов (алюминия, кремния и цинка) при температуре 798 К.
По данным ряда авторов при температурах 2170 ч- 2570 К р — SiC перскристаллизовывается в, а — SiC, а наиболее быстрая перекристаллизация идет при 2470 ч- 2570 К. Выше температуры 2570 К SiC термически разлагается на элементы. Истинное положение границы между областями устойчивого существования р — SiC и aSiC неизвестно до настоящего времени. Предполагается, что переход р — SiC —>а- SiC осуществляется через газовую фазу, поскольку энергия активации процесса такого перехода составляет 660,44 кДж/моль и близка к значению теплоты испарения SiC, равной 556 кДж/моль.
Установлено, что большое значение на образование р — SiC и aSiC оказывает не только температура, но и давление и наличие примесей. Так, Сксйс и Слек получали кристаллы Р — SiC при температуре 2973 К и выше под давлением 3546,4 кПа. При таком давлении может наблюдаться переход aSiC в р — SiC, а при наличии примесей aSiC может образовываться наряду с р — SiC при температурах ниже 2270 К (например, при 1773 К). Присутствие примесей таких элементов как А1, В, Fe приводит к стабилизации аформы SiC.
Рассмотренные выше диаграммы системы Si — С (рис. 1.1 — 1.3) дают сведения о существовании и взаимодействии конденсированных фаз. Однако при высоких температурах требуется знание условий разложения карбида кремния. Согласно данным Б. Ф. Юдина [83] при температуре ниже 3150 К процесс диссоциативного испарения SiC может быть представлен следующими реакциями:
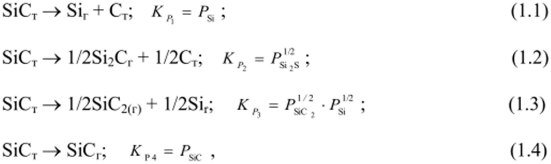
где Pi — равновесное давление /-го компонента; А*р — константа равновесия, рассчитывается по уравнению изотермы химической реакции:
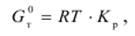
где R — универсальная газовая постоянная.
Степени протекания (л,) и молярные доли компонентов (N{) этих реакций в зависимости от температуры (Т, К) приведены на рис. 1.4. Под степенью протекания реакций в данном случае понимается доля распавшегося SiC, соответствующая реакции, идущей по схемам (1.1) -(1.4).
![Состав паров в мольных долях (N) над карбидом кремния и степень протекания реакций (л,) испарения и диссоциации SiC [83].](/img/s/8/34/1394234_7.png)
Рис. 1.4. Состав паров в мольных долях (Nf) над карбидом кремния и степень протекания реакций (л,) испарения и диссоциации SiC [83]: л2 — реакция (1.1); Из — реакция (1.3); л4 — реакция (1.4).
Из рис. 1.4 следует, что совместно могут протекать только реакции (1.2) и (1.4), а реакция (1.1) может иметь место только при температуре ниже 2540 К. С повышением температуры содержание SiC, SiC2 и Si2C увеличивается, а содержание Si уменьшается. Это связано с образованием насыщенных растворов углерода в кремнии, что вызывает понижение давления паров в газовой фазе. Степени протекания реакций (1.2) и (1.3) сохраняются практически постоянными в интервале температур 2540 — 3150 К, что также связано с образованием насыщенных растворов углерода в жидком кремнии (aSi). При температуре ниже 2540 К степени протекания реакций (1.2) и (1.3) уменьшаются, так как при этих условиях кремний выделяется только в газовой фазе.
Таким образом, до температуры 2540 К диссоциация SiC идет только в газовой фазе, при температурах выше 2540 К — разлагается в газовой и конденсированной фазах с образованием Si2C (m), SiC2 (, аз) и SiC (Т), а при температурах выше 3150 К SiC в конденсированной фазе не существует [83].
Особенностью карбида кремния амодификации является наличие множества его политипов. Термин политипизм дан карбиду кремния как соединению, обладающему специальным типом полиморфизма, при котором различные формы SiC близки друг к другу. Однако политипизм, а — SiC существенно не отличается от полиморфизма.
Карбид кремния кристаллизуется по законам плотной шаровой упаковки атомов. Кристаллы SiC обладают алмазоподобными кристаллическими решетками, в которых каждый атом Si находится внутри тетраэдра из атомов С и наоборот, т. е. решетка образована из слоев тетраэдров SiC4 и CSi4.
Политипы, а — SiC отличаются друг от друга числом слоев одинаково ориентированных тетраэдров в пачке таких слоев. В различных слоях основания тетраэдров могут быть параллельны и не параллельны друг другу. Если каждый второй тетраэдрический слой параллелен предшествующему слою, то получается кубическая структура (3 — SiC, а если каждый второй слой антипараллелен предыдущему, то получается гексагональный тип, а — SiC. Кубический политип [3 — SiC (или ЗС — SiC) имеет структуру цинковой обманки (ZnS); гексагональная (вюрцитная W) структура также существует в чистом виде и обозначается 2Н — SiC. Остальные гексагональные и ромбоэдрические политипы образуются комбинациями этих двух структур. Первоначально нолитипы SiC обозначались римскими цифрами в порядке их открытия, но поскольку число их все время росло, то необходимо было найти другой способ обозначения. Рамсделл к числу слоев в пределах длины параметра по оси С, принятым за характеристику политипа, а — SiC, приписал индексы Н и R в зависимости от того, является ли элементарная ячейка гексагональной или ромбоэдрической. Например: 6Н SiCII, 4Н — SiCIII, 15R — SiCI. Такое обозначение является простым, точным и наглядным. Различные более сложные политипы карбида кремния можно объединить в серии, сводящиеся к основным структурам, а — SiC, которыми и служат структуры с простейшими числовыми символами, а — SiCI (а — SiC 15R); а — SiCII (а — SiC6H); а — SiCIII (а — SiC4H); и р — SiC (ЗС).
Карбид кремния является первым веществом, при исследовании которого обнаружен политипизм как физическое явление [87]. В настоящее время в SiC идентифицировано уже более 150 политипов гексагональной, ромбоэдрической и тетрагональной симметрии, в которых параметр «С» изменяется от 0,5 НМ для политипа 2Н до 1200 НМ для политипа 4680. Политипы, открытые до 1966 года, описаны в работе [8], а более поздние открытия — в статьях периодических изданий.
В табл. 1.1 приведены характеристики некоторых политипов SiC по данным [42].
Основные характеристика некоторых политипов
Таблица 1.1.
Обозначение политипа. | D | Ч | [Si]. [С]. | ЛМО'20, см'3 | /", эВ. | |
N* | Nc | |||||
ЗС. | 0,74. | 1,046. | 2,0. | 2,3. | 2,2. | |
8Н. | 0,25. | 0,96. | 1,029. | 3,3. | 1,7. | 2,56. |
6Н. | 0,33. | 1,022. | 4,3. | 1,5. | 2,86. | |
0,40. | 1,19. | 1,012. | 5,7. | 1,1. | 2,90. | |
0,44. | 1,30. | 1,008. | 6,2. | 1,0. | ; | |
4Н. | 0,50. | 1,37. | 1,001. | 7,1. | 0,7. | 3,1. |
0,36. | ; | ; | ; | ; | ; | |
0,29. | —. | —. | —. | —. | 2,77. | |
ЮН. | 0,40. | ; | ; | ; | ; | ; |
Примечание. D — степень гексагоналыюсти; q — эффективный заряд на атоме кремния; N концентрация вакансий по [74]; h ширина запрещенной зоны по данным [125]_
В работе [107] приведены сведения об исследованиях иестехиометрии в SiC. Для стехиометрического SiC концентрация кремния в нем должна быть 70,05% по массе, однако, для политипа ЗС-SiC она составляет 71,04%, а для 6Н — SiC — 70,7% по массе.
Политипные превращения в SiC идут в различных термодинамических условиях — при нагревании в различных средах и в присутствии примесей, растворяющихся в решетке SiC, при различных механических нагрузках (изгиб, давление индентора и т. п.). Образование политипов SiC описано в ряде работ [8, 107, 9, 29, 166, 171]. Остановимся на рассмотрении стабильности основных политипов SiC.
Вюрцитная фаза 2Н — SiC, впервые открытая в процессе газофазного осаждения SiC при 1400 — 1500 °C в среде водорода [85], на практике при росте SiC наблюдается довольно редко. Несколько позже политип 2Н был выявлен в сочетании с ЗС — SiC при азотировании кремния, помещенного на графитовую подложку [71] и при разложении Si3N4 в среде азота с примесью оксида углерода СО [112]. Стабилизация фазы 2Н — SiC была объяснена растворением в ней кислорода [142]. По данным [27] в условиях одноосного нагружения кристаллов SiC (скольжение) при температуре 1873 — 2073 К возможен переход 6Ни ЗС — фаз в 2Н — фазу. Образование 2Н-фазы наблюдается также в поликристаллических SiC — материалах, формирование которых идет в присутствии кислорода, алюминия или магния [120, 118]. Следует подчеркнуть, что эта фаза нестабильна и уже при температуре выше 673 К она переходит в одномерно разупорядоченное состояние (ОРС) или двухфазное (2Н + ЗС) состояние, которое характеризуется высокой концентрацией дефектов упаковки [155].
Политип ЗС — SiC считается стабильным при температуре ниже 1673 К, а при более высоких температурах переходит в 6Н — политип, который является стабильной формой SiC в инертной газовой среде при температуре выше 2273 К [125]. Об этом свидетельствует практика промышленного получения SiC из Si02 и С при температурах 2273 — 2573 К. Именно в этих условиях в наибольшем количестве образуется политип 6Н — SiC.
Установлено, что примеси алюминия и бора, вводимые в SiC как в элементарном виде, гак и в виде соединений (AI2O3, В4С, BN) стимулируют переходы ЗС —> 6Н -" 4Н и ЗС -" 4Н, при этом эти примеси стабилизируют 4Н — политип [137, 110, 161, 162]. По данным [172] алюминий и бор растворяются в решетке SiC с образованием твердых растворов замещения. Действие примесей наиболее эффективно в сочетании с добавкой углерода, что авторы работы [158] объясняют очисткой поверхности кристаллов SiC от кислородной пленки и увеличением концентрации вакансий.
Монополитипные кристаллы могут формироваться только при длительном отжиге (например, переход ЗС —> 6Н) [76]. По данным [84, 48] азот стабилизирует ЗС — фазу SiC. Установлено, что при внедрении алюминия в эпитаксиальные слои 6Н — SiC происходит переход 6Н —>
ЗС при температуре 1673 К [80]. Предполагается, что этот переход реализуется через разупорядоченное состояние SiC.
Несмотря на то, что изучение политипизма началось более 50 лет назад именно с исследования карбида кремния [173], тем нс менее, его природа до настоящего времени не установлена, хотя существует ряд теорий и гипотез. Рассмотрим некоторые из них. Одна из первых теорий политипизма в SiC, предложенная Франком (дислокационная теория), базируется на определяющей роли винтовых дислокаций в формовании политипов при росте кристаллов SiC [173]. Рамсделл и Конн выдвинули полимерную теорию, в которой появление политипов объясняется ростом кристаллов из различных атомов (полимерных) групп. Термодинамическая теория Ягодзинского объясняет природу политипизма эффектами колебательной энтропии. Шнир, основываясь на известных данных об энергетических различиях между политипами, рассматривал политипные превращения как переходы второго рода. Пайбст связал политипообразование с тепловыми колебаниями в структуре растущего кристалла, а Книппенберг, обратив внимание на различие в ширине запрещенной зоны в политипах SiC, сделал вывод об определяющей роли в политипообразовании энергии электронов. Болес детально отмеченные теории политипизма изложены в работе [8].
Позднее в попытках объяснения политипизма в SiC определяющая роль отводилась структурным дефектам упаковки, генерируемым в процессе периодичного скольжения и переползания дислокаций [75], или возникающих в месте контактирования слоев политипов, растущих на границах двойников SiC — фазы [145]. Прямое доказательство этому было получено в работе [ 178] при определении перехода SiC -" 6Н в кристаллах методом электронной микроскопии.
Для политипа 6Н — SiC имеются противоречивые данные о величине энергии дефекта упаковки, составляющей 1,9 ± 0,25 мДж-м'2 [168], 13,0 [115], 45 — 65 [34] и 72 ± 34 мДж-м 2 [50] при 20 °C. По данным [58] при повышении температуры от 1100 °C до 2000 °C энергия дефектов упаковки фазы 6Н — SiC несколько увеличивается.
По данным [42] политипным превращениям при легировании кристаллов 6Н — SiC бором или алюминием предшествует появление высокой концентрации базисных дефектов упаковки.
Авторы [46] установили взаимосвязь между вероятностью образования дефектов упаковки (а) и их энергией образования (у):

где G — модуль сдвига; b — вектор Бюргерса; h — межплоскостное расстояние; р — плотность дислокациий.
В работе [74] указывается, что политипы в SiC могут формироваться в результате мартенситных превращений, хотя экспериментального подтверждения этому не было дано. Автором [72] предложено рассматривать гексагональные политипы SiC как сдвойникованную ЗС — фазу с различной концентрацией двойников, где двойниковые швы представляют собой прослойки 2Н — SiC. Отсюда все политипы, исключая 2Н, можно рассматривать как фазы, отличающиеся количеством ЗС SiC. Известно, что содержание ЗС — SiC в разных политипах меняется от 50 до 75%. Рамсделл [157] также предполагал, что формирование многослойных политипов происходит на основе базовых структур 6Н и 15R путем нарушения в них периодичности упаковки. Подтверждением этому могут служить результаты работы [106], свидетельствующие о том, что политип 126R состоит из блоков ромбоэдрических политипов более низкой слойности — 33R, 32R и 48R, которые, в свою очередь, сформированы на базе ячеек 6Н, 15R и 12R. Доказано также, что политип 201R образован на основе ячеек 6Н, I5R и 8Н [156].
Далее рассмотрим различные модели политипных структур. В частности, модельное описание образования политипных структур Изинга (модель ANNNT) [98], основанное на решающей роли в политипобразовании обменного взаимодействия между первыми и последующими структурными единицами как базисными элементами кристаллических решеток твердых тел, позднее было заменено моделью дальнодействующего взаимодействия между слоями, которое контролируется фононной энергией решетки [97]. При этом все политипы могут быть образованы различной упаковкой двухатомных SiC — слоев в направлении [81] модификации ЗС.
Особую роль в политипных превращениях в кристаллах SiC (особенно в условиях их легирования) играют точечные дефекты. Как уже было показано в большинстве случаев происходит превращение ЗС -> 6Н. В исходной ЗС — структуре наблюдается избыток кремния (табл. 1.1) и соответственно углеродных вакансий. Вместе с тем примеси могут растворяться в решетке SiC с образованием вакансий. Например, при растворении В, Al, N в SiC происходит гетеровалентное замещение и при этом зарядовая компенсация в решетке может обеспечиваться за счет образования вакансий в одной из подрешеток SiC [79], на основе которых неизбежно формирование комплексов [53, 38].
Установлено, что вакансии как составляющие структуры SiC участвуют в политипообразовании. Показано [42], что превращение 6Н.
—> 4H в присутствии бора и алюминия проходит в ограниченной базисными плоскостями прослойке, которая обогащена растворенной примесью. Другими словами, процесс можно рассматривать с позиций нестехиометрии SiC, т. е. как превращение в твердом растворе. Авторами [42] отмечены особенности превращений ЗС -> 6Н и SiC -" 6Н —> 4Н и в поликристаллических SiC — материалах, заключающиеся в том, что переходы осуществляются не только внутри, но и между зернами на этапе рекрисгаллизационного укрупнения зерен.
На рис. 1.5 приведены схемы изменения микроструктуры SiC — материалов, полученных в условиях приведенных политипных переходов. Видно, что в процессе собирательной рекристаллизации в зависимости от структуры растущего зерна могут идти не только прямые, но и обратные (6Н —> SiC и 4Н —> 6Н) переходы диффузионного типа. Наблюдаемая при этом эволюция микроструктурного развития SiC — материала детально обсуждается в работах [40, 41], где указывается на возможность формирования самоармированных материалов [40].
![Схемы изменения микроструктуры SiC - материалов, полученных в условиях межзеренных политипных переходов, развиваемых внутри зерен SiC и между ними на этапе их рекристаплизационного укрупнения [42].](/img/s/8/34/1394234_9.png)
Рис. 1.5. Схемы изменения микроструктуры SiC — материалов, полученных в условиях межзеренных политипных переходов, развиваемых внутри зерен SiC и между ними на этапе их рекристаплизационного укрупнения [42].
Известно, что различные политипы SiC, 6Н, 4Н, 15Н, 8Н, ЮН и другие отличаются такими свойствами, как ширина запрещенной зоны, эффективная масса свободных электронов, электропроводность, люминесценция, холловская подвижность электронов, энергия фотонов, энергия ионизации, минимум зоны проводимости, диэлектрическая проницаемость [8, 74, 29, 166, 17, 15, 67, 174, 68,70]. Такое различие в свойствах политипов SiC позволяет рассматривать их как семейство широкозонных полупроводниковых материалов. Однако к настоящему времени ввиду трудности выращивания кристаллов заданного политипного состава в качестве полупроводникового материала используется только политип 6НSiC [38, 174].