Синтез белка в клетке

Сигналом инициации трансляции у прои эукариот служит кодон АУГ, если он расположен в начале мРНК. В этом случае его «узнает» специализированная инициирующая формилметиониновая (у бактерий) или метиониновая (у эукариот) тРНК. В остальных случаях кодон АУГ «читается» как метиониновый (см. табл. 5.4.). Сигналом инициации может также служить кодон ГУГ. Это взаимодействие происходит на рибосоме… Читать ещё >
Синтез белка в клетке (реферат, курсовая, диплом, контрольная)
Воспроизведение и действие генов связаны с матричными процессами — синтезом макромолекул: ДНК, РНК, белков. Выше уже рассматривалась репликация как процесс, обеспечивающий воспроизведение генетической информации. Современная теория гена — достижение молекулярной генетики — всецело опирается на успехи биохимии в изучении матричных процессов. И напротив, метод генетического анализа вносит существенный вклад в изучение матричных процессов, которые сами находятся под генетическим контролем. Действие гена обеспечивает транскрипцию, или синтез РНК, и трансляцию, или синтез белка (рис. 5.23).
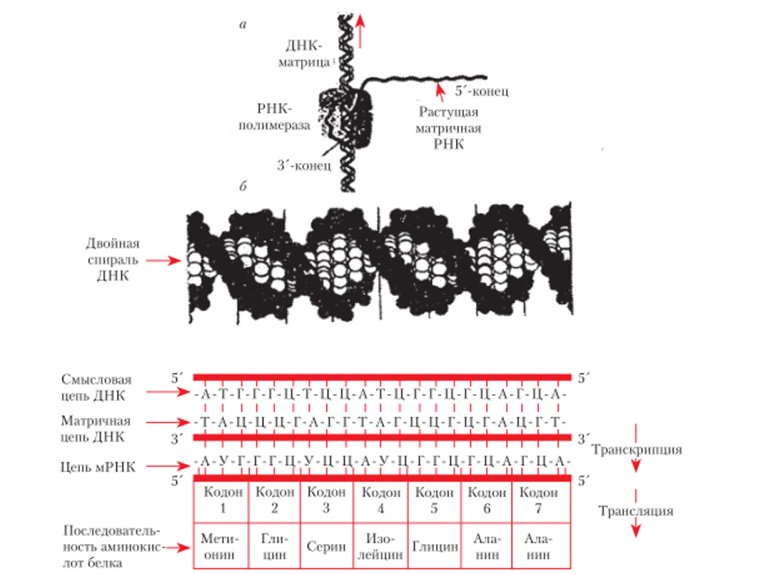
Рис. 5.23. Схема процесса транскрипции ДНК РНК-полимеразой и трансляции: а — общая схема транскрипции. Стрелка показывает направление, в котором ДНК-матрица движется через молекулу РНК-полимеразы; б — два этапа: транскрипция и трансляция Процесс синтеза белка начинается с транскрипции ДНК (как рассматривалось выше). Следующий процесс — трансляция мРНК.
Трансляция мРНК — это синтез белка на рибосомах, направляемый матрицей мРНК. При этом информация переводится с четырехбуквенного алфавита нуклеиновых кислот на двадцатибуквенный алфавит аминокислотных последовательностей полипептидных цепей.
В этом процессе различают три стадии:
- 1. Активация свободных аминокислот — образование аминоациладенилатов в результате взаимодействия аминокислот с АТФ под контролем ферментов, специфичных для каждой аминокислоты. Эти ферменты — аминоацил-тРНК-синтетазы — участвуют и в следующей стадии.
- 2. Аминоацилирование тРНК — присоединение аминокислотных остатков к тРНК путем взаимодействия тРНК и комплекса аминоацил-тРНКсинтетазы с аминоациладенилатами. При этом каждый аминокислотный остаток присоединяется к своему специфическому классу тРНК.
- 3. Собственно трансляция, или полимеризация аминокислотных остатков с образованием пептидных связей.
Таким образом, при трансляции последовательность расположения нуклеотидов в мРНК переводится в соответствующую, строго упорядоченную последовательность расположения аминокислот в молекуле синтезируемого белка.
Сигналом инициации трансляции у прои эукариот служит кодон АУГ, если он расположен в начале мРНК. В этом случае его «узнает» специализированная инициирующая формилметиониновая (у бактерий) или метиониновая (у эукариот) тРНК. В остальных случаях кодон АУГ «читается» как метиониновый (см. табл. 5.4.). Сигналом инициации может также служить кодон ГУГ. Это взаимодействие происходит на рибосоме в ее аминоацильном центре (^-центре), располагающемся преимущественно на малой субъединице рибосомы.
Взаимодействие кодона АУГ информационной РНК, малой субъединицы рибосомы и формилметионил-тРНК образует комплекс инициации. Суть этого взаимодействия заключается в том, что к кодону АУГ на мРНК присоединяется своим антикодоном УАЦ тРНК, захватившая и несущая молекулу аминокислоты метионина (у бактерий инициаторной является тРНК, которая переносит формилметионин). Затем к этому комплексу, состоящему из малой субъединицы рибосомы (305), мРНК и тРНК, присоединяется большая субъединица рибосомы (505). В результате образуется полностью собранная рибосома, включающая одну молекулу мРНК и инициаторную тРНК с аминокислотой. В рибосоме имеются аминоацильный и пептидильный центры.
Первая аминокислота (метионин) сначала попадает в аминоацильный центр. В процессе присоединения большей субъединицы рибосомы мРНК продвигается на один кодон, тРНК из аминоацильного центра перемещается в пептидильный центр. В аминоацильный центр поступает следующий кодон мРНК, который может соединиться с антикодоном следующей аминоацил-тРНК. С этого момента начинается вторая стадия трансляции — элонгация, в ходе которой многократно повторяется цикл присоединения молекул аминокислот к растущей полипептидной цепи. Так, в аминоацильный центр рибосомы поступает в соответствии с кодоном информационной РНК вторая молекула тРНК, несущая очередную аминокислоту. Эта тРНК своим антикодоном соединяется с комплементарным кодоном мРНК. Сразу же при помощи пептидилтрансферазы предшествующая аминокислота (метионин) соединяется своей карбоксильной группой (СООН) с аминогруппой (NH2) вновь доставленной аминокислоты. Между ними образуется пептидная связь (-CO-NH-). При этом выделяется молекула воды:
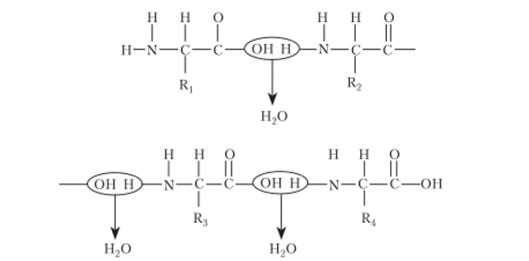
В результате тРНК, доставившая метионин, освобождается, а в аминоацильном центре к тРНК оказывается присоединенным уже дипептид. Для дальнейшего осуществления процесса элонгации должен быть освобожден аминоацильный центр, что и происходит.
В результате процесса трансляции комплекс дипсптндил-тРНК продвигается из аминоацильного центра в пептидильный. Это происходит благодаря перемещению рибосомы на один кодон при участии фермента транслоказы и белкового фактора элонгации. Освободившаяся тРНК и кодон мРНК, который был связан с ней, выходят из рибосомы. Следующая тРНК доставляет в освободившийся аминоацильный центр аминокислоту в соответствии с поступившим туда кодоном. Эта аминокислота при помощи пептидной связи соединяется с предыдущей. При этом рибосома продвигается еще на один кодон, и процесс повторяется до тех пор, пока в аминоацильный центр нс поступит один из трех терминирующих кодонов (нонсенс-кодонов), т. е. УАА, УАГ или УГА.
После поступления в аминоацильный центр рибосомы терминирующего кодона наступает третий этап синтеза полипептида — терминация. Она начинается с присоединения к терминирующему кодону мРНК одного из белковых факторов терминации, что приводит к блокированию дальнейшей элонгации цепи. Терминация синтеза приводит к освобождению синтезированной полипептидной цепи и субъединиц рибосомы, которые затем диссоциируют и могут принять участие в синтезе следующей полипептидной цепи.
Весь процесс трансляции сопровождается расщеплением молекул ГТФ (гуанозинтрифосфата), причем необходимо участие дополнительных белковых факторов, специфичных для процессов инициации (факторов инициации), элонгации (факторов элонгации) и терминации (факторов терминации). Эти белки не являются интегральной частью рибосомы, а присоединяются к ней на определенных этапах трансляции. В общих чертах процесс трансляции одинаков у всех организмов.
Образующиеся при синтезе белка полипептидные цепи претерпевают постгрансляционные преобразования и в дальнейшем выполняют свои специфические функции. Первичная структура полипептида определяется последовательностью расположения в нем аминокислот. Полипептидные цепи самопроизвольно формируют определенную вторичную структуру, которая определяется природой боковых групп аминокислотных остатков (а-спираль, складчатый P-слой, случайный клубок). Все эти и другие структурные особенности определяют некоторую фиксированную трехмерную конфигурацию, которую называют третичной (или пространственной) структурой полипептида, отражающей способ укладки данной полипептидной цепи в трехмерном пространстве.
Белки могут состоять из одной или нескольких полипептидных цепей. Во втором случае их называют олигомерными белками. Для них характерна определенная четвертичная структура. Под этим термином подразумевают общую конфигурацию белка, возникшую при ассоциации всех входящих в ее состав полипептидных цепей. В частности, структурная модель человеческого гемоглобина включает в себя две a-цепи и две P-цепи, которые связаны между собой и образуют четвертичную белковую структуру.
Точность полипептидного синтеза зависит от правильности образования системы водородных связей между кодонами и антикодонами. До замыкания очередной пептидной связи с помощью рибосом осуществляется проверка правильности образования пары кодон-антикодон. Прямое свидетельство в пользу активной роли рибосом в контроле комплементарности кодон-антикодоновой связи — обнаружение мутаций, изменяющих рибосомные белки и таким образом влияющих на точность трансляции.