Плазмиды бактерий.
Генетика в 2 ч. Часть 1

В зависимости от контролируемых ими функций /гд-гены плазмиды F классифицируют на несколько групп. Гены одной из этих групп кодируют белки, необходимые для синтеза на поверхности клеток Е. coli, содержащих плазмиду, специфических нитевидных структур (ворсинок), получивших название F-пилей (от англ. рШ — фимбрии), или «половых» пилей, в количестве 1−3 на одну клетку. Такие структуры могут быть… Читать ещё >
Плазмиды бактерий. Генетика в 2 ч. Часть 1 (реферат, курсовая, диплом, контрольная)
Плазмиды представляют собой экстрахромосомные генетические элементы (кольцевые молекулы ДНК), которые в бактериальных клетках физически обособлены от хромосомы и способны долго поддерживаться и воспроизводиться в такой форме. По размерам двухцепочечные молекулы плазмидных ДНК близки к генетическому материалу соответствующих вирусов, и их длина обычно колеблется от 0,5 до 100 мкм (молярная масса 1−200 МД).
Подобно вирусам некоторые плазмиды могут интегрироваться в бактериальную хромосому с помощью механизма сайт-специфической рекомбинации и длительное время существовать как составная часть ее структуры. При выходе из состава хромосомы под влиянием тех или иных индуцирующих агентов, как и дтя вирусов, возможно правильное либо неправильное «вырезание» плазмиды. В ином случае в хромосоме остаются фрагменты гшазмидного генома, а плазмида приобретает участки ДНК (отдельные гены) бактериальной хромосомы. Вместе с тем в отличие от вирусов плазмиды не способны разрушать клетки, в которых они находятся, т. е. у них нет литического варианта развития.
Плазмиды, имеющие значительные молекулярные размеры (более 10 мкм длиной), обнаруживаются в бактериальных клетках в небольшом количестве (1−3 копии на хромосому), поэтому их называют малокопийны. ми плазмидами. С другой стороны, самостоятельная (автономная) репликация мелких плазмид (0,5−10 мкм) подвержена менее строгому контролю со стороны хромосомной генетической системы клетки, и их число может достигать нескольких десятков копий на хромосому, т. е. они являются многокопийными. Небольшие многокопийные плазмиды представляют собой удобный объект для генетической инженерии, и их часто используют в качестве векторов при клонировании генетического материала различных организмов.
Как и ДНК бактериальной хромосомы, плазмиды находятся в клетке в компактной суперспирализованной форме, линейные размеры которой значительно меньше первичных размеров составляющей ее плазмидной ДНК. Подобно хромосомной ДНК, при ферментативной обработке препарата плазмидной ДНК, выделенной из бактерий, могут быть получены открытые кольцевые варианты этих молекул, которые очень удобны для их изучения и определения линейных размеров.
Генетическая организация плазмид наиболее полно была исследована на примере полового фактора F (фактора фертильности, фактора переноса), который оказался первой из идентифицированных плазмид и был обнаружен в клетках штамма Е. coli К12. В настоящее время имеются сведения о локализации в составе плазмиды F более 60 различных генов, в том числе ответственных за ее автономную репликацию в клетке (генов гер), способность обеспечивать перенос генетического материала в процессе конъюгации бактерий (генов tra), несовместимость с другими плазмидами (генов inc) и др.
В структуре плазмиды F, представляющей собой кольцевую молекулу ДНК величиной 100 тыс. пар нуклеотидов (100 т.п.н.), имеются три генетические области репликации (Rep FIA, Rep FIB, Rep FIC) (рис. 5.36). Однако область Rep FIC инактивирована вставкой транспозона (Тп 1000). В составе этой плазмиды постоянно находятся также инсерционная последовательность IS2 и две последовательности /S3.
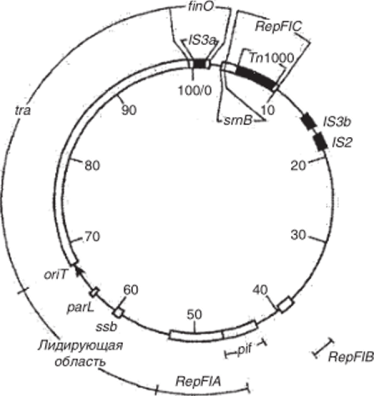
Рис. 5.36. Генетическая карта плазмиды F.
Одно из основных свойств плазмиды F заключается в том, что она обеспечивает содержащим ее бактериальным клеткам способность быть донорами генетического материала (конъюгативность), т. е. возможность вступать в конъюгацию с бесплазмидными (реципиентными) клетками и передавать им свою генетическую информацию. Это свойство указанной плазмиды и других конъюгативных (трансмиссивных) плазмид детерминируется находящейся в их составе генетической областью tra (от англ, transfer — перенос), включающей более 20 rra-генов. В структуре плазмиды F /гд-область занимает непрерывный сегмент ДНК протяженностью 33,3 т.п.н., который начинается в точке 66,7 т.п.н. и заканчивается в точке 100 т.п.н., т. е. на физико-генетической карте этой плазмиды имеет координаты 66,7−100 F (pnc. 5.36).
В зависимости от контролируемых ими функций /гд-гены плазмиды F классифицируют на несколько групп. Гены одной из этих групп кодируют белки, необходимые для синтеза на поверхности клеток Е. coli, содержащих плазмиду, специфических нитевидных структур (ворсинок), получивших название F-пилей (от англ. рШ — фимбрии), или «половых» пилей, в количестве 1−3 на одну клетку. Такие структуры могут быть легко дифференцированы на основании их способности адсорбировать «половые» бактериофаги, которые могут лизировать лишь клетки, являющиеся хозяевами соответствующих конъюгативных плазмид (рис. 5.37). Роль «половых» пилей состоит в том, что они обеспечивают формирование первичного конъюгационного контакта клетки-донора с реципиентной клеткой.
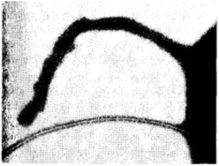
Рис. 5.37. Электронная микрофотография «половой» пили бактерии с адсорбированными бактериофагами.
Дальнейшее сокращение пилей приводит к сближению конъюгирующих клеток и образованию поверхностного контакта между ними (конъюгационного «мостика»), который необходим для одностороннего переноса генетического материала от донора к реципиенту (рис. 5.38).

Рис. 5.38. Электронная микрофотография двух конъюгирующих бакгерий.
Другие гены Ггд-области детерминируют синтез белков, обеспечивающих метаболизм самого процесса конъюгации бактерий и переноса ДНК. К их числу относятся ферменты (эндонуклеазы), которые «разрезают» кольцевую молекулу плазмидной ДНК, превращая ее в линейную структуру, что является обязательным условием для переноса такой молекулы из клетки-донора в реципиентную клетку.
Помимо плазмиды F и ряда других плазмид, относимых к категории «чистых» факторов переноса (половых факторов), в клетках бактерий различных видов были обнаружены конъюгативные плазмиды, представляющие собой комбинированные (коинтегративные) структуры, в которых лишь одна часть является фактором переноса, а другая состоит из генов, имеющих хромосомное происхождение. Многие из таких плазмид способны повышать выживаемость содержащих их бактерий в неблагоприятных условиях. Исключительно широкое распространение в современных популяциях бактерий получили плазмиды лекарственной резистентности (R— плазмиды), которые детерминируют устойчивость этих организмов к антибиотикам, сульфонамидам и другим антимикробным лекарственным веществам. Наличие в составе такой плазмиды генов устойчивости к одному либо одновременно к нескольким различным антибактериальным препаратам значительно затрудняет (а иногда делает невозможным) рациональное лечение инфекционных заболеваний человека и животных.
В широком плане к плазмидам резистентности относят также те из них, которые обеспечивают бактериям устойчивость к ионизирующим излучениям, солям тяжелых металлов, бактериофагам, бакгериоцинам, сыворотке крови и некоторым другим факторам.
Некоторые плазмиды могут участвовать в контроле патогенных свойств бактерий, оказывая влияние на возникновение и течение инфекционного процесса. Известно, что патогенность представляет собой комплексный (полигенный) признак, основанный на биохимических механизмах, с помощью которых бактерии могут вызывать заболевание. Одним из важных атрибутов патогенности является способность бактерий прикрепляться к поверхности эукариотических клеток после проникновения в организм, т. е. осуществлять колонизацию этих клеток.
При изучении штаммов Е. coli> выделенных от животных и людей, страдающих кишечными расстройствами (диареей), были обнаружены различные белки (антигены колонизации), формирующие на поверхности бактериальной клетки короткие нитевидные выросты, названные обычными пилями (фимбриями). Такие фимбрии обеспечивают специфическое прикрепление (адгезию) бактерии к эпителиальным клеткам слизистой оболочки кишечника. Наряду с хромосомными детерминантами антигенов колонизации у этих бактерий выявлены также плазмиды, кодирующие синтез адгезивных фимбрий. Так, в клетках Е. coli, вызывающих диарею новорожденных поросят, обнаружены плазмиды, детерминирующие синтез антигена АГ88, связанного с фимбриями колонизации эпителия тонкого кишечника этих животных. Плазмида, кодирующая антиген колонизации К99, была идентифицирована у бактерий этого вида, выделенных от теленка. Плазмиды, обеспечивающие синтез антигенов CFAI и CFAU (от англ, colonization factor antigen — антигенфактора колонизации), обнаружены в клетках энтеропатогенных К coli, выделенных из кишечника людей с острой диареей. Эти антигены связаны с адгезивными фимбриями, необходимыми для колонизации эпителия слизистых оболочек человека.
Друлш важнейшим фактором патогенности бактерий является их способность продуцировать токсины. Клетки патогенных штаммов Е. coli и других кишечных бактерий (энтеробактерий) могут синтезировать энтеротоксины как под контролем хромосомных генов, так и под генетическим контролем плазмид, называемых Ялг-плазмидами. Такие плазмиды были обнаружены у токсигенных бактерий, выделенных от животных и людей, страдающих диареей. Имеются экспериментальные данные, которые показывают, что включение плазмидного комплекса, состоящего из двух плазмид (Ent + К88), в клетки непатогенного штамма Е. coli, выделенного от здоровых поросят, превращает эти бактерии в энтеропатогенные, что проявляется в их способности вызывать тяжелые формы диареи у зараженных животных. В то же время заражение поросят аналогичными бактериями, содержащими лишь одну из этих плазмид (Я88 либо Ent), не приводило к развитию заболевания либо сопровождалось проявлением легких форм диареи.
Особую категорию внеклеточных токсических белков представляют собой гемолизины, синтезируемые различными бактериями и способные разрушать мембраны эритроцитов животных и человека. Гемолитическая активность бактерий, наиболее изученная у клеток ?. coli, может контролироваться как хромосомными генами hly, так и плазмидами (Я7у-плазмидами). В настоящее время такие плазмиды известны у многих штаммов этих бактерий, выделенных из кишечника животных и человека.
Многочисленные экспериментальные данные свидетельствуют о возможности эффективного переноса различных конъюгативных коинтегративных плазмид (R, Ent, Hly, CFA и др.) из клеток-доноров в реципиентные клетки как в рамках одного вида, так и между бактериями разной видовой принадлежности при их совместном культивировании. Следовательно, возможен как внутривидовой, так и межвидовой (межродовой) конъюгационный перенос бактериальных плазмид. Во время конъюгационного переноса происходит репликация плазмидной ДНК, в результате которой одна копия плазмиды передается реципиенту, а другая остается в клетке-до норе.
Следует отметить, что помимо большого числа конъюгативных плазмид в клетках разных бактерий выявлены также неконъюгативные (нетрансмиссивные) плазмиды (R, Ent, Hly и др.). Считают, что неконъюгативные плазмиды естественного происхождения лишены фактора переноса (генетической области tra) либо этот фактор дефектен по своей основной функции, поэтому они не способны обеспечивать бактериям свойства доноров генетического материала и не могут самостоятельно передаваться от одних клеток к другим. Однако их конъюгационный перенос обеспечивается «чистыми» факторами переноса либо конъюгативными коинтегратииными плазмидами, находящимися вместе с ними в одной и той же бактериальной клетке. Плазмида F и некоторые другие конъюгативные плазмиды помимо собственного переноса способны также мобилизовать на перенос хромосомные гены клеток, в которых они находятся, если происходит интеграция такой плазмиды в структуру бактериальной хромосомы.
Таким образом, необходимо отметить, что имеется значительный прогресс в изучении действия плазмид и их влияния на патогенность бактерий. Лекарственная резистентность бактерий в основном определяется плазмидами, которые относительно быстро копируются и распространяются в различных бактериальных сообществах в условиях селективного действия соответствующих антибактериальных препаратов. Хотя в кодировании резистентности участвуют и хромосомные гены бактерий, их вклад гораздо менее значителен, поскольку эффективность конъюгационной передачи таких генов от одних бактерий к другим существенно ниже, чем в случае генов /?-плазмид.