Периодический закон и Периодическая система химических элементов

Периодичность — это повторяемость химических и некоторых физических свойств у простых веществ и их соединений при изменении порядкового номера элементов. Она связана в первую очередь с повторяемостью электронного строения внешних электронных уровней, определяющих свойства элемента (табл. 2.5, см. далее). Химическая периодичность проявляется в аналогии химического поведения, однотипности… Читать ещё >
Периодический закон и Периодическая система химических элементов (реферат, курсовая, диплом, контрольная)
В 1869 г. Д. И. Менделеев опубликовал предложенный им Периодический закон, в соответствии с которым «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных телу стоят в периодической зависимости от их атомного веса {атомной массы)». Основные выводы из этого закона сводились к следующим.
- • Элементы, расположенные по возрастанию их атомного веса, представляют явственную периодичность их свойств.
- • Сходные, но свойствам элементы имеют или близкие (Os, Ir, Pt), или последовательно и однообразно увеличивающиеся (К, Rb, Cs) атомные веса.
- • Сопоставление элементов или их групп по величине атомного веса отвечает их так называемой валентности.
- • Элементы с малыми атомными весами имеют наиболее резко выраженные свойства, поэтому они являются типическими элементами.
- • Величина атомного веса элемента может быть иногда исправлена, если знать аналоги данного элемента.
- • Следует ожидать открытия еще многих неизвестных элементов, например сходных с Л1 или Si, с атомными весами 65 и 75.
В соответствии с современной формулировкой Периодического зако;
(c)на свойства химических элементов, а также формы и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда их ядер.
Графическим отображением Периодического закона является Периодическая система (таблица) химических элементов, разделенная на периоды и группы. Ее короткая форма (табл. 2.2) наиболее полно отражает периодичность химических свойств элементов, а также характерные для них валентности и степени окисления.
Элементы, расположенные по возрастанию их порядковых номеров, образуют семь горизонтальных периодов.
Периоды — горизонтальные ряды элементов в Периодической системе, начинающиеся со щелочного металла (первый период — с водорода) и заканчивающиеся инертным газом. Номер периода соответствует числу энергетических уровней, на которых располагаются электроны в атоме. Первые Короткая форма Периодической системы химических элементов.
Таблица 2.2
Период. | Ряд. | ГРУППЫ ЭЛЕМЕНТОВ. | |||||||||||
I. | II. | III. | IV. | V. | VI. | VII. | VIII. | ||||||
I. | (Н). | Н. АА 1.797 Водород. | Не 2 4.0028. Гелий. | Обозначение Атомный элемента номер _L. | |||||||||
II. | Т i 3 " в.939 Литий. | Be 4 UC 9.0122 Бериллий. | В 5 " 10.811. Бор | Г 8 ^ 12.1 115 Углерод. | N 7 А^ 14.0087 Азот. | О 8 W 15.9994 Кислород. | F 9. А 18.9984 Фтор | Ne 10 20.179. Неон. | Li 0.03? Литий. | ||||
III. | N о и. 22.9898. Натрий. | Mg 12 АТАЬ 24.305 Магний. | А1 13 'ГАА 28.9815 Алюминий. | Si 14 28.086. Кремний. | р 15. А 30.9738 Фосфор | S 16 ^ 32.084 Сера. | Г1 17 35.453. Хлор | Аг *8 , ГАА 39.948 Аргон. | Относительная атомная масса. | ||||
IV. | К 19 жж 39.102 Калий. | Гя 20 Кальций. |
Скандий. |
|
|
|
|
|
Кобальт. |
| |||
Меда. |
Цинк. | Гто 31. 89.72. Галлий. | Ge 32 72.59. Германий. | Ас 33. 74.9218. Мышьяк. | Se 34 78.98. Селей. | Вг 35 " А 79.904 Бром. | Кг 36 AVA 83.80 Криптон. | ||||||
V. | Rb 37 IVU 85.47 Рубидий. | Sr 38 ^А 87.82 Стронций. |
|
|
Ниобий. |
|
| 101,07 RU Рутений. | to5, 00, Rb. Родий. |
| |||
Серебро. |
Кадмий. | In 49 411 114.82 Индий. | Sn 50 ^АА 118.89 Олово. | Sb Itl". Сурьма. | Те 52 С 127.80 Теллур | Т 53. ж 128.9044 Иод. | Хе 54 С 131.30 Ксенон. | ||||||
VI. |
Цезий. | Вя 36 137.34. Барий. | 57 Т 138.91. Лантан. |
|
|
Вольфрам. | 75 Re 188.2. Рений. |
Осмий. |
|
| |||
Золото. |
| Т1 81 * 204.37 Таллий. | РЬ 82. А w 207.19 Свинец. | Bi 83 208.980. Висмут. | Ро 84 А V (210)*. Полоний. | At 85 (210). Астат. | Rn 86 AVIA (222). Радон. | ||||||
VII. | Fr 87 А 4 (223| Франций. | Вя 88 IVa (226) Радий. | в9 А р*+ (227). Актиний. |
|
|
| 107 Bh (282) 4411 Борий. |
| .VS. ш Мейтнерий. | ||||
Л. |
Церий. |
Празеодим. | во Ncl. 144.24. Неодим. |
| Самарий. |
Европий. |
Гадолиний. |
Тербий. | ев Dy 182.50 " Диспрозий. |
|
Эрбий. |
Тулий. |
Иттербий. |
Лютеций. |
If. * |
Торий. |
Протактиний. |
Уран. |
|
Плутоний. |
Америций. |
кюрий. |
Берклий. |
Калифорний. | 99 Es. Ьйниггсйиий. | 100 Fm. Фермий. |
Менделевий. |
Нобелий. |
|
три периода называют малыми, гак как они содержат небольшое число элементов: первый период два 5-элемента — водород и гелий, второй и третий по 8 элементов (по 2 5-элемента и по 6 p-элементов). Последующие периоды называют большими (часто их делят на ряды — четные и нечетные). Четвертый и пятый периоды содержат по 18 элементов (по 2 5-элемента, по 6р-элементов и по 10 ^/-элементов). Шестой период включает в себя 32 элемента (2 5-элемента, 6 р-элементов, 10 d-элементов и 14 /-элементов). Седьмой период не завершен. В отдельные ряды выделяют /-элементы, называемые лантанидами {лантаноидами) и актинидами {актиноидами). Число элементов в периоде вычисляется по формуле {п + 1)2/2 для нечетных периодов и {п + 2)2/2 — для четных, где п равно номеру периода.
Два семейства элементов, лантаноиды1 (от церия до лютеция) и актиноиды (от тория до лоуренсия), располагаются за пределами основной таблицы. Из-за схожести химических свойств все эти элементы принято условно помещать в клетки, занимаемые, соответственно, лантаном и актинием.
Группа — вертикальный столбец в Периодической таблице, их восемь. В короткопериодном варианте Периодической таблицы они традиционно обозначаются римскими цифрами (от I до VIII). Каждая группа делится на две подгруппы — главную и побочную (А и Б). Деление групп на подгруппы объясняется различием электронных конфигураций атомов составляющих их элементов. У элементов одной подгруппы строение внешнего энергетического уровня всегда одинаково. Исключением являются лишь некоторые d-элементы, у которых наблюдаются так называемые провалы электронов (Cr, Mo, Pd). В главные подгруппы входят элементы малых и больших периодов (5- и p-элементы). Для них номер группы соответствует числу электронов на внешнем энергетическом уровне (за исключением водорода и гелия). Побочные подгруппы содержат только элементы больших периодов (^/-элементы).
Все элементы побочных подгрупп являются металлами, их возможная высшая положительная степень окисления увеличивается слева направо и часто совпадает с номером группы. Восстановительная способность и химическая активность элементов побочных подгрупп увеличивается снизу вверх по группе (например, серебро на воздухе медленно окисляется, а золото нет; медь вытесняет серебро из его солей):
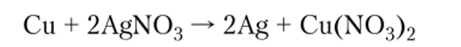
В длинной форме Периодической таблицы, рекомендуемой ИЮПАК (табл. 2.3), группы элементов нумеруются слева направо арабскими цифрами (от 1 до 18). При таком варианте размещения элементов каждый период занимает одну строку, а общая длина таблицы составляет 18 клеток (в отличие от 10 для короткой формы).
Лантаноиды и актиноиды также могут быть размещены в соответствующих периодах, что увеличивает длину таблицы до 32 клеток (так называемая сверхдлинная форма). К настоящему времени разработано несколько[1]
Стандартная периодическая таблица ИЮПАК. | ||||||||||||||||||
5-элементы. | /7-элементы. | |||||||||||||||||
Н. | ^/-элементы. | He. | ||||||||||||||||
Li. | Be. | В. | C. | N. | О. | F. | Ne. | |||||||||||
Na. | Mg. | Al. | Si. | P. | s. | Cl. | Ar. | |||||||||||
К. | Ca. | Sc. | Ti. | V. | Cr. | Mn. | Fe. | Co. | Ni. | Cu. | Zn. | Ga. | Ge. | As. | Se. | Br. | Kr. | |
Rb. | Sr. | Y. | Zr. | Nb. | Mo. | Tc. | Ru. | Rh. | Pd. | Ag. | Cd. | In. | Sn. | Sb. | Те. | I. | Xe. | |
Cs. | Ba. | *La. | Hf. | Та. | W. | Rc. | Os. | Ir. | Pt. | Au. | Hg. | Tl. | Pb. | Bi. | Po. | At. | Rn. | |
Fr. | Ra. | **Ac. | Rf. | Db. | Sg. | Bh. | Hs. | Mt. | Ds. | Rg. | ||||||||
/-элементы.
* Лантаноиды ** Актиноиды.
La. | Ce. | Pr. | Nd. | Pm. | Sm. | Eu. | Gd. | Tb. | Dv. | Ho. | Er. | Tm. | Yb. | Lu. |
Ac. | Th. | Pa. | U. | Np. | Pu. | Am. | Cm. | Bk. | Cf. | Es. | Fm. | Md. | No. | Lr. |
сотен вариантов изображения Периодической системы, каждый из которых подчеркивает те или иные проявления периодичности.
Периодичность — это повторяемость химических и некоторых физических свойств у простых веществ и их соединений при изменении порядкового номера элементов. Она связана в первую очередь с повторяемостью электронного строения внешних электронных уровней, определяющих свойства элемента (табл. 2.5, см. далее). Химическая периодичность проявляется в аналогии химического поведения, однотипности химических реакций. Периодически повторяются не только сходные черты, но и существенные различия химических свойств элементов по мере роста их порядкового номера.
Таблица 2.4
Периодическое изменение строения внешней электронной оболочки атомов элементов главных подгрупп.
Период. | IA. | IIA. | IIIA. | IVA. | VA. | VIA. | VILA. | VIIIA. |
51 | s2 | sy | s2/?2 | sV | sy | sy | s2p6 | |
H*. | He (Is2). | |||||||
Li. | Be*. | В. | C. | N. | О. | F. | Ne. | |
Na. | Mg. | Al*. | Si. | P. | s. | Cl. | Ar. | |
К. | Ca. | Ga*. | Ge*. | As. | Se. | Br. | Kr. | |
Rb. | Sr. | In. | Sn*. | Sb*. | Те*. | I. | Xe. | |
Cs. | Ba. | Tl. | Pb*. | Bi*. | Po*. | At. | Rn. | |
Fr. | Ra. |
Элементы, оксиды которых проявляют амфотерные свойства. _— металлы;_— неметаллы.
Некоторые физико-химические свойства атомов — электроотрицательность[2], энергия ионизации[3], атомный (орбитальный) радиус — могут быть не только качественно, но и количественно представлены в виде зависимостей от порядкового номера элемента, причем эти зависимости имеют четко выраженные максимумы и минимумы (рис. 2.6—2.8).
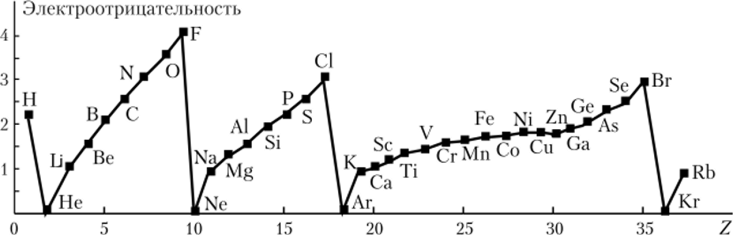
Рис. 2.6. Периодическое изменение электроотрицательности с увеличением порядкового номера элемента.
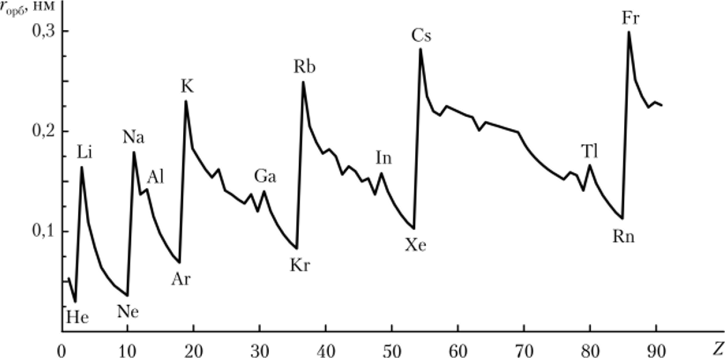
Рис. 2.7. Периодическая зависимость орбитального радиуса атома от порядкового номера элемента.
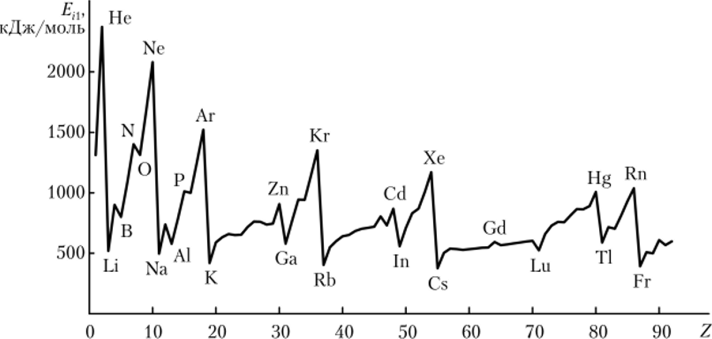
Рис. 2.8. Периодическая зависимость энергии ионизации атома от порядкового номера элемента.
В Периодической таблице химических элементов можно проследить три основные периодичности: вертикальную, горизонтальную и диагональную.
Вертикальная периодичность заключается в повторяемости свойств простых веществ и соединений в вертикальных столбцах. Это основной вид периодичности, в соответствии с которым все элементы объединены в группы и подгруппы. Химические свойства элементов обычно рассматриваются на основе этого вида периодичности. Вертикальная периодичность проявляется и в таких физических свойствах атомов, как радиус и энергия ионизации.
Горизонтальная периодичность заключается в появлении максимальных и минимальных значений свойств простых веществ и соединений в пределах каждого периода.
Диагональная периодичность — это повторяемость свойств простых веществ и соединений по диагоналям Периодической системы. Она связана с возрастанием неметаллических свойств в периодах слева направо и в группах снизу вверх. Поэтому литий похож на магний, бериллий на алюминий, бор па кремний, углерод на фосфор. Диагональную периодичность не следует понимать как абсолютное сходство свойств элементов. Однако свойства ионов Li* и Mg2+ очень близки, проявляясь, в частности, в малой растворимости их карбонатов и ортофосфатов. Бериллий и алюминий проявляют амфотерность своих оксидов и гидроксидов, бор и кремний образуют летучие, весьма реакционноспособные молекулярные гидриды.
В результате объединения вертикальной, горизонтальной и диагональной периодичности появляется так называемая звездная периодичность. Так, свойства германия напоминают свойства окружающих его галлия, кремния, мышьяка и олова. На основании таких «геохимических звезд» можно предсказать присутствие элемента в минералах и рудах.
Металлы — химические элементы, обладающие только восстановительными свойствами и образующие простые вещества, обладающие в обычных условиях характерными, металлическими свойствами', высокая теплои электропроводность, отрицательный температурный коэффициент электрической проводимости, пластичность и др.
В настоящее время важнейшим критерием отнесения элемента к ме;
® таллам является отрицательный температурный коэффициент электрической проводимости, т. е. понижение электрической проводимости с ростом температуры.
Неметаллы — химические элементы, образующие простые вещества, обладающие как окислительными, так и восстановительными свойствами, и не проявляющие типичных металлических свойств. Неметаллы занимают правый верхний угол Периодической таблицы. Неметаллы, как правило, имеют на внешнем энергетическом уровне большее число электронов и обладают большей электроотрицательностыо по сравнению с металлами.
Потенциал ионизации (/) — это энергия, которую необходимо затратить на отрыв электрона от атома. Способность атома отдавать электроны характеризует металличностъ этого элемента. Чем меньше значение /, тем сильнее выражены металлические свойства элемента.
Сродство к электрону (?ср) — это энергия, которая выделяется при присоединении одного электрона к атому. Способность атома принимать электроны характеризует неметалличностъ этого элемента. Чем больше значение ?ср, тем сильнее выражены неметаллические свойства атома.
Электроотрицательность (ЭО) — это способность атома притягивать к себе электроны других атомов. Электроотрицательность — это условная величина, для расчета которой известно несколько способов. Абсолютная электроотрицательность (по Малликену) равна полусумме первой энергии ионизации и его сродства к электрону. Более широкое распространение получила шкала относительной электроотрицательности (ОЭО, но Полингу'), в которой наиболее электроотрицательному атому фтора приписано значение, равное четырем, а атому лития — единице (табл. 2.5).
Для элементов главных подгрупп возможная высшая положительная степень окисления равна номеру группы (кроме водорода, кислорода и фтора), а низшая возможная отрицательная степень окисления равна номеру группы (-8) (за исключением водорода). Слева направо по периоду и снизу вверх по группе ослабляются металлические свойства элементов, увеличивается их электроотрицателыюсть, для неметаллов уменьшаются температуры плавления и кипения. Металлы располагаются левее диагонали, проходящей от бора к астату, а неметаллы — правее. Окислительные свойства элементов усиливаются снизу вверх и слева направо, а восстановительные в обратных направлениях. Инертные газы в химическом отношении занимают особое положение, так как имеют заполненный внешний электрон;
Таблица 2.5.
Таблица ОЭО по Полингу.
I. | II. | III. | IV. | V. | VI. | VII. | VIII. |
н. | |||||||
2,1. | |||||||
Li. | Be. | В. | c. | N. | о. | F. | |
1,0. | 1,5. | 2,0. | 2,5. | 3,0. | 3,5. | 4,0. | |
Na. | Mg. | Al. | Si. | p. | s. | Cl. | |
0,9. | 1,2. | 1,5. | 1,8. | 2,1. | 2,5. | 3,0. | |
К. | Ca. | Sc. | Ti. | V. | Cr. | Mn. | Co-Ni. |
0,8. | 1,0. | 1,3. | 1,5. | 1,6. | 1,6. | 1,5. | 1,9. |
Zn. | Ga. | Ge. | As. | Se. | Br. | ||
1,6. | 1,6. | 1,8. | 2,0. | 2,4. | 2,8. | ||
Rb. | Sr. | Y. | Zr. | Nb. | Mo. | Tc. | Ru-Rh. |
0,8. | 1,0. | 1,5. | 1,5. | i, 6. | 1,8. | 1,9. | 2,2. |
Cd. | In. | Sn. | Sb. | Те. | I. | ||
1,7. | 1,7. | 1,8. | 1,9. | 2,1. | 2,5. | ||
Cs. | Ba. | La—Lu. | Hf. | Та. | w. | Re. | Os-Pt. |
0,7. | 0,9. | 1,0−1,2. | 1,3. | 1,5. | 1,7. | 1,9. | 2,2. |
Hg. | Pb. | Bi. | Po. | At. | |||
1,9. | 1,9. | 1,9. | 2,0. | 2,2. |
1 Лайнус Карл Полинг (1901 —1994) — американский химик, кристаллограф, лауреат двух Нобелевских премий: по химии (1954) и премии мира (1962), а также Международной Ленинской премии «За укрепление мира между народами» (1970).
ный уровень. Они могут образовывать химические соединения только с очень электроотрицательными элементами, такими как фтор или кислород.
Металлы с водородом могут образовывать гидриды — соединения, в которых степень окисления водорода (-1). Обычно это твердые вещества солеобразного строения, сильные восстановители. Гидриды металлов восстанавливают водород из воды: 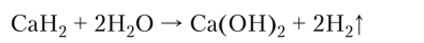
Неметаллы образуют с водородом летучие соединения формулы ЭНГ, где х = 8 — номер группы (исключение представляют гидриды бора).
Многие водородные соединения неметаллов способны проявлять кислотные свойства (отщеплять ион Н+). Эти свойства усиливаются при переходе слева направо по периоду, что объясняется увеличением полярности связи водорода с неметаллом за счет увеличения электроотрицательности последнего (например, H2S — слабая кислота; НС1 — сильная кислота) и сверху вниз по группе из-за уменьшения эффективности связывания малой орбитали атома водорода с постепенно увеличивающейся орбиталью неметалла (HF — кислота средней силы; НС1 — сильная кислота).
Водородные соединения неметаллов, в которых атом неметалла имеет неподеленную пару электронов, могут проявлять основные свойства (присоединять ион Н). Такие свойства ослабляются слева направо по периоду и сверху вниз по группе. Например, аммиак более сильное основание, чем вода. Он способен образовывать устойчивые соли практически со всеми кислотами, тогда как вода в растворах кислот обратимо превращается в ион гидроксония (Н30). Аммиак основнее фосфина, который образует устойчивые соли только с очень сильными кислотами.
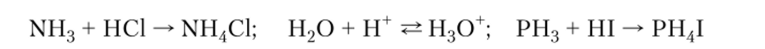
Термическая устойчивость соединений водорода со всеми элементами уменьшается сверху вниз по Периодической системе.
Восстановительные свойства водородных соединений возрастают сверху вниз по группе, например HI — очень сильный восстановитель, более сильный, чем другие галогеиоводороды.
Свойства оксидов элементов главных подгрупп вдоль периода изменяются от основных (Na20) через амфотерные (А1203) к кислотным (Р205). Аналогичная тенденция наблюдается при переходе снизу вверх по группе (MgO — основный оксид, ВеО — амфотерный; А1203 — амфотерный оксид, В203— кислотный).
Свойства гидроксидов слева направо, но периоду изменяются от щелочей (NaOH) через амфотерные гидроксиды [А1(ОН)3] к кислотам (Н3Р04). Аналогичная тенденция наблюдается при переходе снизу вверх по группе.
Сила оснований увеличивается справа налево [А1(ОН)3 — очень слабое основание; Mg (OH)2 — слабое основание; NaOH — сильное основание] и сверху вниз [Са (ОН)2 — сильное основание].
Сила кислородсодержащих кислот увеличивается слева направо по периоду (H2Si03 — слабая кислота; Н3Р04 — кислота средней силы; H2S04 — сильная кислота) и снизу вверх (H3As04 — слабая кислота; HN03 — сильная кислота).
В табл. 2.6 приведен характер изменения различных свойств атомов элементов главных подгрупп в зависимости от положения в Периодической таблице.
Таблица 2.6
Периодичность свойств атомов элементов главных подгрупп.
Свойство. | Увеличение в группах. | Увеличение в периодах. |
Радиус атома. | i. | —. |
Заряд атомного ядра. | i. | —. |
Электроотрицательность. | т. | —. |
Максимальная степень окисления. | Без изменения. | ; |
Металлические свойства. | i. | |
Неметаллические свойства. | t. | —. |
Кислотные свойства оксидов. | т. | —. |