Термохимия.
Общая и неорганическая химия для медиков и фармацевтов

Изменения энтальпии в ходе химической реакции зависят от температуры, давления и физического состояния веществ, участвующих в процессе. Величина АН зависит также от количества этих веществ. Поэтому изменение энтальпии может быть характеристической величиной лишь в случае, если ее измерение проводится при определенных условиях, называемых стандартными. Рис. 43. Экзотермическая (а… Читать ещё >
Термохимия. Общая и неорганическая химия для медиков и фармацевтов (реферат, курсовая, диплом, контрольная)
Раздел химии, занимающийся изучением тепловых эффектов, наблюдаемых при протекании химических реакций, называется термохимией.
Тепловой эффект — количество теплоты, выделяющееся или поглощающееся при протекании физико-химического процесса, если:
- а) процесс протекает при р = const или V= const;
- б) в системе совершается только работа расширения (при р = const);
- в) температура исходных веществ и продуктов реакции одинакова.
Экзотермическим называют процесс, сопровождающийся выделением теплоты, эндотермическим — процесс, сопровождающийся поглощением теплоты.
Если процесс протекает при постоянном давлении, то тепловой эффект представляет собой изменение энтальпии системы:

Если АН< 0 — это экзотермический процесс, АН > 0 — эндотермический процесс (рис. 4.3).
Если процесс не сопровождается изменением объема, тепловой эффект процесса равен изменению внутренней энергии системы AU. Если AU < 0 — экзотермический процесс, AU > 0 — эндотермический процесс.
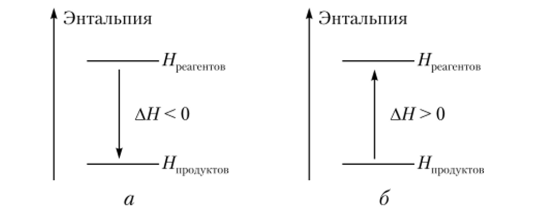
Рис. 43. Экзотермическая (а) и эндотермическая (б) реакции Термохимические уравнения реакции — уравнения реакции, в которых помимо формул исходных веществ и продуктов (с соответствующими стехиометрическими коэффициентами) указаны их агрегатные состояния и отвечающий этой реакции тепловой эффект (изменение энтальпии), например:

или Рассмотрим стандартные изменения энтальпии.
Изменения энтальпии в ходе химической реакции зависят от температуры, давления и физического состояния веществ, участвующих в процессе. Величина АН зависит также от количества этих веществ. Поэтому изменение энтальпии может быть характеристической величиной лишь в случае, если ее измерение проводится при определенных условиях, называемых стандартными.
Стандартные условия:
- • все вещества являются химически чистыми и соответствуют приводимой химической формуле;
- • твердые и жидкие вещества находятся в устойчивых для данных условий агрегатных состояниях и аллотропных модификациях;
- • количества веществ равны 1 моль или вещества в растворе содержатся в количествах 1 моль на 1000 г растворителя[1];
- • давление постоянно и равно 101,3 кПа, или 1 атм (ИЮПАК рекомендует использовать точное значение 100 кПа);
- • температура постоянна и может иметь любое значение, но обычно выбирается равной 25 °C (298 К).
Стандартная энтальпия образования (Д/Я2°98) — это тепловой эффект реакции образования 1 моль какого-либо вещества из простых веществ в стандартных условиях при 298 К. Стандартная энтальпия образования простого вещества в наиболее устойчивой аллотропной модификации равна нулю.
Пример 4.1. Стандартная энтальпия образования аммиака соответствует тепловому эффекту реакции 1,5Н2(Г) + 0,5N2(r) —* NH3® + 45,94 кДж при постоянном давлении (298 К) Л/-Я2°98 = -45,94 кДж/моль.
(c)Энтальпии образования твердых соединений, как правило, имеют большие (по абсолютной величине) отрицательные значения, по сравнению с энтальпиями образования газов.
Стандартная энтальпия сгорания (Дс#298) — это тепловой эффект реакции сгорания в избытке кислорода 1 моль вещества в его стандартном состоянии при температуре 298 К и давлении 101,3 кПа (1 атм).
Пример 4.2. Стандартная энтальпия сгорания этилового спирта соответствует тепловому эффекту реакции С2Н5ОН(ж) + 3,502(г) —*? 2С02(г) + ЗН20(ж) + + 1638 кДж при постоянном давлении (298 К) ДСЯ298 = -1638 кДж/моль.
Стандартные энтальпии образования и стандартные энтальпии сгорания различных веществ сведены в соответствующие таблицы, которые имеются в справочной литературе (см. также приложение 4).
Стандартная энтальпия реакции (Д^Я^в) — это изменение энтальпии при 298 К в стандартных условиях в расчете на количества веществ, соответствующие стехиометрическим коэффициентам.
Калориметрия — совокупность экспериментальных методов измерения тепловых эффектов, сопровождающих различные физико-химические и биологические процессы.
Калориметр — изолированный сосуд для измерения количества теплоты, высвобождаемой или поглощаемой в результате химической реакции или фазового превращения (рис. 4.4).
Суть эксперимента состоит в измерении изменения температуры реакционной смеси в результате химического или иного превращения. В некоторых случаях изменение температуры определяется в охлаждающей реак;
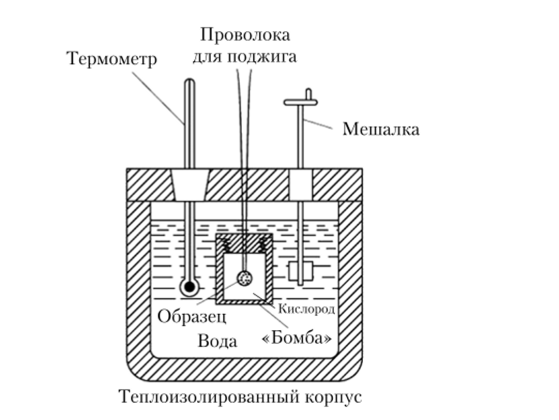
Рис. 4.4. Схема калориметра.
ционный сосуд жидкости, например воде. Калориметр представляет собой прочный закрывающийся сосуд, окруженный теплоизолирующей водяной рубашкой. Образец известной массы помещается внутри бомбы в атмосфере чистого кислорода под давлением 25 атм. Затем образец поджигают с помощью электрической искры. За счет выделяющейся при горении энергии происходит нагрев водяной рубашки. Поскольку сгорание вещества в калориметрической бомбе происходит при постоянном объеме, выделяющаяся тепловая энергия численно равна изменению внутренней энергии U (4.3).
Выделяемая в ходе эксперимента энергия может быть рассчитана по следующему уравнению: 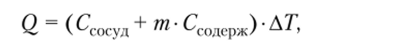
где Q — энергия, передаваемая в форме тепла сосуду и его содержимому; ССОсуД — теплоемкость сосуда; т — масса содержимого сосуда (вода или реакционная смесь); Ссодерж — удельная теплоемкость содержимого; АТ — измеренное изменение температуры содержимого сосуда.
Основной закон термохимии — закон Гесса[2] (закон постоянства сумм теплот реакции).
Энтальпии реакций, которые невозможно провести в лабораторных условиях, могут быть вычислены по известным энтальпиям других реакций.
(c)Закон Гесса: тепловой эффект реакции не зависит от пути проведения процесса, а определяется только начальным и конечным состоянием системы.
Таким образом, если какую-либо реакцию теоретически представить в виде определенного числа последовательных стадий, то изменение энтальпии реакции будет равно сумме изменений энтальпий на каждой стадии (рис. 4.5):
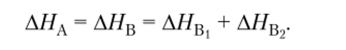 aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">
aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">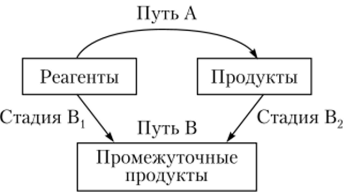
Рис. 4.5. Стадии реакции.
Несмотря на то что закон Гесса был установлен опытным путем, он непосредственно вытекает из свойств функций состояния системы: внутренняя энергия U и энтальпия Н являются функциями состояния системы, следовательно, их изменение AU и АН не зависит от пути процесса, а равно разности AU= U2 — АН = Н2— Нх между значениями U2 и Н2 в конечном состоянии и значениями Ux и Н{ в начальном состоянии системы. Следствия из закона Гесса.
1. Тепловой эффект химической реакции (Д,.Я°) равен разности между суммой теплот образования продуктов реакции (2Д/Я, ф0Д) и суммой теплот образования исходных веществ (?ДуЯреаг) с учетом их стехиометрических коэффициентов. Для теплового эффекта реакции, проводимой при постоянном давлении 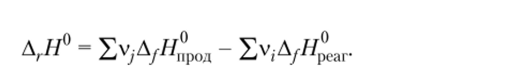
Пример 4.3. Рассчитаем тепловой эффект реакции образования мочевины (одного из важнейших продуктов жизнедеятельности организма) из аммиака и диоксида углерода:
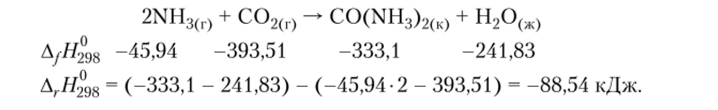
2. Тепловой эффект химической реакции (А, Я0) равен разности между суммой теплот сгорания исходных веществ (?Д Я^) и суммой теплот сгорания продуктов реакции (?АсЯпрод) с учетом их стехиометрических коэффициентов: 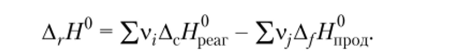
Пример 4.4. Рассчитаем тепловой эффект реакции молочнокислого брожения глюкозы, зная, что стандартные теплоты сгорания глюкозы и молочной кислоты равны -2810 и -1344 кДж/моль соответственно:
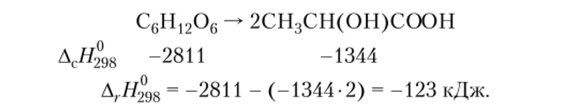
3. Тепловой эффект прямой реакции равен, но величине и противоположен по знаку тепловому эффекту обратной реакции {законЛавуазье—Лапласа).
- [1] Отношение количества растворенного вещества к массе растворителя, выраженнойв килограммах, называется молялъностъю раствора. Таким образом, стандартное состояниеотносится к одномоляльным растворам всех растворенных веществ. На практике, особенноприменительно к разбавленным водным растворам, каковыми являются физиологическиежидкости, вместо молялыюстей используют молярные концентрации. В этом случае стандартное состояние соответствует концентрациям растворенных веществ 1 моль/л.
- [2] Герман Иванович Гесс (1802—1850), русский химик, академик Петербургской Академиинаук (1834).