Соли.
Общая и неорганическая химия для медиков и фармацевтов

Некоторые соли разлагаются при нагревании. Термически относительно устойчивы галогениды, сульфиды, силикаты, сульфаты и фосфаты (за исключением солей аммония). Соли аммония обычно разлагаются на аммиак и кислоту, например. Комплексными называют соли, содержащие комплексный анион или катион, в котором валентность центрального атома-комплексообразователя превышает его степень окисления, например Na… Читать ещё >
Соли. Общая и неорганическая химия для медиков и фармацевтов (реферат, курсовая, диплом, контрольная)
Солями называют сложные вещества, состоящие из атомов металла.
(c)и кислотных остатков. С точки зрения теории электролитической диссоциации соли — электролиты, при диссоциации которых образуются катионы металлов или аммония и анионы кислотных остатков.
Среди солей различают средние, кислые, основные, двойные, смешанные и комплексные.
Средние соли можно рассматривать как продукты полного замещения атомов водорода кислоты на металл или ион аммония.
Названия солей складываются из названий катионов и анионов. Названия бескислородных анионов образуются при добавлении суффикса «-ид» к корню латинского названия элемента, например MgCl2 — хлорид магния, Na2S — сульфид натрия.
Названия анионов кислородсодержащих кислот с разной степенью окисления центрального атома, если их только две, имеют суффикс «-ат» (высокая степень окисления) или «-ит» (низкая степень окисления), например Na2S04 — сульфат натрия, Na2S03 — сульфит натрия. Если степеней окисления больше двух, то добавляются приставки «пер-» (выше высокой) или «гипо-» (ниже низкой), например NaC104 — перхлорат натрия,.
NaC103 — хлорат натрия, NaC102 — хлорит натрия, NaCIO — гипохлорит натрия.
Кислые соли можно рассматривать как продукты неполного замещения атомов водорода многоосновных кислот на металл или ион аммония. При построении их названия перед названием аниона добавляется приставка «гидро-», например NaHC03 — гидрокарбонат натрия, при этом число ионов водорода указывается префиксами «моно-», «ди-», «три-» и т. д., например NH4H2P04 — дигидрофосфат аммония.
Основные соли можно рассматривать как продукты неполного замещения на кислотные остатки гидроксильных групп многокислотных оснований. При построении их названия перед названием катиона металла добавляется приставка «гидроксо-» например MgOHCl — хлорид гидроксомагния, (Си0Н)2С03 — карбонат гидроксомеди, Fe (OH)2Cl — хлорид дигидроксожелеза (Ш).
Двойные соли содержат катионы различных металлов при одном кислотном остатке: NaCr (S04)2 — сульфат хрома натрия, NH4A1(S04)2 — сульфат алюминия аммония.
Смешанными называют соли, содержащие различные кислотные остатки при одном катионе металла, например Са (СЮ)С1 — хлорид гипохлорит кальция, или хлорная известь.
Комплексными называют соли, содержащие комплексный анион или катион, в котором валентность центрального атома-комплексообразователя превышает его степень окисления, например Na[Al (OH)4)] — тетрагидроксоалюминат натрия.
Для получения солей могут быть использованы следующие превращения.
1. Прямое взаимодействие металла с неметаллом:

2. Взаимодействие металла с кислотой:

3. Взаимодействие некоторых металлов (Be, Zn, А1) с растворами щелочей:
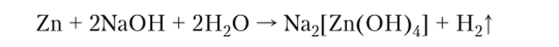
4. Вытеснение менее активного металла из соли более активным металлом:

5. Взаимодействие некоторых неметаллов с растворами щелочей:
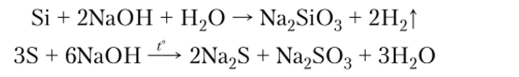
6. Взаимодействие некоторых неметаллов с солями бескислородных кислот:
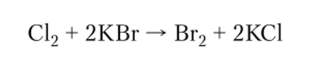
7. Взаимодействие основных или амфотерных оксидов с кислотными оксидами:
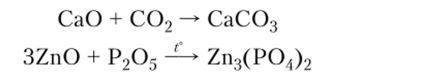
8. Взаимодействие основных оксидов с амфотерными оксидами:
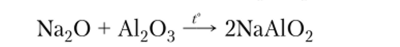
9. Взаимодействие основных или амфотерных оксидов с кислотами:

10. Взаимодействие кислотных или амфотерных оксидов с основаниями:
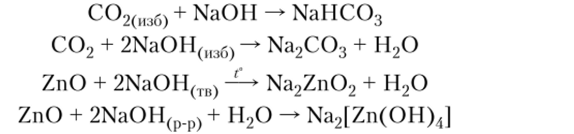
11. Взаимодействие аммиака или аминов с кислотами:

12. Взаимодействие оснований или амфотерных гидроксидов с кислотами:

13. Взаимодействие амфотерных гидроксидов с щелочами:

14. Взаимодействие кислот с солями:
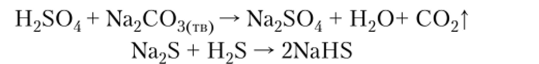
15. Взаимодействие щелочей с солями:
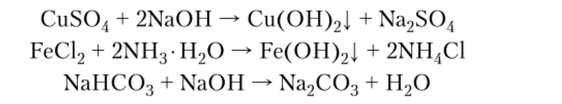
16. Взаимодействие солей между собой при условии выпадения осадка или выделения газа:
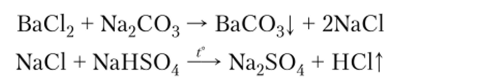
17. Термическое разложение некоторых солей.
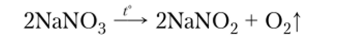
Рассмотрим химические свойства солей.
1. Практически вес соли — сильные электролиты и при растворении в воде диссоциируют на ионы:
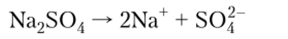
Кислые и основные соли диссоциируют ступенчато:

2. Соли вступают в реакции замещения. Более активный металл может вытеснять менее активный металл из 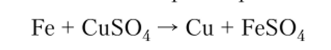 раствора его соли:
раствора его соли:
Более активный неметалл (галоген) может вытеснять менее активный неметалл из солей бескислородных кислот:
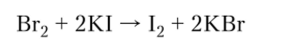
3. Многие соли с водой способны образовывать кристаллогидраты:

- 4. Соли, образованные слабыми кислотами и (или) слабыми основаниями в водных растворах подвергаются обратимому или полному гидролизу.
- 5. Кислотные и амфотерные оксиды при нагревании могут вытеснять из солей более летучие оксиды:
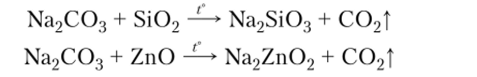
6. Основные оксиды при взаимодействии с кислыми солями могут образовывать средние соли:
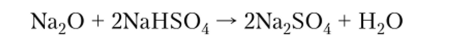
7. Кислоты могут вытеснять из солей более летучие или более слабые кислоты: 
При действии кислоты на среднюю соль может образоваться кислая соль:  [1]
[1]
9. При действии на соли аммония концентрированных растворов щелочей выделяется аммиак.

10. При взаимодействии щелочей с кислыми солями образуются средние соли: 
11. Соли могут взаимодействовать между собой, если происходит выпадение осадка, образуется слабый электролит, или выделяется газ, или реализуется сразу несколько факторов.
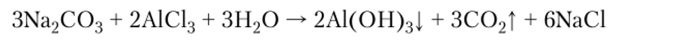
12. Некоторые соли разлагаются при нагревании. Термически относительно устойчивы галогениды, сульфиды, силикаты, сульфаты и фосфаты (за исключением солей аммония). Соли аммония обычно разлагаются на аммиак и кислоту, например
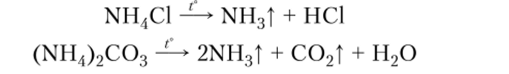
При разложении нитрата, нитрита и дихромата аммония происходят окислительно-восстановительные реакции:
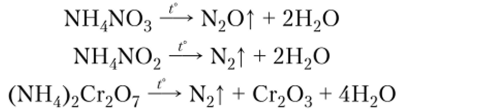
Термически неустойчивы все нитраты. Нитраты щелочных (кроме лития) металлов при нагревании разлагаются на нитриты и кислород:
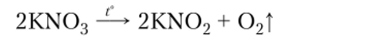
Нитраты остальных металлов, стоящих в ряду активности до меди включительно, разлагаются на оксиды, N02 и кислород:

Нитраты металлов, стоящих в ряду активности после меди, разлагаются на металл, М02 и кислород:

Гидрокарбонаты всех металлов уже при небольших температурах разлагаются на карбонат, С02 и воду:

Из карбонатов термически устойчивы лишь карбонаты щелочных металлов, остальные карбонаты при нагревании разлагаются на оксид металла и С02 (исключение составляют карбонаты металлов, стоящих в ряду активности после меди, они разлагаются на металл, С02 и кислород):

Аналогично карбонатам и гидрокарбонатам ведут себя сульфиты и гидросульфиты.
Термическим разложением иерманаганата калия или хлората калия в присутствии оксида мартанца (1У) в лаборатории получают кислород:
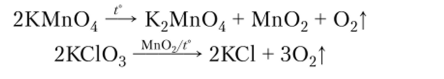
- [1] Щелочи могут осаждать из растворов солей малорастворимые или нерастворимые основания или амфотерные гидроксиды: