Стандартная молярная энтальпия образования

Определяя экспериментально теплоты сгорания пищевых продуктов и кормов для сельскохозяйственных животных, устанавливают их энергетическую ценность. При этом тепловой эффект реакции относят не к количеству вещества в молях, а к его массе в граммах. Например, энергетическая ценность 100 г сахара равна 1680 кДж. В диетологии и в науке о кормлении сельскохозяйственных животных энергетическую ценность… Читать ещё >
Стандартная молярная энтальпия образования (реферат, курсовая, диплом, контрольная)
Абсолютное значение энтальпии вычислить невозможно, можно рассчитать только относительные значения в сравнении с ее значениями в стандартном состоянии. Стандартное состояние в химической термодинамике выбирают таким, чтобы было удобно проводить необходимые в каждом конкретном случае расчеты, поэтому определение стандартного состояния может изменяться в зависимости от поставленной задачи. Для процесса образования сложного вещества из простых веществ в качестве стандартного выбрано наиболее устойчивое состояние при стандартных условиях, т. е. при давлении 101,3 кПа и заданной температуре. В справочниках чаще всего приводят стандартную молярную энтальпию образования при температуре 298,15 К, которую обозначают как Л#, 1г>Р, 298 или ЛЯ/298- В этих обозначениях верхний индекс ° — символ стандартного состояния, нижние индексы: обр. и/ — сокращения соответственно от русского слова образование и английского formation, число 298 означает температуру 298,15 К (его часто опускают).
Стандартная молярная энтальпия образования — изменение энтальпии при образовании 1 моль данного вещества в стандартном состоянии из простых вешеств, также находящихся в стандартном состоянии.
Стандартные энтальпии образования простых веществ в стандартных условиях принимают равными нулю. Если химический элемент в стандартных условиях образует несколько простых веществ (аллотропных модификаций), то в качестве стандартного состояния выбирают наиболее устойчивое из них. Например, для углерода стандартным состоянием считается графит, а для серы — ромбическая форма. В таких случаях в скобках после химической формулы простого вещества указывают название наиболее устойчивой аллотропной модификации: С (графит), S (pom6).
Стандартные молярные энтальпии фазовых переходов. Энтальпия изменяется не только в результате химических реакций, но и при фазовых переходах: превращении одной аллотропной модификации в другую, плавлении и затвердевании, испарении и конденсации, сублимации и десублимации. Сублимация (возгонка) — переход твердого вещества непосредственно в газообразное, минуя плавление. Десублимация — обратный процесс. Температура, при которой происходит фазовое превращение, называется температурой перехода. Приводимые в справочниках стандартные молярные энтальпии фазовых переходов представляют собой изменения энтальпии в результате фазового перехода 1 моль вещества, находящегося в стандартном состоянии при температуре перехода и нормальном атмосферном давлении. Для взаимно обратных процессов, например испарения и конденсации, молярные энтальпии равны по абсолютной величине, но обратны по знаку, поэтому в справочниках приводят значения только одной из этих величин. Например, приводимая в справочниках молярная энтальпия испарения воды АН°сп = = 40,66 кДж/моль. Это означает, что для превращения 1 моль жидкой воды в водяной пар при температуре кипения 398,15 К (100°С) и давлении 101,3 кПа нужно затратить 40,66 кДж теплоты. Положительное значение А//,°1Сп свидетельствует о том, что этот процесс эндотермический. В результате обратного, экзотермического процесса конденсации 1 моль воды выделяет 40,66 кДж теплоты. Следовательно, А//°онд = = -40,66 кДж/моль.
Стандартные молярные энтальпии сгорания. Определить экспериментально теплоты образования подавляющего большинства органических веществ не удается, так как невозможно получить их прямым синтезом из простых веществ. Поэтому в термохимических расчетах для органических соединений используют найденные опытным путем теплоты сгорания этих веществ в кислороде. Стандартная молярная энтальпия сгорания — изменение энтальпии при полном сгорании 1 моль вещества в его стандартном состоянии при стандартных условиях. Для веществ, состоящих только из атомов углерода, водорода и кислорода, полное сгорание означает их превращение в С02 и Н20. Продукты окисления других элементов определяют в каждом конкретном эксперименте.
Определяя экспериментально теплоты сгорания пищевых продуктов и кормов для сельскохозяйственных животных, устанавливают их энергетическую ценность. При этом тепловой эффект реакции относят не к количеству вещества в молях, а к его массе в граммах. Например, энергетическая ценность 100 г сахара равна 1680 кДж. В диетологии и в науке о кормлении сельскохозяйственных животных энергетическую ценность продуктов и кормов называют калорийностью и измеряют в ккал/г (1 ккал = 4,184 кДж).
Закон Гесса. Тепловые эффекты многих реакций не могут быть определены экспериментально, например для многих веществ невозможно опытным путем определить энтальпию образования, потому что далеко не все сложные вещества можно получить прямым синтезом из простых веществ. В таких случаях прибегают к термохимическим расчетам, в основе которых лежит закон, установленный в 1840 г. российским ученым Г. И. Гессом.
Тепловой эффект химической реакции зависит только от начального и конечного состояний системы и не зависит от пути перехода.
Это означает, что если из данных реагентов данные продукты могут быть получены с помощью двух или нескольких различных последовательностей реакций, то сумма тепловых эффектов для каждой из этих последовательностей будет одной и той же. Примером является получение диоксида углерода из графита, которое можно осуществить двумя путями.
Первый путь: прямое окисление графита кислородом до С02:
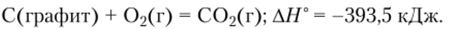
Второй путь: окисление графита сначала до СО, а затем окисление СО до С02:
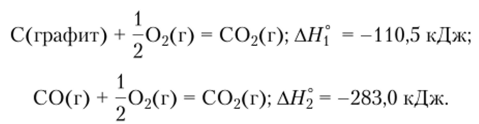
В соответствии с законом Гесса 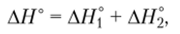 в чем нетрудно убедиться, найдя сумму.
в чем нетрудно убедиться, найдя сумму.
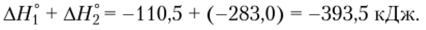
Из закона Гесса следует, что тепловой эффект реакции можно вычислить, если из суммы стандартных молярных энтальпий образования продуктов реакции вычесть сумму стандартных молярных энтальпий образования реагентов:
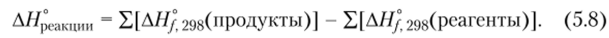
При суммировании каждое значение Afl729g нужно умножать на стехиометрический коэффициент, стоящий в термохимическом уравнении перед формулой соответствующего вещества. Например, для реакции горения фосфина.
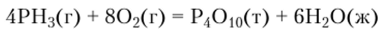
изменение энтальпии равно:
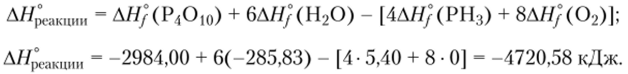
Тепловой эффект реакций с участием органических веществ, для которых известны стандартные молярные теплоты сгорания, в соответствии с законом Гесса можно вычислить, если из суммы стандартных молярных энтальпий сгорания реагентов вычесть сумму стандартных молярных энтальпий сгорания продуктов (суммирование следует осуществлять с учетом стехиометрических коэффициентов, как и в расчетах с использованием AHf 298);
Тепловые эффекты реакций обычно слабо зависят от температуры, поэтому для их достаточно точной оценки, как правило, можно пользоваться значениями стандартных молярных энтальпий образования и сгорания для температуры 298,15 К. Для более строгих расчетов с учетом зависимости молярных энтальпий от температуры и давления предназначены специальные термодинамические справочники, позволяющие вычислять АН при других параметрах.