Электрические явления в возбудимых тканях

А: /—нервная клетка; 2—микроэлектрод; 3 — электрод сравнения; Л, х — входное сопротивление регистрирующей системы; стрелками показано направление движения регистрируемого ионного тока; Б. / — липидный бислой; 2— интегральные белки; 3— ионный канал, 4— элемент спектриновой сети; 5 — коммутационные белки тов). Среди основных функций интегральных белков можно выделить транспортную, рецепторную… Читать ещё >
Электрические явления в возбудимых тканях (реферат, курсовая, диплом, контрольная)
Прежде чем приступить к изложению современных представлений о возбуждении в нервной и мышечной тканях, кратко остановимся на исторических аспектах. Как уже говорилось в начале главы, о наличии процесса возбуждения в различных клетках и тканях можно судить по ряду признаков — критериев. Физиологами, изучавшими проблему возбуждения в XIX в., в нервной и мышечной тканях были найдены два весьма показательных и удобных критерия, используемых в клинической и лабораторной практике: появление электрического сигнала в нерве и сокращение мышцы, иннервируемой эти нервом. Классическими опытами, в которых впервые была продемонстрирована связь возбуждения в нервах и мышцах с их электрической активностью, явились эксперименты, проведенные в конце XVIII в. итальянским ученым Л. Гальвани, а затем в начале XIX в. его учеником К. Маттеучи. Гальвани приготовил из лапки лягушки нервно-мышечный препарат, состоящий из седалищного нерва, включающего в себя большое количество отдельных нервных волокон, и икроножной мышцы, также состоящей из многих отдельных мышечных клеток — мышечных волокон. В середине мышцы делался надрез, в результате чего часть мышечных волокон рассекалась. На поврежденный участок мышцы с помощью стеклянных крючков (стекло было выбрано в качестве изолятора к электрическому току) помещался нерв таким образом, что одна часть касалась поврежденного, а другая — интактного участка мышцы (рис. 2.3, А). В момент накладывания нерва мышца сокращалась. Благодаря результатам.
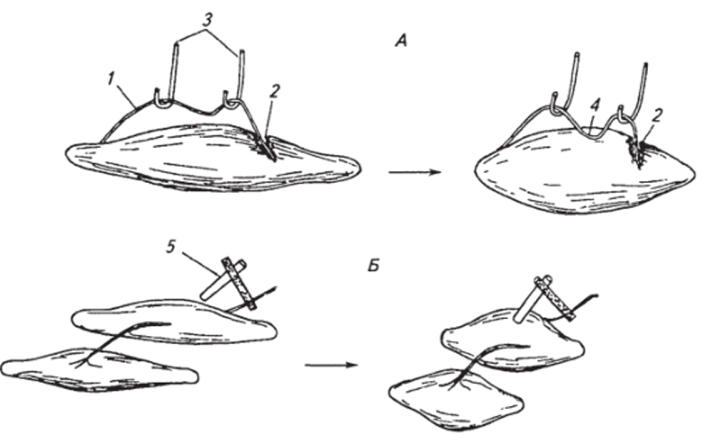
Рис. 2.3. Опыты Гальвани (А) и Маттсучи (?>), доказывающие наличие электрических потенциалов в нервно-мышечном препарате:
/ — нервный ствол; 2— место повреждения мышцы; 3 -стеклянные крючки, «/—место контакта нерва с интактным участком мышцы; 5 — биметаллический элемент из пластинок меди и цинка для раздражения нерва и мышцы данного опыта Гальвани выдвинул два важных положения: 1) «животное электричество», или электрическая поляризация, имеется не только в специальных известных к тому времени электрических органах некоторых рыб (электрический сом, угорь, скат), но и в других тканях организма у различных животных. Отметим, что для доказательства данного положения и был главным образом поставлен этот опыт; 2) электрическая поляризация, существующая в мышечной ткани, может вызвать возбуждение нерва.
Результаты экспериментов Маттеучи со вторичным сокращением мышцы оказались в пользу положений Гальвани. Маттеучи в своем опыте использовал два нервно-мышечных препарата (рис. 2.3, Б). Нерв первого препарата соединялся с источником электрического тока, а нерв другого накладывался на мышцу первого. При раздражении нерва электрическим током от внешнего источника тока сокращались мышцы не только первого препарата, но и второго. Таким образом, электрический ток как от внешнего источника, так и возникающий во время возбуждения является эффективным раздражителем для этих тканей. Процесс возбуждения, происходящий в результате раздражения нервов и мышц, может распространяться на значительные расстояния от места возникновения, причем он сопровождается изменением электрической поляризации ткани. Для объективности следует указать, что прямых измерений электрических токов в нервномышечном препарате в описываемых опытах не производилось, тем не менее результаты исследований Гальвани и Маттеучи явились основой для возникновения активно развивающейся по настоящее время науки о механизмах электрических явлений в организмах — электрофизиологии.
Мощным толчком для развития исследований природы электрических явлений в нервных и мышечных структурах послужили работы Е. Дюбуа-Реймона. В середине XIX в. Дюбуа-Реймон с помощью весьма чувствительного, но инерционного гальванометра провел серию классических опытов, подтвердивших положение Гальвани о том, что нервы и мышцы способны сами по себе генерировать электродвижущие силы. Так, при рассечении или прижигании участка мышцы поврежденная область становится электроотрицательной по отношению к интактной и соединенный с этими участками с помощью электродов гальванометр регистрирует электрический ток — «ток повреждения». Кроме того, раздражение нерва электрическими импульсами сопровождается кратковременными колебаниями регистрируемого электрического тока, которые всегда направлены в сторону уменьшения «тока повреждения». Для объяснения электрических явлений в нервах и мышцах Дюбуа-Реймон выдвинул гипотезу, согласно которой электрические свойства нервов и мышц обусловлены находящимися внутри этих структур так называемыми периполярными молекулами. В покоящихся нервных или мышечных клетках при их рассечении отрицательно заряженные частицы этих молекул всегда обращены к поперечному разрезу, а к продольной (неповрежденной) поверхности — положительные. При раздражении периполярные молекулы могут менять свою ориентацию, что приводит к колебаниям величины «потенциала повреждения» или, как в дальнейшем его стали называть, потенциала покоя. Таким образом, согласно гипотезе Дюбуа-Реймона в нервных и мышечных клетках при регистрации потенциала покоя постоянно существуют внутриклеточные соотношения между полярными молекулами. Другими словами, потенциал покоя предсуществует, а возбуждение связано с перемещением заряженных молекул, причем сами молекулы при этом не претерпевают никаких изменений. Вместе с тем учеником Дюбуа-Реймона Л. Германом была высказана другая точка зрения на происхождение потенциала покоя. Он считал, что электрической поляризации в нормальной неповрежденной клетке не существует. Потенциал покоя возникает как следствие повреждения клеток. При раздражении или повреждении происходят изменения в самих молекулах, находящихся внутри мышц или нервов. Эти две теории легли в основу всех существующих в настоящее время представлений о развитии возбуждения и возникновении электрических потенциалов в живых клетках и тканях — теория предсуществования и теория альтерации (повреждения). Эти теории в момент своего возникновения были в значительной мере умозрительны и не опирались на какие-либо серьезные экспериментальные данные. Время показало, что наиболее перспективной оказалась теория предсуществования Дюбуа-Реймона.
Результаты работ физикохимиков Аррениуса, Оствальда, Нернста позволили ученику Дюбуа-Реймона Ю. Бернштейну развить взгляды своего учителя и в начале XX в. сформулировать мембранную теорию биоэлектрических явлений. Согласно концепции Бернштейна, живая клетка окружена мембраной, которая, пропуская одни ионы и задерживая другие, может поляризоваться, т. е. между внутренней и наружной средой клетки возникает электрический потенциал. Необходимо отметить, что к тому времени было известно о существовании мембраны только у растительных клеток. Предположение, что мембрана может быть и у клеток животных, возникло после проведения экспериментов по измерению ионного состава внутри клетки и окружающей среды. Было обнаружено, что внутри клеток преобладают ионы калия, а во внеклеточной среде — ионы натрия. В соответствии с этими данными Бернштейн полагал, что в состоянии покоя клеточная мембрана избирательно проницаема только для ионов калия и эта избирательность утрачивается на время возбуждения, когда мембрана становится в равной мере проницаемой и для других ионов, например для ионов натрия и хлора, при этом потенциал покоя исчезает. Мембранная теория Бернштейна внесла существенный вклад в выяснение механизмов электрических явлений в живых клетках. В частности, она хорошо объясняла, как клетка поддерживает чрезвычайно экономно градиент концентраций ионов. В соответствии с этим получили свое объяснение существование (предсуществование) потенциала покоя, его знак и примерная величина. Вместе с тем в дальнейшем стали накапливаться экспериментальные факты, которые было трудно объяснить с позиций теории Бернштейна. Концепция Бернштейна была существенно видоизменена и переработана в 50-х годах XX в. А. Ходжкиным, А. Хаксли и Б. Катцем. Нужно отметить, что возникновение новой мембранной теории было подготовлено благодаря усовершенствованию методов регистрации электрических потенциалов в живых клетках и экспериментальных методов с одиночными нервными и мышечными клетками, а также нервными волокнами. Кроме того, значительный вклад внесли исследования структуры самой клеточной мембраны. Видимые доказательства существования клеточной мембраны у клеток животных стали возможны только в середине XX в. в связи с появлением электронного микроскопа.
Под электронным микроскопом мембрана имеет вид трехслойной структуры — два темных слоя по краям и один светлый в середине — «прозрачный» для электронов; толщина ее около 10 нм. К настоящему времени структурная организация нервной мембраны до конца не выяснена. Вместе с тем использование различных физических и химических методов позволило создать несколько моделей клеточной мембраны. На рисунке 2.4, Б представлен фрагмент строения мембраны в соответствии с твердокаркасной жидкостно-мозаичной моделью. Мембрана состоит главным образом из липидов и белков с примесью углеводов. Липиды представлены фосфолипидами или гликолипидами. Жирно-кислотный состав липидов весьма разнообразен, однако преобладают в них пальмитиновая и олеиновая кислоты. Изучение структуры молекул липидов показало, что они имеют полярные «головки» и неполярные «хвосты», т. е на одном конце молекулы имеются заряженные ионные группы, а другой конец является электронейтральным. Сочетание в молекулах липидов двух частей определяет их способность образовывать мембраны. Полярные головки молекул стремятся контактировать с водой, а неполярные хвостовые части избегают таких контактов и притягиваются друг к другу благодаря ван-дер-ваальсовым взаимодействиям. В результате образуются пленки, состоящие из двух слоев липидных молекул. Таким образом, молекулы липидов идеально подходят для образования раздела между неводной фазой внутри мембраны и водными внутрии внеклеточными пространствами.
Мембранные белки подразделяют на две большие группы в зависимости от характера взаимодействия с бислоем липидов. Первая группа — это периферические белки, которые взаимодействуют с полярными поверхностными частями липидов электростатически (см. рис. 2.4, Б). Вторая группа — интегральные белки, в которых много неполярных аминокислотных остатков, взаимодействующих с гидрофобной внутренней областью бислоя мембраны (т. е. хвостами липидов) с помощью ван-дер-ваальсовых сил. Возможны следующие варианты расположения интегральных белков в мембранах (см. рис. 2.4, Б): белок полностью погружен в бислой; сравнительно небольшая гидрофобная часть белка погружена в мембрану, пересекая при этом всю ее толщину, а большая (гидрофильная) часть обращена в водную среду; гидрофобная часть белка (гидрофобный «якорь») проникает только на глубину фосфолипидного монослоя.
По функциям периферические белки делятся на регуляторносигнальные (белки внеклеточного матрикса: фибронектин, ламинин, коллаген), структурно-каркасные (актин-спектриновые комплексы), обеспечивающие подвижность внутриклеточных структур и отдельных клеток (белки микротрубочек и микрофиламен;
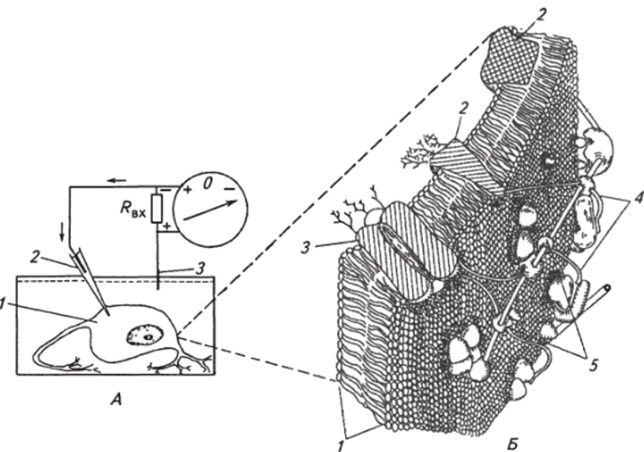
Рис. 2.4. Схема регистрации мембранного потенциала (А) и фрагмент клеточной мембраны (Б) нервной клетки:
А: /—нервная клетка; 2—микроэлектрод; 3 — электрод сравнения; Л,х — входное сопротивление регистрирующей системы; стрелками показано направление движения регистрируемого ионного тока; Б. / — липидный бислой; 2— интегральные белки; 3— ионный канал, 4— элемент спектриновой сети; 5 — коммутационные белки тов). Среди основных функций интегральных белков можно выделить транспортную, рецепторную и ферментативную. Транспортные белки осуществляют перенос ионов и незаряженных молекул через мембрану, они формируют каналы пассивного и активного транспорта. Рецепторные (т. е. воспринимающие) белки чрезвычайно разнообразны и участвуют в восприятии различных химических и физических стимулов, воздействующих на клетку. Ферментативные белки обеспечивают биохимические реакции, протекающие на клеточных мембранах. Согласно модели (см. рис. 2.4, Б) липидный бислой заполняет ячейки каркаса, образованные связанными между собой определенным образом периферическими и интегральными белками. Вместе с тем часть белков не входит в состав каркаса, а находится в свободном состоянии. Структура белкового каркаса динамична и в зависимости от физиологического состояния клетки может изменяться в результате включения или удаления различных структурных и функциональных (рецепторы, ферменты) элементов. Таким образом, по современным представлениям клеточная мембрана имеет довольно сложную структуру, может выполнять многочисленные и чрезвычайно важные операции для функционирования клетки, и в том числе для ее возбуждения.
В течение длительного времени потенциал покоя измерялся как потенциал повреждения, т. е. регистрировалась разность потенциалов между участком нервной или мышечной ткани, где клеточная мембрана была разрушена, и участком интактной мембраны. По этим измерениям нельзя было судить об абсолютной величине потенциала покоя, поскольку невозможно избежать шунтирования регистрирующих электродов из-за того, что часть тока, величину которой трудно оценить, распространялась от поврежденного участка по тонкому слою жидкости к интактным областям ткани, минуя регистрирующие электроды. Кроме того, потенциал повреждения быстро уменьшался со временем.
Величину потенциала покоя стало возможным измерять с высокой точностью с введением в 50-е годы XX в. Грэхемом, Лингом и Джерардом в практику электрофизиологического эксперимента микроэлектродов — микросолевых мостиков. Микроэлектроды изготовляются из тонких стеклянных трубочек с оттянутым на одном конце кончиком, диаметр которого составляет доли микрона. Микроэлектрод заполняется концентрированным солевым раствором, например 3-молярным КС1. Со стороны широкого конца в трубочку вставляется металлическая проволока — платиновая или серебряная.
Для того чтобы избежать поляризации металла в солевом растворе, т. е. возникновения на регистрирующих электродах противоположно направленной измеряемому потенциалу электродвижущей силы, и тем самым исключить искажения в регистрации потенциала, на поверхность металла наносят тонкий слой его соли электролитическим методом. Например, в случае серебра — хлорид серебра. Такое покрытие создает значительный запас ионов Ag+ и Cl" на поверхности проволочки и служит промежуточным звеном между электронной проводимостью в металле (Ag+ + е- —> Ag) и ионным током, который обусловлен обменом ионами Cl- между слоем AgCl и раствором. Вследствие этого становится возможным двусторонний поток электрических зарядов от электронов в металле к ионам хлора в растворе и в обратном направлении без возникновения на электродах обратнонаправленной электродвижущей силы. Такие электроды получили название неполяризующихся.
Для работы с микроэлектродами были разработаны электронные усилители постоянного тока, которые работают в электрометрическом режиме, т. е. имеют очень большое входное сопротивление и потребляют чрезвычайно малый ток от измеряемого источника ЭДС. Для измерения постоянных или медленно изменяющихся потенциалов к выходу усилителя можно подключить стрелочный индикатор, однако для регистрации быстрых изменений потенциала используют безынерционные электронные осциллографы. С целью измерения потенциала покоя кончиком микроэлектрода прокалывают мембрану клетки, второй электрод (электрод сравнения) — также неполяризующийся электрод — помешают рядом с исследуемой клеткой. Его конструкция может быть самой различной: в простейшем случае это просто хлорированная проволочка. Нужно отметить, что прокалывание мембраны кончиком микроэлектрода клетки также, по сути, наносит клетке повреждение, но, как продемонстрировали многочисленные исследования, оно минимально. Подтверждением этого является тот факт, что регистрируемый потенциал может держаться на неизменном уровне в течение нескольких часов. Предполагается, что клеточная мембрана в месте входа микроэлектрода плотно обхватывает его стенки, предупреждая появление шунтирующего ионного тока вдоль наружной поверхности стеклянного кончика. Микроэлектродные измерения различных типов клеток животных показали, что потенциал покоя или, как лучше называть разность потенциалов на клеточной мембране — мембранный потенциал, имеет отрицательный знак внутри клетки (рис. 2.4, А). Учитывая, что в наружной цепи источника ЭДС электрический ток течет от положительного полюса к отрицательному, ток через мембрану будет распространяться к электроду сравнения (внеклеточному), т. е. к наружной поверхности мембраны. В месте соединения солевой раствор/металл (AgCl/Ag) ионная проводимость переходит в электронную. Электронный ток на входном сопротивлении усилителя Лвх создаст падение напряжения, очень близкое по величине к мембранному потенциалу клетки. Затем поток электронов в месте контакта Ag/AgCl, находящемся в стеклянной трубочке, переходит в поток ионов и через кончик микроэлектрода входит в клетку, замыкая цепь. Таким образом, измерения мембранного потенциала с помощью микроэлектродов подтвердило теорию Дюбуа-Реймона о том, что разность потенциалов через мембрану преформирована и не является результатом повреждения протоплазмы клетки. Преимущество микроэлектродного метода состоит в том, что можно исследовать мелкие клетки и проводить эксперименты на отдельных клетках, находящихся в организме без их изоляции.
Попытаемся теперь выяснить, каким образом устанавливается через мембрану, имеющую избирательную проницаемость к определенным ионам, разность потенциалов и как можно вычислить ее величину. Начнем с идеального случая. На рисунке 2.5 видно, что два раствора солей разделены мембраной. Раствор во внутреннем объеме (А) содержит 100 мМ КС1 и 10 мМ NaCl, снаружи (Б) — 100 мМ NaCl и 10 мМ КС1. Мембрана имеет каналы, диаметр которых позволяет проходить через них только гидратированным (т.е. окруженным оболочкой из молекул воды) ионам калия и молекулам воды. Гидратированные ионы натрия, превышающие в 1,5 раза диаметр гидратированных ионов калия, не проходят через данные каналы. Кроме того, на внутренних стенках этих каналов располагаются фиксированные отрицательные заряды, что препятствует прохождению через них отрицательно заряженных ионов хлора. При данных условиях из объема А в объем Б через каналы по своему концентрационному градиенту могут проходить только ионы калия. Но диффузии происходить не будет. Причина заключается в том, что ионы калия — положительно заряженные частицы. Движение только ионов калия в объем Б приведет к увеличению в нем положительно заряженных частиц, что сразу же проявится в возникновении задерживающей их положительной электростатической силы. Через мембрану возникнет разность потенциалов соответственно с положительным знаком снаружи и отрицательным внутри объема А, которую можно измерить с помощью описанной ранее регистрирующей системы. Добавление NaCl в растворы по обе стороны мембраны обеспечивает поддержание осмотического равновесия. При отсутствии NaCl возникло бы гидростатическое давление или же в случае податливости мембраны осмотический ток воды в объем А из объема Б. Таким образом, между объемом А и объемом Б, разделенными мембраной, установится электрохимическое равновесие, обусловленное равенством электрической работы, необходимой для перемещения небольшого количества заряженных частиц — ионов в одном направлении и осмотической работой, затраченной для перемещения того же количества ионов, в противоположном направлении. Известно, что электрическая работа А-3, необходимая для переноса 1 моль ионов К+ против разности потенциалов Е, равна произведению заряда Q этого количества ионов на разность потенциалов:
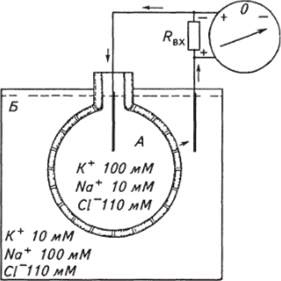
Рис. 2.5. Образование потенциала через идеальную мембрану:
А — внутренний объем, ограниченный мембраной; Б — внешний объем; Rax — входное сопротивление регистрирующей системы; стрелками показано направление ионного тока, пунктирной линией — уровень раствора.

но Q = nF, где я — валентность ионов (в данном случае она равна 1), a F— число Фарадея. Следовательно,.

Осмотическую работу, необходимую для перемещения 1 моль ионов калия из области концентрации [К+]Б в область, где его концентрация [К+]А в 10 раз выше, легче всего оценить, проведя аналогию с работой по сжатию 1 г • экв идеального газа до 1/10 его первоначального объема. Идеальный газ состоит из частиц (молекул), не взаимодействующих друг с другом. Сжатие газа производится очень медленно, без изменения его температуры. Представим, что газ находится в цилиндре с подвижным поршнем. Механическая работа Ам равна произведению силы F на расстояние /: Аы = FI. В данном случае для очень малого перемещения Д/ поршня действующая сила F равна произведению давления Р газа на площадь S поперечного сечения. Отсюда произведенная работа при малом перемещении поршня.

Учитывая, что произведение S&I— элементарный объем Д V,

При медленном увеличении силы, действующей на поршень, произведенная работа по сжиманию идеального газа от объема V до объема V2, меньшего в 10 раз объема V,

Согласно формуле Менделеева — Клайперона давление и объем газа связаны между собой обратно пропорциональной зависимостью:

где R — универсальная газовая постоянная; Г—температура.
Отсюда механическая работа.

Вычисляя определенный интеграл, получим, что.
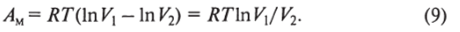
Отметим, что при сжатии газа с уменьшением его объема происходит увеличение концентрации его молекул. Поскольку между объемом и концентрацией существует обратно пропорциональная зависимость V— 1/[С], можно переписать формулу (9) 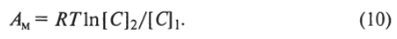
Приведенные рассуждения применимы к вычислению осмотической работы, выполняемой при увеличении концентрации молекул растворенного вещества, т. е. при перемещении молекул в область их более высокой концентрации. Эту ситуацию легко смоделировать, представив, что в цилиндре находится не газ, а раствор с ионами и поршень сделан из полупроницаемой неподатливой (не изменяющей свои размеры) мембраны (см. рис. 2.5). Допустим, первоначально по обе стороны поршнямембраны находится раствор, в котором концентрация КС1 составляет 10 мМ. Затем начнем медленно увеличивать давление таким образом, чтобы молекулы воды по каналам успевали выходить из объема А в объем Б без повышения температуры раствора. При достижении определенного давления на поршень-мембрану концентрация КС1 в объеме А увеличится в 10 раз. Осмотическая работа.
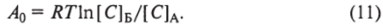
Ионы К+ в соответствии с разностью их концентраций будут стремиться диффундировать через каналы поршня. Поскольку они являются заряженными частицами, увеличение количества положительно заряженных частиц, не скомпенсированное с отрицательно заряженными частицами, вызовет возникновение задерживающей их электростатической силы. Возникший потенциал компенсирует «диффузионное давление». В этом случае, как уже говорилось,.

Подставляя значения, получаем.

Отсюда потенциал через мембрану.
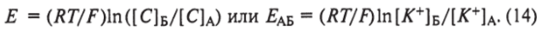
Это уравнение было выведено физикохимиком Нернстом и носит его имя. Следует отметить, что равнение Нернста — самое известное и наиболее используемое. Приведен его первоначальный вывод, который базируется на простых термодинамических принципах, определяющих электрохимическое равновесие. Как следует из уравнения, потенциал через мембрану зависит от температуры и концентрации только ионов К+ по обе стороны мембраны. Этот потенциал получил еще и название равновесного потенциала, поскольку он уравновешивает разность концентраций ионов через мембрану.
Перейдя от натуральных логарифмов к десятичным и подставив значения универсальной газовой постоянной и числа Фарадея, можно вычислить величину потенциала при температуре 18 °С:
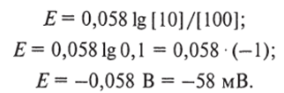
Таким образом, согласно расчету по уравнению потенциал имеет знак «минус».
От рассуждений о ситуации с идеальной мембраной перейдем теперь к примеру, более приближенному к реальным условиям: мембране между двумя объемами, пропускающей несколько ионов. На рисунке 2.6 изображены две ячейки, разделенные данным типом мембраны. Отметим также, что мембрана и стенки ячеек способны выдерживать большое гидростатическое давление. В исходном состоянии концентрации ионов К+ и С1″ в обеих ячейках одинаковы и находятся в равновесном состоянии. При добавлении в ячейку А калиевой соли, анион которой не способен проходить через каналы, в мембране происходит перераспределение ионов К+ и С1″. Ионы К+ будут выходить из ячейки А в ячейку Б. По аналогии с первым случаем (см. рис. 2.5) изменение концентрации заряженных частиц по обе стороны мембраны вызовет возникновение электростатической силы с отрицательным знаком со стороны ячейки А, которая заставит ионы С1~ перемещаться в ячейку Б, хотя движение С1~ будет происходить против образующегося и возрастающего концентрационного градиента. Этот процесс будет продолжаться до тех пор, пока разность концентраций,.
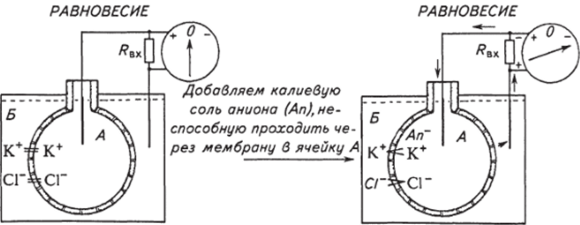
Рис. 2.6. Схема ионного равновесия Доннана:
Л,х — входное сопротивление регистрирующей системы; стрелками показано направление ионного тока, пунктирной линией — уровень раствора заставляющих ионы К+ переходить из ячейки А в ячейку Б, не будет уравновешена противоположно направленной силой, заставляющей переходить ионы С1~ из ячейки Б в ячейку А. Две силы уравновесят друг друга тогда, когда отношение концентраций для К+ и С1~ по обе стороны мембраны будет удовлетворять равенству.
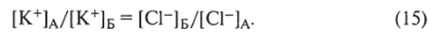
Это явление названо равновесием Доннана, по имени Ф. Доннана, который в начале XX в. впервые исследовал распределение ионов в данной системе. Общая осмотическая концентрация в объеме А выше, чем в объеме Б, но стремление молекул воды переходить в объем А по своему концентрационному градиенту будет сбалансировано развившемся в объеме А гидростатическим давлением, равным разности осмотических давлений с двух сторон мембраны. Во время равновесного состояния стремление К+ переходить из ячейки А в ячейку Б будет равно стремлению С1″ переходить из ячейки Б в ячейку А. Однако ионы перемещаться не будут, поскольку этому препятствует образование разности потенциалов между двумя сторонами, которая уравновешивает концентрационные градиенты этих ионов. Величина этой разности потенциалов определяется по формуле Нернста.
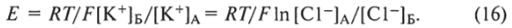
Исследования потенциала покоя у различных клеток (главным образом нервных и мышечных) с помощью микроэлектродов подтвердили справедливость основных положений мембранной теории. Так, экспериментально замеренные потенциалы покоя в ряде случаев были близки по значению с рассчитанным равновесным потенциалом для ионов калия. Вариации наружной концентрации ионов калия вызывали изменения в величине потенциала покоя, совпадавшие с вычисленными по уравнению Нернста, а изменения концентрации ионов натрия в окружающей клетку среде не влияли на величину потенциала покоя. В то же время были получены данные, что мембраны, окружающие клетки, в отличие от идеальной мембраны пропускают в той или иной степени не один или два иона, а все неорганические ионы, находящиеся в окружающей клетку наружной среде, и поэтому представляют собой более сложные системы. Напомним, что электрохимический градиент того или иного иона не влияет на мембранный потенциал, если этот ион не способен проникать через мембрану, т. е. переносить заряды с одной стороны мембраны на другую. Кроме того, оказалось, что мембранный потенциал не будет зависеть от электрохимического градиента иона и в том случае, если его проницаемость через мембрану во много раз меньше легко диффундирующего иона. Таким образом, относительная способность различных ионов к диффузии через мембрану определяет их вклад в потенциал, возникающий в результате диффузии. Приняв во внимание это положение, а также упрощенное допущение о том, что уменьшение потенциала при переходе от одной поверхности мембраны к другой происходит равномерно, Д. Голдман в начале 40-х годов XX в. на основании уравнения Нернста вывел новое уравнение, учитывающее относительную проницаемость мембраны для всех диффундирующих ионов: 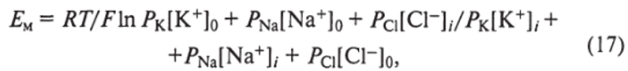
где Р— проницаемость для основных ионов, присутствующих во внутрии внеклеточной среде; /—внутриклеточная концентрация ионов; 0 — экстраклеточная концентрация ионов. Поскольку валентность всех ионов равна 1, то п • F= 1 ? FF.
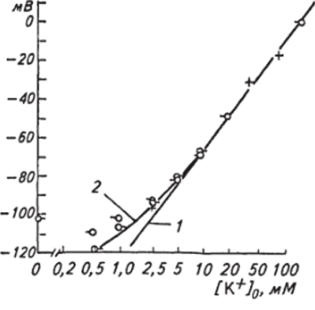
Проницаемость определяется как отношение потока какихлибо частиц (нейтральных молекул, ионов) к их концентрации и характеризует скорость, с которой частицы проходят через мембрану в заданных условиях. Поток частиц можно представить как количество растворенных частиц (моль), которые пересекают единицу площади мембраны (см2) каждую секунду (моль/см2 • с). Концентрация вещества в каком-либо объеме будет измеряться как моль/см3. Поэтому размерность проницаемости будет выражаться как моль/см2: с/моль/см3 =см/с, т. е. имеет размерность скорости. В соответствии с уравнением Голдмана вклад каждого иона в потенциал покоя или, как часто его называют, мембранный потенциал, будет тем меньше, чем меньше его проницаемость через мембрану. Кроме того, снижение концентрации иона также уменьшает его вклад в мембранный потенциал. Это хорошо иллюстрирует рисунок 2.7, на котором представлена зависимость мембранного потенциала мышечного волокна лягушки от внеклеточной концентрации ионов калия. При высоких значениях концентраций ионов калия на;
Рис. 2.7. Зависимость потенциала покоя мышечного волокна от концентрации ионов калия во внеклеточной среде:
/ — теоретическая зависимость, рассчитанная по формуле Нернста; 2—кривая, построенная по экспериментальным данным; по оси абсцисс— концентрация ионов калия; по оси ординат — величина мембранного потенциала клон кривой совпадает с теоретически рассчитанной и имеет, как и в случае с идеальной мембраной, наклон 58 мВ на десятикратное увеличение содержания ионов калия. При низких концентрациях кривые начинают расходиться из-за влияния ионов натрия, хотя проницаемость для этих ионов, определенная в опытах с радиоактивными изотопами, примерно в 100 раз меньше, чем ионов калия. Произведение /WNa+fo численно начинает приближаться к произведению /VI K+]q. Следует учитывать, что ионы хлора в мышечных волокнах лягушки распределяются пассивно в соответствии с величиной и знаком мембранного потенциала, т. е. отсюда следует, что не ионы хлора вносят вклад в мембранный потенциал, а мембранный потенциал определяет распределение ионов хлора. Поэтому при расчете мембранного потенциала в данном случае ионами хлора можно пренебречь. Вместе с тем исследования показали, что в других клетках ионы хлора не находятся в состоянии электрохимического равновесия по разные стороны мембраны и вносят соответствующий вклад в создание мембранного потенциала. Учитывая этот факт, уравнение Голдмана можно записать в упрощенном варианте:
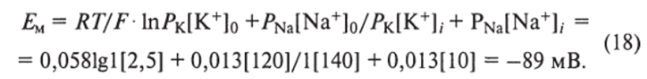
При физиологических значениях ионов калия в окружающей среде 2,5 мМ равновесный потенциал покоя по уравнению Нернста.
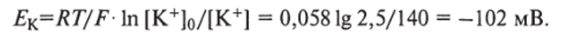
Значение ?м = —89 мВ заметно отличается от значения равновесного потенциала для ионов К+и согласуется со значением Ем = -90 мВ, полученным при микроэлектродных измерениях мембранного потенциала мышечной клетки.