Биоэнергетика.
Биохимия человека

Самопроизвольное гипотетическое опреснение; /, / '-исходные состояния, 2, 2'- конечные состояния Поскольку система изолированная, обмен энергией путем передачи теплоты, вещества и совершение работы не происходят. Следовательно, термодинамическая функция — внутренняя энергия Е системы — не меняется. В то же время очевидно, что состояние системы изменилось, так как компоненты внутри нее… Читать ещё >
Биоэнергетика. Биохимия человека (реферат, курсовая, диплом, контрольная)
Взаимосвязь между процессами обмена веществ и энергии в организме
Процессы жизнедеятельности на Земле обусловлены в значительной мере накоплением солнечной энергии в биогенных веществах — белках, жирах, углеводах — и последующими превращениями этих веществ в живых организмах — растениях и животных с выделением энергии.
Особенно отчетливо понимание взаимосвязи химических превращений и энергетических процессов в организме было осознано после исследований, проведенных совместно великими французскими естествоиспытателями Антуаном Лавуазье (1743−1794) и Пьером Лапласом (1749−1827). Эти ученые с помощью придуманного ими калориметра прямыми измерениями на животных показали, что энергия жизнедеятельности определяется окислением продуктов питания кислородом воздуха, вдыхаемым животными.
Бурное развитие машиностроения в XIX—XX вв. привело к созданию новой науки — термодинамики.
Термодинамика (от греч. «therme» — тепло и «dynamikos» — сильный) — наука о взаимопревращениях теплоты и энергии.
Биоэнергетика — раздел термодинамики, изучающий взаимосвязь между обменом веществ и энергии в живых системах С помощью методов термодинамики стало возможно количественно строго рассчитывать превращения энергии не только в тепловых машинах, но и в биохимических реакциях и физиологических процессах, предсказывать их направление.
Термодинамические методы основаны на ряде строгих понятий: «система», «состояние системы», «внутренняя энергия системы», «функция состояния системы».
Термодинамической системой называют любой объект природы, состоящий из достаточно большого числа молекул (структурных единиц) и отделенный от других объектов природы реальной или воображаемой граничной поверхностью (границей раздела).
Из данного определения следует, что к термодинамическим системам могут быть отнесены и такие огромные объекты природы, как звезды, и самые маленькие живые существа — микроорганизмы. Отсюда понятно, насколько важно знать законы термодинамики.
Объекты природы, не входящие в систему, называют средой.
Средой для нашей планеты является Вселенная. Средой для микроорганизма в чашке Петри является агар с питательной смесью веществ.
Наиболее общими характеристиками самых различных систем являются масса т вещества, содержащегося в системе, и внутренняя энергия Е системы.
Масса т вещества системы есть величина, измеряемая суммой масс т, молекул (структурных единиц), из которых она состоит:
Внутренняя энергия Е системы есть величина, измеряемая суммой энергий теплового движения Е" молекул и энергий  Еы взаимодействия между ними:
Еы взаимодействия между ними:
Системы по характеру обмена веществом и энергией с окружающей средой (внешними объектами природы) подразделяют на три типа: изолированные (рис. 5.1, а), закрытые (рис. 5.1, б) и открытые (рис. 5.1, в).
Изолированной системой называется такая система, которая не обменивается со средой ни веществом, ни энергией [Ат = О, АЕ = 0).
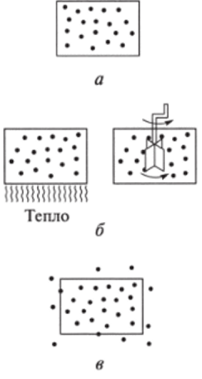
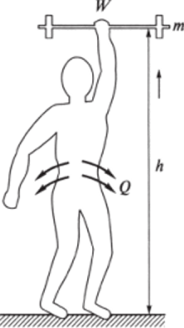
Рис. 5.1. Типы термодинамических систем:
а — изолированные, б - закрытые, в открытые.
Рис. 5.2. Термодинамика процессов при совершении человеком механической работы поднятия тяжести:
W — механическая работа. Q — теплота при поднятии человеком гантели массой т на высоту И
Примерами практически изолированных систем могут служить бытовой термос, сосуды Дьюара для длительного хранения при низких температурах жизнеспособных организмов.
Закрытой системой называют такую систему, которая не обменивается со средой веществом, но может обмениваться энергией [Ат = 0, АЕ * 0).
Обмен энергией в закрытых системах может осуществляться путем передачи теплоты Q или совершения работы IV.
Примером закрытой системы может служить герметически закрытый сосуд с мешалкой для выращивания микроорганизмов в термостате, поддерживающем заданную температуру.
Открытой системой называют такую систему, которая может обмениваться со средой и веществом и энергией (Ат Ф 0, АЕ Ф 0).
Примерами открытой системы являются живая клетка, организм человека. Примером из быта может служить стиральная машина.
Одно из важнейших понятий — «состояние системы».
Под состоянием системы понимают совокупность свойств системы, позволяющих определить эту систему с точки зрения термодинамики.
Количественно состояния различают с помощью термодинамических переменных (или параметров).
Термодинамическими переменными называют такие свойства системы, значения которых характеризуют состояние системы в целом.
Важнейшими термодинамическими переменными являются: давление р, температура Г, объем системы V или общая масса системы /и, масса химических веществ (компонентов) т*, из которых состоит система, или концентрация этих веществ с*.
Следует отметить, что аналогичные характеристики (температура и масса тела, состав биологических жидкостей организма — анализы, артериальное давление) используются в медицине для определения состояния пациента.
Процессом называется переход системы из одного состояния в другое.
В результате процесса состояние системы и термодинамические переменные изменяются. Эти изменения количественно характеризуются разностью термодинамических переменных в начальном и конечном состояниях, между которыми осуществляется переход в рассматриваемом процессе.
В термодинамике для определения изменения энергии системы в тех или иных условиях применяют различные энергетические характеристики.
Внутренняя энергия системы Е — одна из энергетических функций состояния. Изменение внутренней энергии системы АЕ может быть обусловлено работой W% которая совершается при взаимодействии системы со средой, и передачей теплоты Q между средой и системой. Соотношение между этими величинами составляет содержание 1-го начала термодинамики.
Приращение внутренней энергии системы ДЕ в некотором процессе равно теплоте О, полученной системой, плюс работа IV, совершенная над системой в этом процессе: 
В биологических системах теплота обычно отдается системой во внешнюю среду, а работа совершается системой за счет убыли внутренней энергии (рис. 5.2). Поэтому математическую запись первого начала термодинамики удобно представить в виде, а 1-е начало термодинамики формулируется так: 
Убыль внутренней энергии системы ДЕ в некотором процессе равна теплоте О, отданной системой, минус работа IV, совершенная системой в этом процессе.
Все величины в приведенных формулах измеряются в джоулях (Дж).
В качестве иллюстрации, дающей представление о применении 1-го начала термодинамики, удобно рассмотреть связь между теплотой, работой и внутренней энергией при многократном поднятии груза человеком (рис. 5.2).
Задача. Известно, что максимальная механическая работа, которая может быть совершена человеком в результате окисления 1 г глюкозы кислородом (с учетом КПД живого организма г ~ 40%), равна 6,5 кДж/г. При этом выделяется теплота, равная Qp = 9,5 кДж/г. Какая масса глюкозы должна окислиться в мышцах, чтобы человек мог поднять 25 раз груз массой т = 20 кг на высоту И- 2 м?
Решение. В соответствии с законами физики механическая работа по поднятию груза lV=vntgh, где v — число поднятий, т. е. 1 Т = -10кДж. Следовательно, для совершения этой работы в мышцах окисляется примерно.
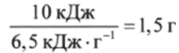 глюкозы и выделяется теплота Q = -9,5 кДж/гх х1,5 г = -14,3 кДж. Таким образом, в соответствии с 1-м началом термодинамики убыль внутренней энергии организма в результате окисления глюкозы составляет АЕ = -14,3 кДж — 10 кДж = -24,3 кДж.
глюкозы и выделяется теплота Q = -9,5 кДж/гх х1,5 г = -14,3 кДж. Таким образом, в соответствии с 1-м началом термодинамики убыль внутренней энергии организма в результате окисления глюкозы составляет АЕ = -14,3 кДж — 10 кДж = -24,3 кДж.
Этот простой пример показывает, что на основе 1-го начала термодинамики с помощью несложных расчетов можно получить важные сведения о процессах обмена веществ и энергии в организме.
Немецкий врач Ю. Р. Майер впервые сформулировал 1-е начало термодинамики (1840), исходя из наблюдений таких процессов у человека. Исходными работами, послужившими основой применения этого закона к химическим реакциям, явились исследования русского ученого Г. И. Гесса (1840), а окончательным его подтверждением стали экспериментальные исследования английского физика Д. Джоуля (1850).
1-е начало термодинамики относится к числу фундаментальных законов природы, которые не могут быть выведены из каких-то других законов. Справедливость 1-го начала термодинамики доказывают многочисленные эксперименты. К ним относятся эксперименты с отрицательным результатом — неудачные попытки построить вечный двигатель первого рода, т. е. такую машину, которая смогла бы как угодно долго совершать работу без подвода энергии извне. Следует помнить также, что 1-е начало термодинамики является количественным выражением одного из важнейших законов природы о неуничтожимости материи и ее движения.
Организм совершает работу, затрачивая внутреннюю энергию, запасенную в виде энергии химического взаимодействия атомов составляющих его веществ. Математическое выражение (5.2) 1-го начала термодинамики определяет точное соотношение между расходом внутренней энергии системы Л?, работой W, совершаемой системой, и энергией Q, которая теряется в виде теплоты. Однако из 1-го начала термодинамики нельзя определить часть расходуемой внутренней энергии, которая может быть преобразована в работу. Правда, при расчете, например, затрат энергии при совершении механической работы (рис. 5.2) учитывались тепловые потери. Но откуда берется значение этих потерь?
Наиболее общим методом экспериментального определения эффективности затрат внутренней энергии организмом являются калориметрические измерения, применяемые физиологами, а также эргометрические.
Теоретические оценки затрат осуществляются на основе 2-го начала термодинамики. Этот закон накладывает строгие ограничения на эффективность преобразования энергии в работу и, кроме того, позволяет ввести критерии возможности самопроизвольного протекания того или иного процесса.
Процесс называется самопроизвольным, если он осуществляется без какихлибо воздействий, когда система предоставлена самой себе.
Человек, знающий общий закон сохранения энергии из физики, но не знакомый с термодинамикой, может предположить, что химические и физические процессы могут протекать самопроизвольно лишь с уменьшением внутренней энергии системы. Таким образом, предполагается, что критерием самопроизвольности служит отрицательное значение приращения внутренней энергии (АЕ < 0).
Такое предположение может быть основано, в частности, на наблюдениях за движением предметов у земной поверхности. Все хорошо знают, что предметы падают сверху вниз, а не наоборот. Из физики известно, что при этом уменьшается потенциальная энергия? пот тела, т. е. имеет место убыль потенциальной энергии (AEnoi < 0). Однако изучение различных процессов, в том числе химических реакций, показало, что правило уменьшения внутренней энергии (АЕ < 0) не всегда применимо.
Во-первых, существуют процессы, при которых внутренняя энергия системы не меняется (АЕ — 0). К таким процессам относится, например, ионизация уксусной кислоты в воде.
Во-вторых, ряд самопроизвольных процессов протекает с увеличением внутренней энергии (АЕ > 0). К ним относятся, в частности, типичные реакции образования бионеорганических соединений альбумина (белок плазмы крови) с ионами металлов, например Си2* .
Существует, конечно, множество самопроизвольных процессов, происходящих с уменьшением внутренней энергии (АЕ < 0), например реакции окисления органических соединений, в том числе реакция окисления глюкозы при клеточном дыхании.
Таким образом, изменение внутренней энергии АЕ для закрытых систем не может служить критерием самопроизвольного протекания процессов. Следовательно, 1-го начала термодинамики, из которого получен этот критерий, недостаточно для решения вопроса о самопроизвольности, равно как и об эффективности процессов. Решение этих вопросов достигается с помощью 2-го начала термодинамики.
Для формулировки 2-го начала термодинамики необходимо ввести понятия обратимого и необратимого в термодинамическом смысле процессов.
При изменении внешних условий состояние системы может меняться, т. е. в системе может протекать процесс. Если, например, система заключена в цилиндр, то изменение внешнего давления вызывает процесс, приводящий к изменению объема системы, и система переходит из состояния 1 с объемом V в состояние 2 с объемом *2.
Процесс называется термодинамически обратимым, если при переходе из начального состояния 1 в конечное состояние 2 все промежуточные состояния оказываются равновесными.
Обратимый процесс на любом этапе можно заставить идти в обратном направлении, изменив внешние условия на очень малую величину. Например, при обратимом расширении газа можно начать сжатие в произвольный момент путем увеличения давления р на бесконечно малую величину dp.
Процесс называется термодинамически необратимым, если хоть одно из промежуточных состояний неравновесно.
Обратимый процесс можно осуществить лишь при достаточно медленном изменении параметров системы — температуры, давления, концентрации веществ и др. Скорость изменения параметров должна быть такой, чтобы возникающие в ходе процесса отклонения от равновесия были пренебрежимо малы. Следует отметить, что с обратимостью связана важная проблема медицины — консервация тканей при низких температурах.
Обратимые процессы являются предельным случаем реальных процессов, происходящих в природе и осуществляемых в промышленности или в лабораториях.
Максимальная работа которая может быть получена при данной убыли внутренней энергии ДЕ в процессе перехода из состояния 1 в состояние 2, достигается лишь в том случае, если этот процесс обратимый. В соответствии с выражением (5.1) для 1-го начала термодинамики при этом выделяется минимальная теплота QMHH
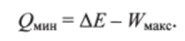
Максимально достижимый коэффициент полезного действия, характеризующий эффективность затрат внутренней энергии системы, соответственно равен.
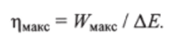
При необратимом процессе перехода из состояния 1 в состояние 2 производимая системой работа меньше WMWQ. Чтобы рассчитать т)макс при известном значении Д?, необходимо знать величину WMUX или Величину QMHM определяют на основе 2-го начала термодинамики с помощью термодинамической функции состояния, называемой энтропией.
Понятие энтропии ввел (1865) немецкий физик Р. Ю. Клаузиус (1822−1888) — один из основателей термодинамики и молекулярно-кинетической теории тепловых процессов. На основе этого понятия Р. Ю. Клаузиус одновременно с У. Томсоном в 1850 г. дал первую формулировку 2-го начала термодинамики. В соответствии с Клаузиусом энтропия — это функция состояния, приращение которой AS равно подведенной к системе в обратимом изотермическом процессе теплоте Омин1 деленной на абсолютную температуру Т, при которой осуществляется процесс:
 aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">
aside class="viderzhka__img" itemscope itemtype="http://schema.org/ImageObject">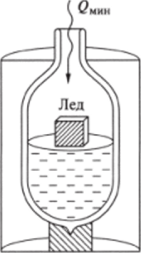
Рис. 5.3. Обратимое плавление (таяние) льда в термосе с водой при Тм = 273 К Из формулы (5.3) следует, что единица СИ измерения энтропии — Дж/К.
Примером обратимого изотермического процесса может служить медленное таяние льда в термосе с водой при 273 К (рис. 5.3). Экспериментально установлено, что для плавления 1 моля льда (18 г) необходимо подвести по крайней мере 6000 Дж теплоты. При этом энтропия системы лед-вода в термосе возрастает на ДS = 6000: 273 = 22 Дж/К.
При охлаждении воды в термосе при 273 К можно медленно отвести 6000 Дж теплоты. В результате происходящей при этом кристаллизации воды образуется 1 моль льда. Для этого процесса величина QMHH в формуле (5.3) имеет отрицательное значение. Соответственно энтропия системы лед-вода при образовании 1 моля льда убывает на ДS = -22 Дж/К.
Аналогичным образом можно рассчитать изменение энтропии при любых изотермических физических и химических процессах, если известна теплота ?мин, подводимая к системе или отводимая от нее при этих процессах. Как известно из физики, эта теплота может быть определена с помощью калориметрических измерений.
Таким образом, изменение энтропии, как и двух других функций состояния системы — внутренней энергии и энтальпии, представляет собой экспериментально определяемую величину. Физический смысл энтропии, как и внутренней энергии, отчетливо выявляется при рассмотрении с молекулярно-кинетической точки зрения процессов, протекающих в изолированных системах.
Изолированные системы, по определению, не обмениваются с внешней средой ни веществом, ни энергией. Конечно, реально таких систем в природе не существует. Однако очень хорошая изоляция может быть осуществлена, если поместить систему в термос с закрытой пробкой.
В качестве примера теплоизолированной системы рассмотрим термос с двумя слоями жидкостей. Нижний слой — окрашенный сироп, а верхний, бесцветный слой — газированная вода (рис. 5.4, а). Хорошо известно, что по прошествии достаточно большого промежутка времени граница между слоями исчезнет и в термосе получится однородный по цвету раствор — «коктейль». Очевидно, что в результате теплового движения частиц происходит диффузия компонентов и они равномерно распределяются по системе. После этого в системе устанавливается равновесие, которое сохраняется до тех пор, пока поддерживается изоляция.
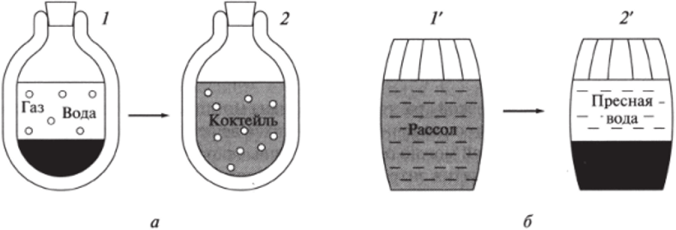
Рис. 5.4. Процессы перераспределения вещества: а — самопроизвольный процесс выравнивания концентраций в изолированной двухслойной системе.
6 — самопроизвольное гипотетическое опреснение; /, / '-исходные состояния, 2, 2'- конечные состояния Поскольку система изолированная, обмен энергией путем передачи теплоты, вещества и совершение работы не происходят. Следовательно, термодинамическая функция — внутренняя энергия Е системы — не меняется. В то же время очевидно, что состояние системы изменилось, так как компоненты внутри нее перераспределились. Это изменение — самопроизвольный переход из двухслойного состояния 1 с энтропией S в состояние 2 однородного раствора с энтропией S2 (рис. 5.4, а) — как раз и характеризуется увеличением энтропии: ДS = S2~S.
Любой самопроизвольный процесс может протекать в изолированной системе лишь в том случае, если он характеризуется увеличением энтропии; в равновесии энтропия системы постоянна:
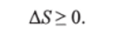 (5.4).
(5.4).
Это утверждение, основанное на экспериментальных наблюдениях, является одной из возможных формулировок 2-го начала термодинамики.
Процесс, обратный самопроизвольному, согласно 2-му началу термодинамики в изолированной системе протекать не может, поскольку такой процесс характеризуется уменьшением энтропии. В частности (рис. 5.4, а), из повседневного опыта хорошо известно, что обратный процесс перехода от равномерно окрашенного раствора — «коктейля» (состояние 2) к двухслойной системе (состояние 1) не происходит. Осуществление такого процесса означало бы, например, возможность самопроизвольного опреснения в бочке с соленой водой (рис. 5.4, б). Хотя в принципе такой процесс не противоречит 1-му началу термодинамики, нетрудно представить, что в результате теплового движения ионы солей соберутся в одной половине сосуда.
В молекулярных системах число возможных расположений молекул огромно и быстро возрастает с увеличением количества вещества и размеров системы. Весьма существенно, что любому из этих расположений отвечает одно и то же значение внутренней энергии Е системы. Внутренняя энергия, по определению, складывается из энергий индивидуальных молекул, или, как говорят в физике, внутренняя энергия распределяется по отдельным молекулам и разным расположениям.
Каждому расположению молекул отвечают различные распределения внутренней энергии Е системы по составляющим ее частицам. Очевидно, что чем больше вариантов распределения данной энергии, тем более неупорядоченна хаотична система. На этом основании австрийский физик Л. Больцман в 1872 г. предложил статистическую трактовку понятия энтропии системы:
«?Энтропия системы есть мера неупорядоченности, хаотичности системы.
На основе статистической трактовки Больцмана можно теоретически рассчитать абсолютные значения энтропии кристаллизующихся веществ, в отличие от внутренней энергии ?, для которой можно определить лишь относительные значения.
Важное значение понятия энтропии связано с тем, что на основе этой величины можно прогнозировать направление самопроизвольного протекания процессов. Однако применимость изменения энтропии как критерия направленности процессов ограничивается изолированными системами в соответствии с формулировкой.
2-го начала термодинамики (5.4).
Для неизолированных, т. е. закрытых и открытых, систем изменение энтропии, как и изменение внутренней энергии, уже не является критерием самопроизвольности.
Пример 1. При кристаллизации воды с образованием льда в закрытом сосуде (см. рис. 5.3) вода в результате теплоотдачи во внешнюю среду переходит из неупорядоченного жидкого состояния в упорядоченное кристаллическое. При этом образование каждых 18 г (1 моль) льда сопровождается уменьшением энтропии системы ДS = -22 кДж/К, т. е. хотя процесс самопроизвольный, энтропия убывает на AS начала термодинамики (5.4), поскольку она справедлива только для изолированных систем.
В качестве критерия самопроизвольности процессов в открытых и закрытых системах вводится функция состояния — энергия Гиббса. Эта функция получила название в честь великого американского физика Д. У. Гиббса (1839−1903), который использовал ее для описания свойств термодинамических систем.
Энергия Гиббса G определяется через внутреннюю энергию Е и энтропию S с помощью соотношения.

Если процесс протекает обратимо при постоянных давлении р и температуре Т (такие процессы называют изобарно-изотермическими), соответствующее приращение энергии Г иббса равно.

На основе энергии Г иббса 2-е начало термодинамики можно сформулировать следующим образом.
-?В изобарно-изотермических условиях (р, Г = const) в системе самопроизвольно могут осуществляться только такие процессы, в результате которых энергия Гиббса системы уменьшается (AG < 0). В состоянии равновесия энергия Гиббса системы не меняется (G = const, AG = 0):

В рассмотренных выше примерах ионизации уксусной кислоты, реакциях альбумина и окисления органических соединений энергия Гиббса системы уменьшается (AG < 0) и процессы осуществляются самопроизвольно. Изменение внутренней энергии АЕ имеет при этом различные знаки. Исходя из выражения (5.6), можно сделать вывод, что в первых двух случаях энтропия системы возрастает (А5> 0).
Энергия Гиббса позволяет решить вопрос о расчете максимальной работы 1Гмакс, которую может совершить система, расходуя внутреннюю энергию АЕ, и рассчитать теоретический коэффициент полезного действия timbkc = WMMJAE. Это особенно важно для оценки нагрузок, рациона питания при физических упражнениях и прогнозирования направления самопроизвольных процессов в организме.
Исходя из математических выражений (5.1) и (5.4) для 1-го и 2-го начал термодинамики, можно доказать следующее положение.
-?В изобарно-изотермических условиях (р, Т = const) максимальная работа -1VMMC, которая может быть осуществлена системой в данном процессе сверх работы расширения, равна убыли энергии ГиббсаAG, если процесс обратимый, и меньшеAG, если процесс необратимый:

Величина WUMC по абсолютному значению равна полной работе, которая может быть совершена системой при данном процессе, за вычетом работы расширения, равной pAV. С учетом неравенства (5.8) максимально достижимый при обратимом процессе коэффициент полезного действия равен 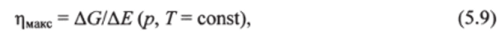
где AG и АЕ — изменения энергии Гиббса и внутренней энергии системы при нагрузке.
Коэффициент полезного действия при произвольном изобарно-изотермическом процессе подчиняется неравенству.

Неравенство (5.10) может служить еще одним математическим выражением 2-го начала термодинамики для неизолированных систем.
Из изложенного вытекает, что энергия Гиббса G играет большую роль для изучения биоэнергетических процессов. С помощью этой функции состояния можно прогнозировать направление самопроизвольных процессов в биологических системах и рассчитывать максимально достижимый КПД.
Энергия Гиббса G является функцией (энергетической) состояния системы, поэтому ее изменение AG может использоваться для характеристики химических превращений. Уравнения реакций, для которых указывается соответствующее этим реакциям изменение энергии Гиббса, называются термохимическими.
Химические реакции, при протекании которых происходит уменьшение энергии Г иббса системы (AG < 0) и совершается работа, называются экзергоническими. Реакции, в результате которых энергия Г иббса возрастает (АО' > 0) и над системой совершается работа, называются эндергоиическими. Экзергонические реакции лежат в основе энергетического обеспечения жизнедеятельности организма, в том числе физических нагрузок.
Пример 2. Окисление глюкозы СбН^Об дикислородом Ог сопровождается уменьшением энергии Г иббса A G = -2880 кДж/моль, т. е. этот процесс экзергонический. Именно в результате этой реакции осуществляются различные виды работы в организме человека. С помощью формулы (5.9) можно рассчитать максимальный коэффициент полезного действия данного процесса.
Убыль внутренней энергии системы в результате окисления глюкозы примерно равна убыли энтальпии: АЕ ~ Qcrop = -2880 кДж/моль (Qcгор — теплота сгорания глюкозы). Следовательно, в соответствии с формулой (5.9) максимальный коэффициент полезного действия равен.
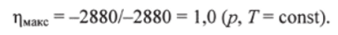
В действительности ц равен примерно 0,4, т. е. приблизительно 60% энергии, запасенной в глюкозе, рассеивается в виде теплоты (см. рис 5.2).
Поскольку выведенная на основе 2-го начала термодинамики энергия Гиббса является функцией состояния, то на основе 1-го начала термодинамики может быть сформулирован закон Гесса для энергии Г иббса в следующей форме.
-^-Изменение энергии Гиббса в реакции AG^., образования заданных продуктов из данных реагентов при постоянных давлении и температуре не зависит от числа и вида реакций, в результате которых образуются эти продукты.
Именно на этом законе основан теоретический расчет «калорийности» — энергоотдачи различных продуктов питания с помощью таблиц термодинамических данных по теплоте сгорания и образования различных веществ (см. Приложение).
Важный пример применения закона Гесса — расчет энергии Гиббса реакции окисления глюкозы СбН^Об дикислородом О2. Изменение энергии Гиббса в этой реакции при р=101кПа и Т= 298 К, определенное вне организма, равно.
AG° = -2880 кДж/моль. Соответствующее термохимическое уравнение записывается в виде.
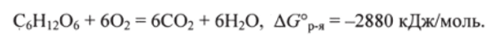
В клетках организма эта реакция осуществляется через ряд последовательных стадий, изученных биохимиками. Можно предсказать, исходя из закона Гесса, что сумма изменений энергий Гиббса во всех промежуточных реакциях равна AG0p.:
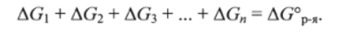
Это предсказание хорошо согласуется с экспериментальными данными, что иллюстрируется диаграммой Гиббса (рис. 5.5, а). На этой диаграмме отложены уровни энергии Гиббса, соответствующие исходным реагентам — глюкозе и дикислороду, а также промежуточным продуктам — интермедиатам: фруктозофосфату, лактату, пирувату и др. Расстояние между уровнями определяется величинами AGi, AG2, AG3, …
Суммарная высота энергетических ступеней между начальным и конечным уровнями (высота лестницы между нижним и верхним «этажами») одинакова независимо от числа ступеней. Отсюда можно сделать вывод, что для реакции а + ЬВ = сС + сЮ справедливо следствие закона Гесса для энергии Гиббса:
Энергия Гиббса реакции AGp." равна алгебраической сумме энергий Гиббса образования стехиометрического количества продуктов за вычетом алгебраической суммы энергий Гиббса образования стехиометрического количества реагентов:
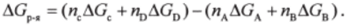
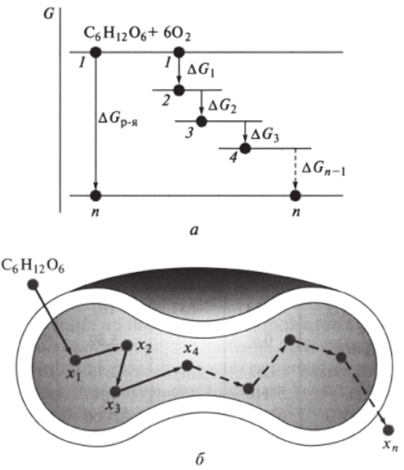
Рис. 5.5. Диафамма изменений энергии Г иббса (а) в последовательных стадиях биоокисления глюкозы в эритроците (б) (1−4 — уровни энергии системы) Экспериментально определенные энтальпии образования Q,° и энергии Гиббса AG/° различных биогенных веществ X, в стандартных условиях (р= 101 кПа, Т = 298 К) сведены в таблицы (табл. 5.1). С помощью этих табличных данных на основе закона Гесса можно проводить биоэнергетические расчеты для большого числа биохимических реакций и прогнозировать их протекание.
Таблица 5.1
Стандартные значения теплоты образования О" , энергия Гиббса образования AG° и абсолютная энтропия S различных веществ при 298,1 К.
Вещество. | <�г. К‘Лж/М0.1Ь. | Л (7°, кДж/. моль. | 5°,. Лж/(моль'К). | Вещество. | Qв. кДж/моль. | ЛС°, кДж/. моль. | S°,. Дж/(моль'К). |
Н* (водн.). | 0,0. | 0,0. | 0,0. | С2Н2 (г). | |||
Н30* (водн.). | — 286. | — 237. | 69,9. | С2Н4 (г). | 52,3. | 68,1. | |
Н2(г). | 0,0. | 0,0. | С2Н6(г). | — 84,7. | — 32,9. | ||
Li (т). | 0,0. | 0,0. | 28,0. | СбН6 (ж). | 49,0. | ||
Li* (водн.). | — 278. | — 294. | нсоон. (волн.). | — 410. | — 356. | ||
LiCl (т). | — 409. | — 384. | 55,2. | НСОО (водн.). | — 410. | — 335. | |
Na (т). | 0,0. | 0,0. | 51,0. | Н2С03 (водн.). | — 699. | — 623. | |
Na* (водн.). | — 240. | — 262. | 60,2. | НС03«(водн.). | — 691. | — 587. | |
Na20 (т). | — 416. | — 377. | С032 (водн.). | — 676. | — 528. | — 53. | |
NaCI (т). | — 411. | — 384. | 72,4. | СН3СООН. (водн.). | — 488. | — 400. | ; |
К (т). | 0,0. | 0,0. | 63,6. | СН3СОО. (водн.). | — 486. | — 369. | |
К* (водн.). | — 251. | — 282. | СН3ОН (ж). | — 239. | — 166. | ||
КС1 (т). | —436. | — 408. | 82,7. | С2Н5ОН (ж). | — 278. | — 175. | |
Mg (т). | 0,0. | 0,0. | 32,5. | СН3СНО (т). | — 166. | — 134. | |
Mg2* (водн.). | — 462. | — 456. | — 118. | СбН|2Об (т). | — 1260. | — 919. | |
MgCI2 (т). | — 642. | — 542. | 89,5. | РЬ2* (водн.). | 1,6. | — 24,3. | |
Са (т). | 0,0. | 0,0. | 41,6. | NH3®. | — 46,2. | — 16,6. | |
Са2* (водн.). | — 543. | — 553. | — 55,2. | NH3 (водн.). | — 80,8. | 26.6. | ПО. |
СаС12 (т). | — 795. | — 750. | NH4* (водн.). | — 133. | — 79,5. | ||
CaCOj (т). | — 1207. | — 1129. | 92,9. | NI14C1 (т). | — 315. | — 204. | |
Гс2>(водн.). | — 87,9. | — 84.9. | — 113. | nh2conh2 (т). | — 333. | — 197. | |
Fc3* (водн.). | — 47,7. | — 10,6. | — 293. | 02(г). | 0,0. | 0,0. | |
Си2* (водн.). | 64,4. | 65,0. | — 98,7. | 03 (г). | |||
CuS04 (т). | — 770. | — 662. | ИЗ. | ОН (водн.). | — 230. | — 157. | — 10,5. |
А13* (водн.). | — 525. | — 481. | — 313. | Н20 (ж). | — 286. | — 237. | |
А1СЬ (т). | — 653. | — 637. | Н202 (ж). | — 188. | — 114. | ||
С (т), графит. | 0,0. | 0,0. | 5,69. | F (водн.). | 76,6. | 59,4. | |
С (т). алмаз. | 1,83. | 2,83. | 2,36. | СГ (водн.). | — 167. | — 131. | |
СО (г). | — ПО. | — 137. | НС1(водн.). | — 167. | — 131. | ||
С02 (г). | — 393,5. | — 394,4. | 213,6. | Г (водн.). | — 56. | — 52. | |
С02 (водн.). | — 413. | — 386. | S042- (водн.). | — 909. | — 744. | 18,2. | |
СН4(г). | — 74.8. | — 50,8. | S (т), ромбич. | 0,0. | 0,0. | 31,9. |