Фазы в металлических сплавах

Химические соединения (промежуточные фазы) образуются между компонентами, имеющими большое различие в электронном и кристаллическом строении, а также в размерах атомов; тип кристаллической решетки отличается от типов кристаллических решеток чистых компонентов. В соединении АтВп (тип — простые целые числа, А и В компоненты), как правило, сохраняется простое кратное соотношение компонентов… Читать ещё >
Фазы в металлических сплавах (реферат, курсовая, диплом, контрольная)
В металловедении широко используются понятия — фаза, система фаз, структура, структурная составляющая.
Сплавы получают путем сплавления, спекания или одновременного осаждения из газовой фазы отдельных компонентов, которые, вступая во взаимодействие друг с другом, образуют фазы — новые однородные части системы, имеющие свой тип кристаллической решетки, состав, свойства и отдельную от других частей системы поверхность раздела.
Переход вещества из одной фазы в другую — фазовый переход — связан с качественным изменением свойств вещества. Например, газовое, жидкое и кристаллическое состояния (фазы) вещества существенно различаются характером движения частиц (молекул), при высоких температурах и давлениях вещество переходит в состояние плазмы. Кристаллические фазы могут отличаться друг от друга электропроводностью, наличием электрического или магнитного момента, типом кристаллической структуры и т. д.
Жидкие фазы отличаются друг от друга концентрацией компонент, наличием или отсутствием свойства сверхтекучести (у жидких 3Не и4 Не), анизотропией упругих и электрических свойств (у жидких кристаллов) и т. д.
Система фаз — образования из двух или большего числа фаз, находящихся в состоянии равновесия.
Структура (лат. structura — строение, расположение) — определенная взаимосвязь, взаиморасположение составных частей; строение, устройство соответствующих фаз в металлах или сплавах.
Структурная составляющая — часть сплава, возникающая при каком-либо фазовом превращении, характеризуется одинаковым средним химическим составом, однообразным расположением и формой зерен образующих ее фаз. Микроструктура может состоять из одной фазы (например, в чистом железе, в закаленной стали) или нескольких структурных составляющих (например, перлит и вторичный цементит в заэвтектоидной стали).
В зависимости от характера физико-химического взаимодействия компонентов, могут образовываться следующие фазы: жидкие растворы, твердые растворы, химические соединения. При отсутствии в системе взаимодействия компонентов фазами будут чистые компоненты (например, система Fe — Pb).
Жидкие растворы — макроскопически однородные двухил и многокомпонентные фазы переменного состава, в которых при данных внешних условиях соотношение компонентов (атомов или ионов) может непрерывно меняться в некоторых пределах. Упорядоченность во взаимном расположении атомов или молекул соответствует ближнему порядку (см. рис. 4.2), характерному температуре жидкости.
Твердые растворы (обозначаются малыми буквами греческого алфавита а, у, 5, е,…) — твердые переменного состава, в которых атомы различных элементов смешаны в известных пределах в общей кристаллической решетке (рис. 4.9) с упорядоченностью, повторяющейся на неограниченно больших расстояниях (дальний порядок). Примесные атомы или атомы легирующих элементов могут образовывать в кристаллической решетке растворителя твердые растворы замещения, или твердые растворы внедрения.
В твердых растворах замещения (с неограниченной или ограниченной взаимной растворимостью) атомы растворенного компонента В замещают атомы основного компонента-растворителя А в узлах кристаллической решетки. Микроструктура не отличается от микроструктуры чистого компонента (например, ферритные зерна на рис. 2.9).
В соответствии с полуэмпирическими правилами ЮмРозери твердые растворы замещения образуются лишь теми атомами, которые:
• имеют близкие по размерам радиусы (отличающиеся не более чем на 15%, а для твердых растворов на основе Fe — не более чем на 8%);
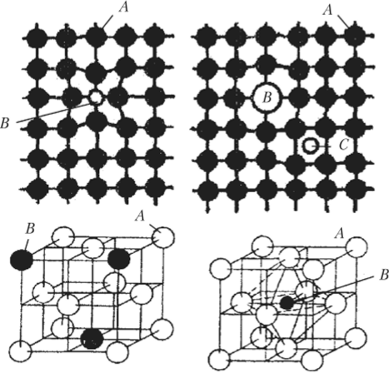
Рис. 4.9. Расположение атомов компонентов В и С в кристаллической решетке компонента-растворителя А.
• электрохимически подобны, т. е. обладают одинаковым (изоморфным) типом кристаллической решетки компонентов.
Твердые растворы внедрения (только с ограниченной взаимной растворимостью) образуются в тех случаях, когда размеры атомов компонентов существенно отличаются друг от друга и возможно внедрение атомов одного сорта (В) в поры (междоузлия) кристаллической решетки, образованной атомами другого сорта (Л). Чаще всего твердые растворы внедрения образуют переходные металлы — Мп, Со, Ti, Mo, W, V, Zr и др. с металлоидами — С, N, О, Н. Промышленное значение имеют, например, твердые растворы внедрения углерода в железе — FeaH Fey.
Твердые растворы как замещения, так и внедрения могут быть либо неупорядоченными — со статистическим распределением атомов в решетке, либо частично или полностью упорядоченными — с определенным расположением атомов разного сорта относительно друг друга.
Химические соединения (промежуточные фазы) образуются между компонентами, имеющими большое различие в электронном и кристаллическом строении, а также в размерах атомов; тип кристаллической решетки отличается от типов кристаллических решеток чистых компонентов. В соединении АтВп (тип — простые целые числа, А и В компоненты), как правило, сохраняется простое кратное соотношение компонентов. Температура плавления химического соединения постоянна, свойства резко отличаются от свойств образующих его веществ.
В химических соединениях металлов между собой (интерметаллидах) преобладает металлическая связь, поэтому состав таких промежуточных фаз обычно не отвечает формальной валентности их компонентов и может изменяться в значительных пределах. Рассмотрим наиболее важные разновидности интерметаллидов.
- • Фазы внедрения образуют переходные металлы и неметаллы с малым атомным радиусом — С, N, В, Н — карбиды, нитриды, бориды; формула — Ме4Х (Fe4N, Mn4N), Ме2Х (W2C, Fe2N и др.). В образовании простой кубической или гексагональной решетки (отличная от решетки компонентов) решающую роль играет передача валентных электронов атомами металла атомам неметаллических элементов, в результате чего образуются ионы с внешними перекрывающимися р6-о6олочками. На базе решеток фаз внедрения образуются твердые растворы вычитания.
- • Фазы Лавеса с формулой ЛВ2 образуются между компонентами А и В при соотношении атомных диаметров Da/Db — 1,1—1,6; кристаллическая решетка ГПУ (MnZn2, MgNi2) или ГЦК (TiBe2, TiCr2, FeW2, FeMo2).
- • Электронные соединения (фазы Юм-Розери) имеют определенное соотношение числа валентных электронов и числа атомов в кристаллической ячейке (определенную электронную концентрацию). Они образуются между одновалентными (Си, Ag, Аи, Li, Na), переходными (Fe, Mn, Со и др.) и простыми металлами с валентностью от 2 до 5 (Be, Mg, Zn, А1 и др.) в результате обменного взаимодействия орбиталей внешних р6-, d6- и г/4+6-оболочек их металлических катионов, расщепляющихся и перекрывающихся вследствие взаимодействия с электронным газом, образующимся из коллективизированных валентных электронов. Существуют соединения с электронными концентрациями 3/2 — CuBe, Cu3Si, Cu3Ga; 21/13 — Cu5Zn8 и 7/4 — CuZn3. Каждому соотношению соответствует определенный тип кристаллической решетки.
Полиморфизм (от греч. polymorphos — многообразный) — существование вещества в состояниях с различной атомной кристаллической структурой —открыт в 1798 г., когда было обнаружено, что СаС03 может существовать в виде двух минералов — кальцита и арагонита (рис. 4.10).
Полиморфизмом обладают простые вещества, а также неорганические и органические соединения. Так, углерод имеет две модификации, кубическую (алмаз) и гексагональную (графит), резко различающиеся по физическим свойствам. Белое олово, имеющее тетрагональную объемно-центрированную решетку — пластичный металл, а серое олово.

Рис. 4.10. Друзы кальцита (а) с кристаллами различной формы и окраски и арагонит (б) с игольчатой формой кристаллов и более высокой степенью растворимости в воде.
(низкотемпературная модификация с алмазоподобной тетрагональной решеткой) хрупкий полупроводник. Некоторые соединения, например Si02, имеют более двух полиморфн ых модификаций.
Кристаллические структуры в одном и том же металле, но при разных температурах называют полиморфными модификациями и обозначают малыми буквами греческого алфавита: устойчивую при более низкой температуре — буквой a (Fea), при более высокой — р, далее — у (Fey) и т. д. Различие в структуре обусловливает и различие в свойствах.
Переход чистого металла из одной полиморфной модификации в другую в условиях равновесия может происходить как по диффузионному, так и бездиффузионному механизму, протекает при постоянной температуре и сопровождается выделением (при охлаждении) или поглощением (при нагреве) тепла.
При диффузионном превращении зародыш новой модификации чаще всего возникает на границах кристаллов старой модификации, а последующий его рост связан с переходом атомов через границу фаз. Например, при небольших переохлаждениях (и перегревах) перестройка решеток железа a &# у осуществляется в результате неупорядоченных индивидуальных переходов атомов от исходной фазы к образующейся (рис. 4.11, а).
При больших скоростях охлаждения или нагревания, когда диффузия компонентов подавлена, полиморфные превращения твердых растворов происходят бездиффузи;

Рис. 4.11. Примеры микроструктур с полиморфным превращением:
а — полиморфное превращение в чистом железе — видны бывшие границы Fey (X 150); б — мартенситная структура в высокоуглеродистой стати, (х 500); в — видманштеттова структура в углеродистой стати (х 100) онным путем — новая модификация кристаллической решетки образуется за счет сдвига по определенным кристаллографическим плоскостям и направлениям на расстояния меньше межатомного. Образуется «игольчатая» структура (рис. 4.11, б, в) мартенситного типа, по имени немецкого металловеда А. Мартенса (A Martens; 1850—1914), или видманштеттного типа, впервые обнаруженная австрийским ученым А. Видманштеттеном (A Widmannstatten) в начале XIX в. при изучении железо-никелевых метеоритов.
Контрольные вопросы и задания
- 1. Объясните особенности строения жидкой фазы.
- 2. Что такое фазовое равновесие, его условия?
- 3. Что такое степень переохлаждения Г?
- 4. Что такое критический зародыш, от чего зависит его размер?
- 5. Объяснить гомогенное и гетерогенное образование зародыша.
- 6. Что такое модификаторы и для чего их применяют?
- 7. Что такое дендрит? Как и почему образуются дендриты?
- 8. Что такое аморфные материалы и как их получают?
- 9. Теоретическая температура плавления свинца 327 °C.
К началу кристаллизации жидкий металл переохладили до 200 °C. Чему равна степень переохлаждения At?
- 10. Температура кристаллизации меди — 1090 °C. Один слиток меди затвердевал с переохлаждением 100 °C, другой — 500 °C. Зарисуйте и объясните схему образовавшейся структуры слитка.
- 11. Приведите примеры известных вам сплавов, определите число компонентов в них.
- 12. Что называется фазой в металлических системах?
- 13. Что такое полиморфные модификации, полиморфное превращение?