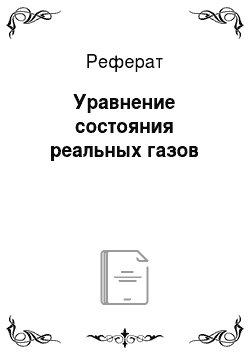
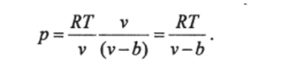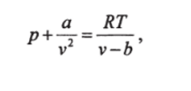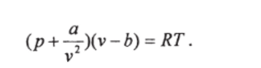Другие работы

Почему в схемах замещения нулевой последовательности трансформаторов со схемой соединения обмоток У0/Д обмотка, соединенная в Д, имеет нулевой потенциал? Для какой конструкции трансформаторов сопротивление цепи намагничивания нулевой последовательности принимается равным бесконечности? Как в схеме замещения нулевой последовательности учитывается сопротивление, включенное в нейтраль обмоток…
Реферат 
Уникальным примером преимуществ объединения станций в систему служит единая энергосистема СССР, включающая 11 объединенных энергосистем. Мощное территориальное объединение обеспечило большие преимущества при функционировании энергосистемы, но особенно при ее развитии. Мощности ЕЭС СССР наращивались в основном за счет крупных электростанций с уникальными параметрами. Мощность энергоблоков КЭС…
Реферат 
Обозначение проволоки, применяемой для сварки черных металлов, расшифровывается следующим образом: Св — сварочная (содержание серы или фосфора не более 0,04%); первое число — содержание углерода в сотых долях процента; заглавными буквами обозначают легирующие элементы (марганец — Г, кремний — С, хром — X, никель — Н, молибден — М, вольфрам — В, селен — Е, алюминий — Ю, титан — Т, ниобий — Б…
Реферат 
Общая тенденция устранения проводных соединений привела к идее — обеспечить подобную же радиосвязь. Однако одновременная связь миллионов людей по радио немыслима из-за нехватки радиочастот. Тогда зародилась новая идея — осуществление связи абонентов на одних и тех же частотах. Идея оказалась плодотворной благодаря разделению пространства на отдельные ячейки (cellular), или соты. Радиус соты может…
Реферат 
Механизм собран на цилиндрическом барабане 22 (рис. 108, б), установленном на подшипниках в корпусе 12 заднего моста. Снаружи к барабану прикреплена ведомая коническая шестерня главной передачи 9, а внутри имеются два зубчатых венца коронных шестерен 23 (короны). На осях сателлитов 29, закрепленных на водилах 28, свободно надеты сателлиты 27, находящиеся в зацеплении с коронной 23 и одновременно…
Реферат 
Первичная обмотка выполнена из провода диаметром 0,7… 1 мм, число витков 150… 300; вторичная обмотка — из И… 13 тыс. витков провода диаметром 0,07 мм. Оба провода изолированы. Если контакты прерывателя сомкнуты, то при вращении двухполюсного магнита в первичной обмотке создаётся ток небольшого напряжения (12… 15 В), который уходит на массу. В момент, когда кулачок 12 разрывает контакты…
Реферат 
В процессе эксплуатации судна его остойчивость меняется. Ряд факторов, влияющих на нее, мы уже затрагивали: расходование судовых запасов, в том числе топлива и воды, связанные с этим изменения свободных поверхностей в цистернах и танках и т. д. Все эти изменения происходят в течение длительного времени, а постоянно ведущийся на судне контроль за остойчивостью позволяет предотвратить се уменьшение…
Реферат 
Рис. 15.2. Схемы вариантов циклов силовых головок обозначен быстрый подвод силовой головки из общего исходного положения в промежуточное исходное положение, после чего начинается ее рабочая подача, обозначенная, как и на рис. 15.2, цифрой 2. По достижении некоторого первого промежуточного рабочего положения осуществляется быстрый отвод силовой головки в промежуточное исходное положение, что…
Реферат 
Одной из основных проблем при использовании пьезоэлектрических преобразователей является снятие и передача сигнала с обкладок датчика, тем более она усиливается, когда возрастает количество точек контроля. Поэтому был разработан и создан четырех канальный пьезотрон, который состоит из базового дифференциального виброакселерометра для динамических испытаний строительных конструкций, цепей…
Реферат 
Раскалывание твердого тела происходит по двум различным механизмам: во-первых, под действием касательных напряжений в результате процесса скольжения (раскол в результате скольжения) и, вовторых, при разрывных воздействиях (быстрый «хрупкий» излом). То, какой из процессов имеет место при механической обработке — скользящий раскол или хрупкий излом, зависит от природы напряженного состояния…
Реферат 
Схема градирни с естественной циркуляцией воздуха дана на рис. 8.20. Охлаждающая вода, прошедшая конденсатор, стекает на оросительное устройство /, представляющее собой при капельной конструкции систему горизонтальных брусков с малыми зазорами между ними. Проходя оросительное устройство, вода разбрызгивается на мелкие капли, охлаждаемые движущимся навстречу воздухом, поступающим через жалюзи…
Реферат 
Однодисковое фрикционное сцепление, а — включено; б — выключено; 1 — кожух; 2 — нажимной диск; 3 — маховик; 4 — ведомый диск; 5 — пластина; 6 — пружина; 7 — подшипник; 8 — педаль; 9 — вал; 10 — тяга; 11 — вилка; 12 — рычаг Ведущими деталями являются маховик 3 двигателя, кожух 1 и нажимной диск 2, ведомыми — ведомый диск 4, деталями включения — пружины 6, деталями выключения — рычаги 12 и муфта…
Реферат 
Датчик глубины (глубиномер) служит для непрерывного определения глубины забоя скважины по инструменту, положения долота (конца инструмента) в скважине при проведении СПО, положения талевого блока, вычисления скорости бурения и спуско-подъемных операций, мгновенной скорости подачи и т. д. Он использует данные датчика углового положения вала буровой лебедки, а также возможно датчиков веса на крюке…
Реферат 
На Втором специализированном совещании по правилам полетов и управлению воздушным движением, проходившем в декабре 1946 г. — январе 1947 г., документ Doc 2010 был пересмотрен, были внесены предложения по Стандартам и Рекомендуемой практике, относящимся к правилам полетов. Эти предложения были приняты Советом ИКАО 15 апреля 1948 г. в качестве Стандартов и Рекомендуемой практики, относящихся…
Реферат 
В транзисторной биполярной интегральной схемотехнике четко прослеживается принцип дискретности, так как в топологии четко видны отдельные транзисторы и резисторы. Дискретизация является следствием необходимости изоляции транзисторов и резисторов с помощью изолирующих карманов (блочный принцип построения схем), которые, в принципе, при другой схемотехнике (переходной) являются лишними. Таким…
Реферат