Реакции обнаружения анионов второй аналитической группы

Описание опыта. В пробирку помещают несколько капель 0,1%-ного водного раствора фуксина и обесцвечивают их, прибавляя твердый NaHSO:3 и 1—2 капли концентрированной (12 н) соляной кислоты. Смачивают полученным раствором кусочек фильтровальной бумаги и прикрепляют к внутренней поверхности верхнего часового стекла. На нижнее стекло помещают 2—3 капли исследуемого раствора и 4—5 капель 25%-ного… Читать ещё >
Реакции обнаружения анионов второй аналитической группы (реферат, курсовая, диплом, контрольная)
Вторая группа объединяет СГ, Br, I, S2' и некоторые другие анионы, образующие с катионом серебра соли, нерастворимые в воде и в разбавленной азотной кислоте.
Групповой реагент для этой аналитической группы — нитрат серебра AgN03 в присутствии разбавленной азотной кислоты. Бариевые соли этих анионов в воде растворимы.
Большинство хлоридов растворимо в воде, исключение составляют соли серебра, одновалентной ртути и свинца. Анионы СГ бесцветны.
Л) Реакция с групповым реагентом
Нитрат серебра образует с ионом С1 белый творожистый осадок хлорида серебра: 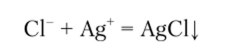
постепенно темнеющий на свету из-за выделения свободного серебра. Осадок нерастворим в кислотах, но легко растворяется в гидроксиде аммония с образованием хлорида диаминсеребра (Т) [Ag (NH3)2]Cl. При подкислении раствора азотной кислотой комплексный ион разрушается вследствие образования более прочного катиона аммония, и хлорид серебра снова выпадает в осадок: 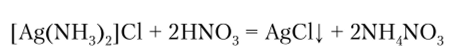
Описание опыта. К 4—5 каплям раствора хлорида натрия прибавляют.
- 2—3 капли раствора нитрата серебра. К образовавшемуся осадку хлорида серебра добавляют по каплям раствор гидроксида аммония до полного растворения. Затем прибавляют несколько капель азотной кислоты до появления мути хлорида серебра. Если помимо хлорида серебра в осадке присутствуют бромид и иодид, то при действии гидроксида аммония последний практически не растворяется, так как имеет очень небольшую величину произведения растворимости (1,5−10 |6). У бромида серебра произведение растворимости несколько выше (7,7 • 10 13), и он заметно растворим в гидроксиде аммония. Однако растворимость его можно понизить, если вместо гидроксида аммония воспользоваться раствором карбоната аммония. Вследствие гидролиза последнего концентрация NH4OH настолько мала, что бромид серебра почти не растворяется. Таким образом, удается центрифугированием отделить растворимый [Ag (NH;i)2]Cl от осадка бромида и иодида серебра. Появляющаяся при добавлении к центрифугату нескольких капель раствора бромида калия обильная желто-белая муть свидетельствует о присутствии в растворе аниона СГ.
- Б) Реакция с сильными окислителями
Сильные окислители (КМп04, КСЮ3, К2Сг207 идр.) в кислой среде окисляют анион СГ до свободного хлора.
В качестве окислителя обычно используют Мп02:
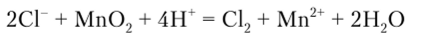
Описание опыта. К 2—3 каплям раствора хлорида натрия добавляют немного твердого Мп02, 1—2 капли концентрированной серной кислоты и нагревают. Следует обратить внимание на цвет и запах выделяющегося газа. К отверстию пробирки подносят бумагу, пропитанную иодидом калия и крахмалом, и наблюдают изменение ее окраски.
Бромид-ион (Вг)
Ионы Вг бесцветны. Нерастворимы в воде бромиды серебра, свинца и ртути (1).
A) Реакция с групповым реагентом
Нитрат серебра дает с ионом Вг желтоватый осадок бромида серебра:

Осадок нерастворим в азотной кислоте, карбонате аммония, но растворяется в избытке гидроксида аммония с образованием комплексного соединения. Под действием цинковой пыли, в присутствии воды или 2 н серной кислоты бромид серебра разлагается:
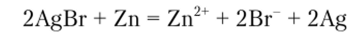
Выделяющееся серебро образует черный осадок, а ион Вг переходит в раствор, где и может быть обнаружен.
Описание опыта. К 5—6 каплям раствора бромида калия прибавляют 2—3 капли раствора нитрата серебра и центрифугируют осадок. К полученному осадку бромида серебра добавляют 5—6 капель воды, немного цинковой пыли и перемешивают стеклянной палочкой. Затем осадок центрифугируют и в цеитрифугате снова определяют Вг одной из реакций.
Б) Реакция с сильными окислителями
Сильные окислители окисляют в кислой среде Вг" до свободного брома. Чаще всего окислителем служит хлорная вода:
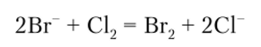
Описание опыта. Подкисливают 2—3 капли раствора бромида несколькими каплями 2 н раствора серной кислоты (в щелочной среде бром переходит в бесцветные соединения), прибавляют 1—2 капли свежеприготовленной хлорной воды и 2—3 капли бензола. Содержимое пробирки встряхивают. Бензол, в котором бром растворяется лучше, чем в воде, приобретет красновато-бурый цвет.
B) Фуксиновая проба
Описание опыта. В пробирку помещают несколько капель 0,1%-ного водного раствора фуксина и обесцвечивают их, прибавляя твердый NaHSO:3 и 1—2 капли концентрированной (12 н) соляной кислоты. Смачивают полученным раствором кусочек фильтровальной бумаги и прикрепляют к внутренней поверхности верхнего часового стекла. На нижнее стекло помещают 2—3 капли исследуемого раствора и 4—5 капель 25%-ного раствора хромовой кислоты, после чего накрывают второе стекло первым и в течение 10 мин нагревают над водяной баней. Бумага постепенно окрашивается в красно-фиолетовый цвет.
Реакция очень чувствительна и позволяет обнаружить даже очень малые количества Вг в присутствии С1 и Г.
Иодид-иоп (I)
Из иодидов нерастворимы в воде Agl, РЫ2, Hgl2, Hg2I2, Cul. Ион I бесцветен.
Л) Реакция с групповым реагентом
Нитрат серебра образует с ионом Г бледно-желтый творожистый осадок иодида серебра. Осадок нерастворим в азотной кислоте и в гидроксиде аммония, но может быть переведен в раствор добавлением тиосульфата натрия: 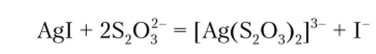
От действия цинковой пыли в присутствии воды или 2 н раствора серной кислоты иодид серебра, как и бромид, разлагается с выделением серебра. Реакцию выполняют так же, как на ион ВГ.
Б) Реакция с окислителями
Анион иода гораздо легче окисляется, чем анионы хлора и брома. Даже такие слабые окислители, как Fe3+ или Си2+, выделяют свободный иод из иодидов. Особенно часто в аналитической практике используют действие на иодиды хлорной воды и нитритов.
1. Хлорная вода легко вытесняет свободный иод из иодидов:
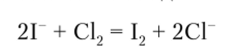
Если при этом к раствору прилить бензол и встряхнуть смесь, то органический растворитель окрашивается иодом в фиолетовый цвет. Малые количества выделившегося иода обнаруживают реакцией с крахмальным клейстером.
Описание опыта. Реакцию проводят в растворе, подкисленном 2 н серной кислотой, так как в щелочной среде окраска иода обесцвечивается. Хлорную воду прибавляют к исследуемому раствору осторожно, по каплям, так как ее избыток окисляет выделившийся иод до бесцветных продуктов. При одновременном присутствии в растворе анионов иода и брома хлорная вода сначала окисляет I. Дальнейшее прибавление реагента приводит к обесцвечиванию фиолетовой окраски бензольного слоя вследствие окисления иода. После этого начинается выделение брома, окрашивающего бензольный слой в красно-бурый цвет. Реакция служит для обнаружения анионов иода и брома при их совместном присутствии.
2. Нитрит калия или натрия также окисляет I в кислой среде до свободного иода: 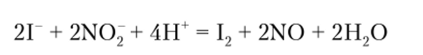
Выделившийся иод обнаруживают по посинению крахмала или по окрашиванию бензола в фиолетовый цвет.
Анионы брома в противоположность анионам иода нитритами не окисляются.
Описание опыта. К 1—2 каплям раствора иодида калия прибавляют столько же раствора нитрита калия, подкисляют полученный раствор 2 н раствором серной кислоты и добавляют 1—2 капли крахмального клейстера.
Таким образом, анион хлора не мешает обнаружению анионов брома и иода реакцией с хлорной водой в присутствии бензола.
Нитриты в кислой среде выделяют из смеси анионов только свободный иод.
В отличие от анионов хлора и иода Вг дает сине-фиолетовое окрашивание с раствором фуксинсернистой кислоты.
Сульфид-ион (S2-)
В воде растворимы только сульфиды аммония, щелочных и щелочноземельных металлов, растворы которых бесцветны. Анион S2 является сильным восстановителем, поэтому присутствие его в растворе в больших концентрациях мешает определению других анионов 2-й группы.
A) Реакция с групповым реагентом
Нитрат серебра дает с анионом S" черный осадок сульфида серебра, нерастворимый в гидроксиде аммония, но растворяющийся при нагревании в разбавленной азотной кислоте.
Б) Реакция с нитропруссидом натрия
Нитропруссид натрия Na2[Fe (CN)5NO] дает с S2 характерную краснофиолетовую окраску вследствие образования комплексного соединения:
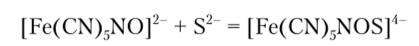
B) Реакция с солями кадмия.
Соли кадмия дают с S2 характерный ярко-желтый осадок CdS. Если его после отделения от раствора обработать 1—2 каплями раствора CnS04, то осадок почернеет вследствие образования CuS.
Образование сульфида кадмия используют для отделения аниона S2 от других анионов. Для этого исследуемый раствор обрабатывают твердым карбонатом кадмия. Затем раствор центрифугируют и осадок отбрасывают.