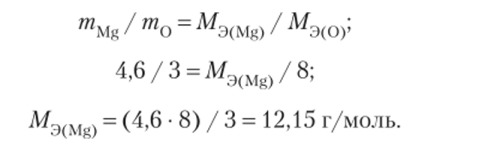Соблюдение законов постоянства состава и кратных отношений

В отличие от закона сохранения массы, законы постоянства состава и кратных отношений не являются всеобщими. В связи с открытием изотопов выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. При изменении изотопного состава элементов меняется и массовый состав соединений. Например, тяжелая… Читать ещё >
Соблюдение законов постоянства состава и кратных отношений (реферат, курсовая, диплом, контрольная)
В отличие от закона сохранения массы, законы постоянства состава и кратных отношений не являются всеобщими. В связи с открытием изотопов выяснилось, что соотношение между массами элементов, входящих в состав данного вещества, постоянно лишь при условии постоянства изотопного состава этих элементов. При изменении изотопного состава элементов меняется и массовый состав соединений. Например, тяжелая вода (D, 0) содержит ~ 20% Н2, а обычная вода (Н20) — только 11%.
В начале XX в. Н. С. Курнаков, изучая сплавы металлов, обнаружил наличие в них соединений переменного состава, в которых на единицу массы одного элемента приходится разная масса другого элемента. Например, в сплаве галлия (Tl) с висмутом (Bi) на одну единицу массы Т1 приходится от 1,24 до 1,82 единицы массы Bi.
Впоследствии было установлено, что соединения переменного состава встречаются не только в сплавах металлов, но и среди других твердых тел: оксидов, соединений металлов с серой, азотом, углеродом, водородом и т. д. Так, оксид титана (Н) имеет состав от ТЮ059 до TiOt 33 в зависимости от способа его получения.
По предложению Н. С. Курнакова вещества немолекулярного строения (с атомной, ионной или металлической решеткой), состав которых непостоянен и зависит от условий их получения, названы бертоллидами. Вещества молекулярного строения (состоящие из молекул), имеющие постоянный состав, названы далътонидами.
В связи с наличием соединений переменного состава в современную формулировку закона постоянства состава следует внести уточнение: состав соединений с молекулярной структурой является постоянным независимо от способа их полученияt в отличие от соединений с немолекулярной структурой.
Если не соблюдается закон постоянства состава, т. е. два элемента образуют друг с другом соединения переменного состава, то в этом случае не соблюдается и закон кратных отношений.
4. Закон объемных отношений (Гей-Люссак, 1808 г.): объемы газов у вступающих в химические реакции, и объемы газов у образующихся в результате реакции, относятся между собой как небольшие целые числа.
Следствие: стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Пример 1.10.
1. 2СО + 02 = 2С02
При окислении двух объемов оксида углерода (СО) одним объемом кислорода (02) образуются два объема диоксида углерода (С09), т. е. объем исходной реакционной смеси уменьшается на один объем.
2. N2 + ЗН2 = 2NH3
При синтезе аммиака (NH3) из азота (N2) и водорода (Н2) один объем азота реагирует с тремя объемами водорода, при этом образуются два объема аммиака, таким образом, объем исходной газообразной реакционной смеси уменьшится в два раза.
5. Закон Авогадро (1811 г.): в равных объемах различных газов при одинаковых условиях (температура, давление) содержится одинаковое число молекул.
Закон справедлив только для газообразных веществ.
Следствия: 1. Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
2. При нормальных условиях (0°С = 273 К, 1 атм = = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Пример 1.11. Согласно экспериментальным данным при нормальных условиях 1 л водорода (Н2) имеет массу 0,0899 г, а 1 л кислорода (02) — 1,4289 г. Вычислим объемы, занимаемые 1 молем каждого из этих газов при нормальных условиях.
Решение.
Молярная масса Н2 равна 2 1=2 г/моль;
молярная масса 02 равна 2 • 16 = 32 г/моль.
Составим соответствующие пропорции и найдем объемы 1 моля этих газов х и у.
- 0,0899 г Н, занимает объем 1л, х = 2 / 0,0899 = 22,4 л;
- 2 г (1 моль) Н2 занимает объем х л,
- 1,4289 г 02 занимает объем 1л, у = 32 / 1,4289 = 22,4 л.
- 32 г (1 моль) 02 занимает объем у л,
Пример 1.12. Какой объем водорода (Н2) при нормальных условиях выделится при растворении 4,8 г магния (Mg) в избытке хлороводородной (соляной) кислоты (НС1)?
Решение. 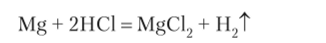
При растворении 24 г (1 моль) Mg в НС1 выделится 22,4 л (1 моль) Н2; при растворении 4,8 г 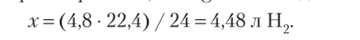 Mg в НС1 выделится х л Н2:
Mg в НС1 выделится х л Н2:
Пример 1.13. 3,17 г хлора (С12) занимают при нормальных условиях объем, равный 1 л. Вычислим по этим данным молярную массу хлора.
Решение.
Находим массу 22,4 л хлора: 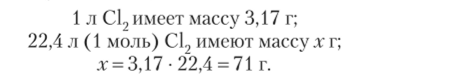
Следовательно, молярная масса хлора — 71 г/моль.
6. Закон эквивалентов (И. Рихтер, 1809 г.): вещества взаимодействуют друг с другом в количествах, прямопропорциональных их эквивалентам.
Из закона постоянства состава следует, что химические элементы соединяются друг с другом в строго определенных количественных и массовых соотношениях. Поэтому в химию были введены понятия эквивалента, количества вещества эквивалентов и его молярной массы.
Эквивалентом называется реальная или условная частица вещества, которая способна замещать, присоединять, высвобождать один ион водорода или быть ему равноценной в конкретных кислотно-основных и ионно-обменных реакциях или одному электрону в конкретных окислительновосстановительных реакциях. Причем понятие эквивалента без указания конкретной реакции не имеет смысла.
Масса 1 моля эквивалентов вещества называется молярной массой эквивалентов (Мэ, г/моль). Она показывает, сколько граммов вещества при химических превращениях соответствует (прямо или косвенно) 1 г водорода или 8 г кислорода. В структуре молекулы воды Н90 содержатся два атома водорода и один атом кислорода, поэтому молярная масса эквивалента кислорода Мэо =16/2 = 8 г/моль-экв. Таким образом, молярная масса1 эквивалентов водорода равна 1 г/молъ, а кислорода — 8 г/моль.
Отметим, что многие элементы способны образовывать несколько соединений друг с другом. Из этого следует, что эквивалент одного и того же элемента и его молярная масса эквивалентов в зависимости от состава образующихся веществ имеют различные значения. Молярная масса эквивалентов Мэ для различных веществ может быть рассчитана по следующим формулам:
Му осн =осн / число замещаемых в реакции гидроксидных групп Мэ кис = Мкис / число замещаемых в реакции ионов водорода МЭсоли = Мсо1и / произведение числа катионов на их заряды Мэ ок/восст = Мок/восст / количество принятых (отданных) электронов, где М — молярная масса соответствующего вещества.
Примеры 1.14. Определить молярную массу эквивалентов гидроксида цинка (Zn (OH)9), серной кислоты (H9S04) и хлорида натрия (NaCl) в различных реакциях.
Решение.
1. Молярная масса Zn (OH)9 равна 65,4 + 2- 16 + 2- 1 = = 99,4 г/моль.
Так как в молекуле Zn (OH)2 имеются две гидроксидные группы (ОН-), то в случае замещения в реакции одной из них молярная масса эквивалентов Zn (OII)2 будет равна 99,4 / 1 = = 99,4 г/моль, а двух — 99,4 / 2 = 49,7 г/моль.
2. Молярная масса H2S04 равна 2−1 + 32 + 416 = 98 г/моль.
Так как в молекуле H2S04 имеются два атома водорода, то молярная масса эквивалентов H9S04 в случае замещения одного из них будет равна 98 / 1 = 98 г/моль, а двух — 98 / 2 = = 49 г/моль.
3. Молярная масса NaCl равна 23 + 35,5 = 58,5 г/моль.
Так как в этой соли один катион Na+ и его заряд равен +1, то молярная масса эквивалентов NaCl равна 58,5 / (1 • 1) = 58,5 г/моль, т. е. молярной массе этого вещества.
Следует различать два понятия — количество вещества и масса вещества, в том числе и для эквивалентов. Понятие молярной массы эквивалентов рассмотрено выше. Второе понятие может быть сформулировано следующим образом.
Количество вещества эквивалентов (пэ, моль) есть отношение массы вещества (тъ, г) к молярной массе эквивалентов (Мэ): 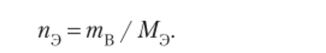
Моль вещества содержит 6,02 • 1023 эквивалентов.
Введение
в химию понятия эквивалент позволило сформулировать закон, названный законом эквивалентов.
При решении некоторых задач удобнее пользоваться другой формулировкой закона эквивалентов.
Массы (объемы) реагирующих друг с другом веществ прямо пропорциональны их молярным массам (объемам) эквивалентов.
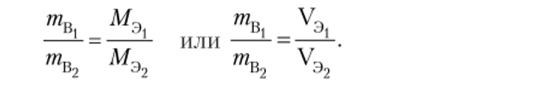
Пример 1.15. Определим молярную массу веществ — эквивалентов магния (Mg), если при сгорании 4,6 г Mg на воздухе образуется 7,6 г оксида магния (MgO).
Решение.
В 7,6 г MgO на долю кислорода приходится 7,6 — 4,6 = 3 г. В соответствии с законом эквивалентов: