Фазовые равновесия.
Общая и неорганическая химия

Гетерогенной называется система, составляющие части которой образуют несколько фаз, отделенных друг от друга поверхностями раздела, например смесь нескольких кристаллических веществ, насыщенный раствор соли с осадком, смесь ограниченно растворимых друг в друге жидкостей и т. д. Гомогенной (однородной) называется система, все составляющие части которой образуют одну фазу (поверхности раздела… Читать ещё >
Фазовые равновесия. Общая и неорганическая химия (реферат, курсовая, диплом, контрольная)
Термодинамические системы могут быть гомогенными и гетерогенными в зависимости от числа составляющих фаз.
Фазой называется часть системы, ограниченная поверхностью раздела и характеризующаяся в отсутствии внешних сил постоянством физических и химических свойств во всех точках.
Гомогенной (однородной) называется система, все составляющие части которой образуют одну фазу (поверхности раздела отсутствуют), например смесь газов, водные растворы солей, сплав железа и никеля.
Гетерогенной называется система, составляющие части которой образуют несколько фаз, отделенных друг от друга поверхностями раздела, например смесь нескольких кристаллических веществ, насыщенный раствор соли с осадком, смесь ограниченно растворимых друг в друге жидкостей и т. д.
При расположении веществ системы в одной фазе они находятся в термодинамическом равновесии друг с другом и образуют фазовое состояние. Равновесный переход вещества из одного фазового состояния в другое называется фазовым переходом. Он характеризуется скачкообразным изменением свойств вещества (теплоемкости, объема, внутренней энергии, энтропии).
Различают фазовые переходы первого и второго рода. Фазовым переходам первого рода свойственны скачкообразные изменения первых производных энергии Гиббса по температуре и давлению:
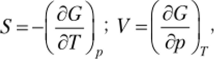
г. е. скачком изменяются энтропия и объем системы. Вторые производные энергии Гиббса по этим независимым переменным тоже могут изменяться скачкообразно. Примерами фазовых переходов первого рода являются взаимные превращения различных фазовых состояний вещества — твердого, жидкого и газообразного. К фазовым переходам первого рода относятся также аллотропные (полиморфные) превращения кристаллических веществ, например переход атомов серы из орторомбической модификации в моноклинную.
При фазовых переходах второго рода скачкообразно изменяются только вторые производные энергии Гиббса по температуре и давлению, а первые производные (энтропия и объем) изменяются непрерывно. Примерами фазовых переходов второго рода являются: превращение железа из ферромагнитного состояния (a-Fe) в парамагнитное (P-Fe), переход металла из обычного состояния в сверхпроводящее.
По числу фаз системы подразделяются на одно-, двух-, трехи многофазные. Число фаз системы обозначают буквой Ф. Газы неограниченно смешиваются друг с другом, образуя однофазную систему. Конденсированные вещества, неограниченно растворимые друг в друге, также образуют одну фазу, например твердый или жидкий сплавы золота и серебра, раствор воды в этаноле. При ограниченной взаимной растворимости число фаз равно числу веществ системы.
Составляющими частями (веществами) системы называются индивидуальные вещества, которые могут быть выделены из системы и существовать изолированно.
Вещества, наименьшее число которых необходимо и достаточно для выражения состава каждой фазы, называются независимыми компонентами (число независимых компонентов обозначается буквой К). При отсутствии химических взаимодействий в системе число независимых компонентов совпадает с числом составляющих веществ. Если в системе происходят химические реакции, то число независимых компонентов находят как разность между числом составляющих веществ и числом независимых уравнений, которыми связаны равновесные концентрации или парциальные давления веществ. По числу компонентов системы бывают одно-, двух-, трехи многокомпонентными.