Реакции окисления-восстановления.
Общая химия

Степень окисления (СО) — это формальный заряд атома, равный числу электронов, частично или полностью переданных от него к более электроотрицательным атомам при образовании связей с ними (СО положительна) или принятых от менее электроотрицательных атомов (СО отрицательна). Окислитель, принимая электроны, восстанавливается, образуя продукт, который в обратной реакции отдает электроны, т. е… Читать ещё >
Реакции окисления-восстановления. Общая химия (реферат, курсовая, диплом, контрольная)
Изучив содержание главы 15, студенты должны: знать
- • сущность и основные понятия теории реакций окисления-восстановления;
- • взаимосвязь химических и электрических явлений;
- • количественную характеристику силы окислителей и восстановителей;
- • процессы при работе химических источников тока; уметь.
- • составлять уравнения реакций окисления-восстановления;
- • определять возможность самопроизвольного протекания реакций окислениявосстановления;
- • рассчитывать константы равновесия реакций окисления-восстановления; владеть
- • навыками прогнозирования протекания реакций окисления-восстановления.
Сущность и основные понятия
Реакциями окисления-восстановления называются такие реакции, при которых изменяются степени окисления атомов и происходит перенос разного числа электронов от одних атомов к другим. В учебниках встречается и сокращенное название редокс-реакции от терминов в западноевропейских языках «reduction» (восстановление) и «oxidation» (окисление).
К реакциям окисления-восстановления относятся все реакции между простыми веществами, реакции горения, реакции металлов с кислотами, получение металлов из руд в металлургии, реакции разложения веществ и многие другие. Реакции окисления-восстановления имеют большое значение в энергетике, так как именно они характеризуются выделением большого количества энергии.
Рассмотрим пример взаимодействия металлического натрия и молекулярного хлора. Внешний электрон с подуровня 35 натрия переносится на орбиталь в подуровне 3р хлора, заселенную одним электроном. Это приводит к образованию устойчивых ионов с заполненными внешними электронными оболочками, как у благородных газов. Ион Na+ имеет электронную структуру атома Ne, а ион СИ — электронную структуру атома Аг. Переход атомов в ионное состояние и вытекающее из этого уравнение реакции можно записать в виде так называемой схемы электронного баланса:
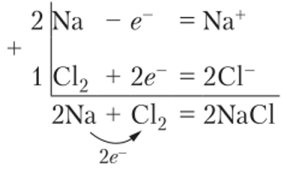
Полученное в результате реакции вещество NaCl электронейтрально, так как сумма электрических зарядов во всех физических и химических процессах сохраняется и число отданных электронов одними атомами равно числу присоединенных электронов другими атомами.
Роль отдельных атомов в реакции можно установить, сравнивая их электроотрицательности.
Рассмотренный пример относится к образованию вещества с ионными связями. Электроотрицательное™ натрия (х = 0,9) значительно меньше электроотрицательности хлора (х = 3,0). Это означает, что атом натрия отдает электрон, а атом хлора — присоединяет. Если атомы, составляющие вещество, не сильно различаются по электроотрицательности, то они образуют полярные ковалентные связи. Тогда появляются частичные заряды +5 на атомах с меньшей электроотрицательностью иб на атомах с большей электроотрицателыюстыо.
Водород (х = 2,2) образует с хлором молекулы НС1, в которых на водороде имеется относительно небольшой частичный заряд +0,17, а на хлоре -0,17. Но формально реакция водорода с хлором записывается в виде такой же схемы электронного баланса:
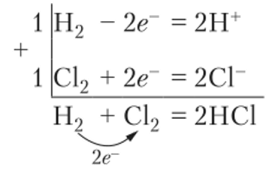
При рассмотрении многих вопросов, связанных с окислительно-восстановительными реакциями, истинная величина заряда не имеет значения, и принято считать, например, что водород окислен до состояния +1, а хлор восстановлен до состояния -1. Эти целые числа называются степенями окисления. Для обозначения состояния атома они записываются над символом элемента: 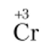
Степень окисления (СО) — это формальный заряд атома, равный числу электронов, частично или полностью переданных от него к более электроотрицательным атомам при образовании связей с ними (СО положительна) или принятых от менее электроотрицательных атомов (СО отрицательна).
Степень окисления — это производная величина от валентности атомов и электроотрицательное™. Например, степени окисления хрома в его оксидах СгО, Сг203 и СгОэ равны +2, +3 и +6 соответственно, потому что хром связан с более электроотрицательным двухвалентным кислородом. В оксиде СгО от атома хрома в сторону кислорода смещаются два электрона, в следующем оксиде к трем атомам кислорода смещаются шесть электронов от двух атомов хрома, а в последнем тоже шесть электронов от одного атома хрома. Но истинные заряды +8 на атомах хрома при повышении степени окисления не увеличиваются, а даже уменьшаются. Этим подтверждается формальный характер СО.
По абсолютной величине СО совпадает с валентностью атомов, кроме тех случаев, когда рассматриваемый атом одновременно связан как с более, так и с менее электроотрицательными атомами. Степени окисления рассчитывают на основе следующих правил.
- 1. Связи между одинаковыми атомами на степень окисления не влияют. Из этого вытекает следствие, что степени окисления атомов в простых веществах равны нулю.
- 2. В сложных веществах постоянные степени окисления имеют:
- -1 -1
- -2 — кислород во всех соединениях, кроме пероксидов (-О — О -), супе- +2
роксидов (О?) и OF2;
-1 — фтор; остальные галогены — хлор, бром и иод — во всех соединениях, кроме соединений с кислородом; водород в соединениях с металлами и кремнием;
+ 1 — водород в соединениях с большинством неметаллов, кроме кремния; элементы группы IA от лития до франция;
+2 — элементы группы ПА от бериллия до радия; цинк;
+3 — алюминий.
3. В частице, состоящей из нескольких атомов, сумма степеней окисления всех атомов равна ее заряду.
Применяя эти правила, можно определять степени окисления остальных атомов.
Пример 15.1. Какую степень окисления имеет хром в ионе Сг3+?
Решение. У одноатомного иона заряд совпадает со степенью окисления:
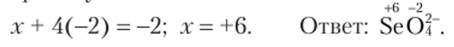
Пример 15.2. Определите СО атомов в анионе SeO|" .
Решение. У кислорода СО равна -2. Степень окисления х селена определим по правилу 3: 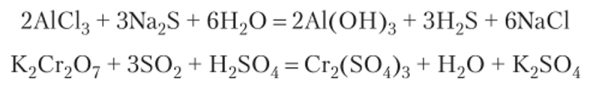
Пример 15.3. Определите СО атомов в дисульфиде калия K2S2.
Решение. СО (К) = +1 (правило 2). СО серы х определяем из уравнения 2(+1) + + 2х = 0; х = -1. Сера в данном веществе двухвалентна (K+-S-S-K+), но связь между атомами серы на СО не влияет. Поэтому валентность и СО серы в данном случае оказались разные.
Изменение степеней окисления атомов служит признаком окислительно-восстановительной реакции.
Пример 15.4. Являются ли следующие химические реакции окислительно-вое — ста! 10 в ител ы i ы м и ?
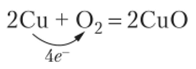
Решение. В первой реакции СО всех атомов остаются без изменения. Это кислотно-основная реакция. Во второй реакции изменяются СО хрома и серы. Это реакция окисления-восстановления. Рекомендуется самостоятельно проверить вывод расчетом степеней окисления.
Атомы, отдающие электроны, играют роль восстановителя и в процессе реакции окисляются. Степень окисления при отдаче электронов повышается. Атомы, принимающие электроны, играют роль окислителя и при этом восстанавливаются. Степень окисления при присоединении электронов понижается.
Окислением называется отдача электронов.
Восстановлением называется присоединение электронов. Окислителем называется как атом, присоединяющий электроны, так и вещество, в котором находится этот атом.
Восстановителем называется как атом, отдающий электроны, так и вещество, в котором находится этот атом.
Термины «окисление» и «восстановление» перешли в химию из металлургии. Окисление в металлургии — это соединение металла с кислородом:
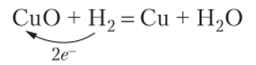
При этом металл теряет электроны. Потерю электронов стали называть окислением и во всех других реакциях. Получение металла из оксида естественно назвать восстановлением, т. е. возвращением в исходное состояние:
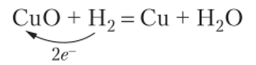
При восстановлении металл принимает электроны. Присоединение электронов стали называть восстановлением и во всех других реакциях.
Окислитель, принимая электроны, восстанавливается, образуя продукт, который в обратной реакции отдает электроны, т. е. действует как восстановитель. Соответственно и восстановитель, отдавая электроны, образует продукт, который в обратной реакции действует как окислитель.
Окислитель и восстановитель, в который он переходит, принимая электроны, составляют сопряженную окислительно-восстановительную пару, Ox+we-/Red. Между силой окислителя и сопряженного восстановителя имеется обратно пропорциональная зависимость.