Применение комплексных соединений в химическом анализе

Определение ионов по изменению окраски раствора вследствие образования окрашенных комплексов. Многие комплексные соединения обладают характерной окраской, что позволяет использовать их для обнаружения ионов в растворе. Так, катионы Fe2+ или Fe3+ можно определить по образованию темно-синих осадков «турнбулевой сини» Fe§+2 и «берлинской лазури» Fe^+3 при реакциях с феррицианид-ионом3… Читать ещё >
Применение комплексных соединений в химическом анализе (реферат, курсовая, диплом, контрольная)
Осаждение катионов и анионов из растворов. Катионы калия К+ осаждают с помощью гексахлороплатината натрия Na2[PtCl6] или платинахлористоводородной кислоты:
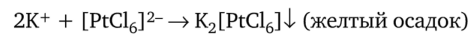
Осаждение катионов калия можно также проводить с помощью гексанитрокобальтата (Ш) натрия Na31 Co (N02)6 |:
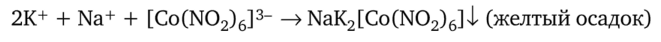
Еще менее растворим в воде гексанитрокобальтат (Ш) калия и серебра (1) K2Ag[Co (N02)6], осаждающийся из водных растворов в виде оранжево-желтого осадка.
Осаждение катионов аммония NH^ можно осуществить растворами гексахлороплатината натрия Na2[PtCl6] или платинахлористоводородной кислоты H2[PtCl6] (как и катионов калия):
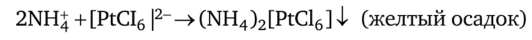
Висмут (Ш) осаждают из водных растворов в форме комплекса [Cr (NH3)6] [BiCl6].
Аналогично можно осадить из водных растворов сурьму (У) в виде устойчивого и весьма малорастворимого комплекса [Сг (еп)3] |SbS4], где еп — молекула этилендиамина. Это очень удобный и быстрый метод определения полумикроколичеств сурьмы.
Растворение осадков. Для растворения осадка хлорида серебра AgCl используют реакцию образования растворимого комплекса [Ag (NH3)2]Cl.
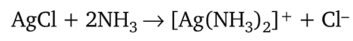
Обработка щелочами при нагревании осадка сульфата свинца PbS04 приводит к его растворению вследствие образования растворимого комплекса [РЬ (ОН)4]2-:
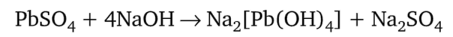
в ионной форме 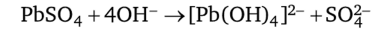
Разделение ионов путем дробного осаждения или дробного растворения. Ионы кадмия Cd2+ и цинка Zn2+, обладающие сходными свойствами, можно разделить дробным осаждением с последующим их определением. Для этого в раствор, содержащий смесь катионов кадмия и цинка, вводят тиокарбамид SC (NH2)2 и затем комплекс хрома (Ш) [Cr (SCN)4]. Образующийся растворимый тиокарбамидный комплекс кадмия.
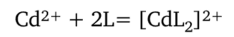
где L — молекула тиокарбамида, осаждается в форме малорастворимого осадка красного цвета с комплексом хрома.
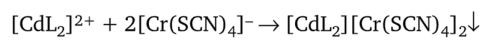
Осадок кадмиевого комплекса можно отделить от маточника, в котором остаются катионы цинка.
Другой пример — отделение серебра из смеси хлоридов серебра и ртути: AgCl + Hg2Cl2. Осадок, состоящий из этой смеси, обрабатывают раствором аммиака. Серебро переходит в раствор вследствие образования растворимого комплекса [Ag (NH3)2]Cl.
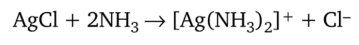
Хлорид ртути (I) Hg2Cl2 остается в осадке, который постепенно темнеет вследствие выделения металлической ртути при реакции хлорида ртути (1) с аммиаком.
Аналогично можно перевести в раствор из осадков гидроксидов катионы Со2+, Ni2+, Cu2+, Cd2+, Hg2+ в форме растворимых аммиачных комплексов, тогда как гидроксиды магния, марганца, железа, сурьмы, висмута остаются в осадке, поскольку не образуют растворимых аммиакатов.
Определение ионов по изменению окраски раствора вследствие образования окрашенных комплексов. Многие комплексные соединения обладают характерной окраской, что позволяет использовать их для обнаружения ионов в растворе. Так, катионы Fe2+ или Fe3+ можно определить по образованию темно-синих осадков «турнбулевой сини» Fe§+ [Fe3+(CN)6]2 и «берлинской лазури» Fe^+ [Fe2+(CN)6]3 при реакциях с феррицианид-ионом [Fe (CN)6]3~ и ферроцианид-ионом [Fe (CN)6]4— соответственно:
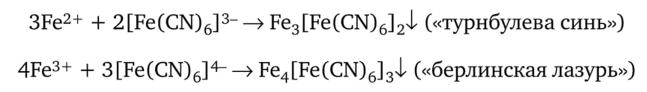
Ионы Fe3+ можно обнаружить также по образованию в растворе окрашенных в красный цвет тиоцианатных комплексов железа (Ш):
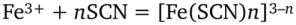
где гс = 1−3.
Катионы меди (Н) Си2+ определяют, действуя раствором аммиака на раствор, содержащий катионы Си2+. При этом протекает реакция образования растворимого аммиачного комплекса меди (П) [Cu (NH3)4]2+ ярко-синего цвета:
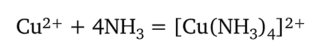
Маскирование ионов в растворе (устранение их мешающего действия). Ионы, мешающие обнаружению других ионов в растворе, нередко можно связывать в прочные комплексы с помощью подходящих лигандов, что понижает концентрацию их аквакомплексов в растворе и тем самым устраняет их мешающее действие.
Рассмотрим, например, возможность определения ионов Со2+ в присутствии катионов Fe3+ реакцией с тиоцианат-ионами SCN~. Ионы Со2+ образуют с тиоцианат-ионами комплексы [Co (SCN)4]2_ синего цвета:
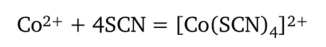
Тетратиоцианатный комплекс кобальта (П) не очень устойчив (lgK = 2,20, т. е. Ку = 1,6 • 102), и в разбавленных растворах равновесие сильно смещено влево. Ионы Fe3+ также образуют с тиоцианат-ионами окрашенные (в красный цвет) тиоцианатные комплексы [Fe (SCN)n]3-n:
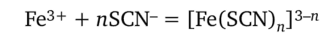
При гс = 6 константа устойчивости комплекса железа (Ш) Ку — 1,7 х х 103 (IgKy = 3,23), т. е. этот комплекс несколько устойчивее тиоцианатного комплекса кобальта (Н). На фоне окрашенного комплекса железа (Ш) окраску соединения кобальта (Н) заметить практически невозможно, т. е. катионы Fe3+ мешают открытию ионов Со2+. Мешающее действие катионов железа (III) можно подавить введением в раствор фторид-ионов F-. В присутствии этих анионов железо (III) связывается в очень прочный бесцветный комплекс [FeF6]3-:
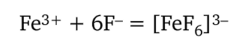
с константой устойчивости Ку = 7 • 1011 (lgKy = 11,86), на несколько порядков превышающей константу устойчивости тиоцианатного комплекса железа (Ш). Последний в присутствии фторид-ионов разрушается и переходит во фторидный комплекс железа (Ш):
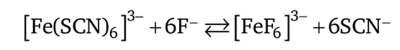
Концентрационная константа этого равновесия (Кс = 4,1 • 108) достаточно большая, поэтому равновесие практически полностью сдвинуто вправо — в сторону образования фторидного комплекса железа (Ш), т. е. тиоцианатный комплекс практически разрушается. Ион кобальта Со2+ в этих условиях не образует прочных фторидных комплексов.
Для маскирования ионов металлов (устранения их мешающего действия) используют их связывание в хлоридные, тиосульфатные, аммиачные комплексы, в комплексонаты. Основное условие, которое должно при этом выполняться, состоит в том, что образующийся комплекс, в который связываются мешающие ионы, должен обладать высокой устойчивостью (высоким значением константы устойчивости Ку), а определяемый ион, напротив, не должен образовывать устойчивые комплексы с маскирующим агентом.
Изменение окислительно-восстановительных потенциалов (ОВП) редокс-систем. Образование различных комплексов влияет на величину ОВП редокс-пар. Рассмотрим, например, редокс-пару pt4+|pt2+, которой соответствует полуреакция Pt4+ +2е~ =Pt2+. Ионы Pt4+ и Pt2+ в растворе присутствуют в форме комплексов, причем природа лигандов и состав комплексов влияют на величину ОВП:
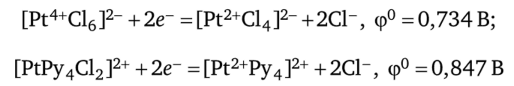
(Ру — пиридин, C5H5N).
Здесь величины стандартного ОВП даны для 0,1 моль/л водных растворов НС1 при комнатной температуре.
Другой пример — редокс-пара Fe3+|Fe2+, которой соответствует полуреакция Fe3+ + е~ =Fe2+, ф°=0,771 В. Той же редокс-паре в комплексах соответствуют уже другие величины стандартного ОВП:
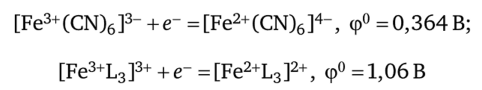
(L — молекула 1,10-фенантролина C12H8N2).
Изменения значений ОВП, как мы видим, могут быть весьма значительными.
Концентрирование веществ. Для концентрирования веществ иногда используют образование комплексов, которые затем экстрагируют из большого объема водной фазы в малый объем жидкой органической фазы.
Так, например, проводят экстракцию катионов кадмия Cd2+ в форме оксихинолинатного комплекса из водных растворов хлороформным раствором 8-оксихинолина.
Определение катионов металлов люминесцентным методом.
Комплексообразование используют в соответствующем анализе для перевода ионов в люминесцирующий комплекс.
Так, катионы цинка Zn2+ в присутствии бензоина С6Н5СН (ОН)СОС6Н5 образуют комплексы, обладающие интенсивной флуоресценцией.
Люминесцентным методом можно обнаружить и определять катионы бериллия Ве2+, алюминия А13+, галлия Ga3+, индия 1п3+, скандия Sc3+ в присутствии морина, который образует комплексные соединения с этими катионами; ионы бериллия — также и в присутствии 1-амино- 4-оксиантрахинона и т. д.
Фиксирование точки эквивалентности в титриметрическом анализе. Образование или разрушение комплексов используется для определения конца титрования. Это явление подробно рассматривается в курсе титриметрического анализа.