Атомное ядро.
Фундаментальная радиохимия

Существование магических ядер приводит к следующим явлениям: более широкое распространение тех элементов, у которых Z или Лг являются магическими числами; стабильные элементы в конце природных радиоактивных рядов все имеют магическое число нейтронов или протонов; поперечные сечения поглощения нейтронов у изотопов с магическим числом намного ниже, чем у ближайших к ним изотопов; энергия связи для… Читать ещё >
Атомное ядро. Фундаментальная радиохимия (реферат, курсовая, диплом, контрольная)
Начнем с некоторых определений.
Химический элемент — совокупность атомов с одинаковым зарядом ядра и числом протонов, совпадающим с порядковым номером в периодической системе элементов.
Каждый химический элемент имеет свое название и символ.
Атом — мельчайшая частица химического элемента, сохраняющая его свойства.
Нуклид — разновидность атома, характеризуемая числом протонов и нейтронов, а в некоторых случаях энергетическим состоянием ядра.
Нуклиды могут быть стабильными или нестабильными, т. е. радиоактивными.
Радионуклид — нуклиду испускающий ионизирующее излучение.
Атомное ядро — положительно заряженная центральная часть атома, в которой сосредоточена практически вся масса атома.
Состоит из протонов и нейтронов (нуклонов). Число протонов определяет электрический заряд атомного ядра и порядковый номер Z атома в периодической системе элементов. Число нейтронов равно разности массового числа и числа протонов. Объем атомного ядра пропорционален числу нуклонов в ядре. Плотность ядерного вещества соответствует приблизительно значению 10й г/см3.
Фотон — элементарная частица, квант электромагнитного излучения.
Это безмассовая частица, способная существовать только двигаясь со скоростью света. Электрический заряд фотона равен нулю. Фотон может находиться только в двух спиновых состояниях с проекцией спина на направление движения (спиральностыо) ±1. Фотону свойственен корпускулярноволновой дуализм, он проявляет одновременно свойства частицы и волны.
Электрон — стабильная отрицательно заряженная частица со спином, ½ с массой, приблизительно равной 9−10~28 г, и магнитным моментом, равным магнетону Бора.
Позитрон е+ — античастица электрона. Относится к антивеществу, имеет электрический заряд + 1, спин ½, лептонный заряд -1 и массу, равную массе электрона.
При аннигиляции позитрона с электроном их масса превращается в энергию в форме двух (и гораздо реже — трех и более) у-квантов.
Нуклон — общее название протона и нейтрона, являющихся составными частями атомных ядер.
Протон — стабильная элементарная частица с плюсовым зарядом, со спином ½, магнитным моментом р = 2,79хв и массой 1838,5 электронных масс (10 21 г).
Положительный заряд протона равен элементарному заряду е = 1,6 021 773 -10 19 Кл, масса протона равна т, = = 1,6 726 231 10 27 кг = 1,726 470 а.е.м. = 938,27 231 МэВ. Масса легкого изотопа атома водорода (протия) ота1(, 11') = = 1,814 а.е.м. = 938,7 МэВ = 1837 т, т = 1,759 а.е.м. = = 938,7 МэВ = 1839 т,.
Нейтрон — электрически нейтральная элементарная частица со спином 1 /2, магнитным моментом р = -1,91 рв и массой, превышающей массу протона на 2,5 электронных масс.
тп = 1,8 986 а.е.м. = 939,5 МэВ = 1838,5т(" В свободном состоянии нейтрон нестабилен: он распадается с периодом полураспада Тх/2 = 10,18 мин (время жизни нейтрона х = = 881,5 ± 1,5 с), образуя протон и испуская электрон и антинейтрино, v (p-распад). Вместе с протонами нейтроны образуют атомные ядра; в ядрах нейтрон стабилен.
Нейтрино (v) — стабильная незаряженная элементарная частица со спином ½ и нулевой массой.
Нейтрино чрезвычайно слабо взаимодействуют с веществом.
Ядерные силы — силы, связывающие нуклоны {протоны и нейтроны) в ядре.
Ядерные силы — одно из проявлений сильных взаимодействий. Они являются короткодействующими, радиус их действия порядка 1 • 10 12 —1? 10 13 см. Ядерные силы не зависят от заряда нуклонов.
Число протонов в ядре Z определяет непосредственно его электрический заряд, у изотопов одинаковое количество протонов, но разное количество нейтронов. Экспериментально заряд ядра определяют по длине волны характеристического рентгеновского излучения, используя закон Г. Мозли.
Закон Мозли — линейная зависимость квадратного корня из частоты характеристического рентгеновского излучения линейно зависит от атомного номера химического элемента:

где Л — длина волны; а и b — постоянные.
Ферми — единица измерения расстояния, применяющаяся в ядерной физике, названа в честь итальянского физика Э. Ферми.
Обозначение: русское — фм, международное — fm. Единица удобна для применения в ядерной физике, поскольку характерные размеры атомного ядра составляют несколько ферми. 1 ферми = 1 фм = 1 • 10″ 15 м = 1 фемтометр.
Радиус атома определяется радиусом электронной оболочки и равен примерно 1 • 10 8 см. Ядро — центральная, несущая основную массу часть атома, имеет размеры порядка 1 • 10-13 — 1 • 10 12 см = 1 — 10 фм (ферми).
Атомное ядро с зарядом Z и массовым числом А состоит из А нуклонов: Z протонов и N нейтронов, связанных между собой ядерными силами. Ядро имеет Z положительных элементарных зарядов. Общее число нуклонов в ядре называется массовым числом А = N+ Z. Эта сумма всегда является целым числом; ее не следует отожествлять с атомной массой.
Число нуклонов А равно сумме числа нейтронов и протонов, но масса ядра не равна весу протонов и нейтронов, из которых он был синтезирован, так как масса нуклона меньше массы свободного протона или нейтрона. Это различие в массах обусловливает связь нуклонов в атомном ядре.
Массовое число атомного ядра, А — суммарное количество протонов и нейтронов (называемых общим термином «нуклоны») в ядре.
Массовое число близко к атомной массе изотопа, выраженной в атомных единицах массы, но совпадает с ней только для 12С, так как атомная единица массы (а.е.м.) определяется сейчас как 1/12 массы атома 12С. Во всех остальных случаях атомная масса не является целым числом, в отличие от массового числа. Так, массовое число изотопа хлора 35С1 равно 35, а его атомная масса составляет 34,96 885 а.е.м.
Атомная масса, относительная атомная масса — значение массы атома, выраженное в атомных единицах массы.
Атомная единица массы принята равной 1/12 массы нейтрального атома изотопа углерода 12С, поэтому атомная масса этого изотопа равна точно 12. Разность между атомной массой изотопа и его массовым числом называется избытком массы (обычно его выражают в МэВ). Он может быть как положительным, так и отрицательным.
Атомная единица массы (дальтон) — внесистемная единица массы, применяемая для масс молекул, атомов, атомных ядер и элементарных частиц. 1 а.е.м. = 1,6 605 402−10-24 г = = 0,931 494 028 ГэВ/с2.
Массу атома выражают в атомных единицах (а.е.м.). За 1 а.е.м. принята 1/12 массы атома углерода с массовым числом 12 (углеродная шкала). Одна (1) а.е.м. = 1,6 605 655−10″27 кг — величина, обратная числу Авогадро, т. е. 1 /NA, где NA = = 6,02 • 1023. Эта единица удобна тем, что ее величина близка к массе нуклона. Такой выбор атомной единицы массы удобен тем, что молярная масса данного элемента, выраженная в граммах на моль, в точности совпадает с массой атома этого элемента, выраженной в а.е.м. За атомную массу элемента, состоящего из смеси изотопов, принимают среднее значение атомной массы изотопов с учетом их процентного содержания.
Пример. Рассчитаем атомную массу природной смеси изотопов неона. Элемент неон в природе находится в виде трех стабильных изотопов: 20Nc (атомная масса 19,9924, содержание 90,48%), 2,Ne (20,9938; 0,27%) и 22Ne (21,9913; 9,25%).
Атомный вес природной смеси трех изотопов неона округленно равен:
19,9924−0,9048 + 20,9938−0,0027 + 21,9913 • 0,0925 = 20,18.
Атомная масса меньше суммы масс составляющих атом частиц (протонов, нейтронов, электронов) на величину, обусловленную энергией их взаимодействия (дефект массы). Экспериментально масса ядра обычно измеряется масс-спектрометрами.
Стандартная масса, которая обычно приводится для нуклида в справочниках — это масса нейтрального атома. Для определения массы ядра нужно из массы атома вычесть сумму масс всех электронов (более точное значение получится, если учесть еще и энергию связи электронов с ядром).
Конкретный изотоп обозначается символом химического элемента, слева внизу указывается число протонов Z (атомный номер в периодической системе), слева вверху — массовое число А, справа внизу — число нейтронов N (обычно не указывается), справа вверху — заряд иона (валентность).
z X и м и ч ес к и й с и м во л v
Часто N не указывают, а справа от символа вверху пишут валентность или заряд иона. Например, типичное обозначение нуклида углерода имеет вид: 1|С4+.
Изотопы — нуклиды с одинаковым числом протонов, но различным количеством нейтронов (Z = const).
Все изотопы принадлежат одному и тому же химическому элементу.
Изобары — разновидности атомов или атомных ядер {нуклидов), отличающиеся числом протонов, т.е. зарядом ядра {порядковым номером элемента в периодической таблице), при одинаковом массовом числе.
Изотоны — атомы различных химических элементов с одинаковым числом нейтронов в ядрах.
Изомер — нуклид в возбужденном ядерном состоянии с измеримой продолжительностью жизни {> 10~9 с).
Изомерные нуклиды различаются не числом протонов или числом нейтронов, а энергией связи ядра. Изомеры находятся в различных энергетических состояниях, причем каждое состояние ядра имеет определенное измеримое время жизни.
Состояние нуклида с минимальным значением энергии является основным состоянием. Высокоэнергетическое состояние называется «возбужденным состоянием».
Для различия отдельных изомеров принято прибавлять к числу нуклонов букву g (для основного состояния) или т (для высокоэнергетического метастабильного состояния), например, 4(*Sc в отличие от 46mSc.
Пример. Рассмотрим следующие ядра: 99mTc, l4C, 14N, , 2С, 13N. Кто из них изотопы, кто изогоны, кто изобары, а кто изомеры?
Ответ: «» Тс — изомер, 14С и |2С — изотопы С, 13N и , 4N — изотопы N, 14С и 14N — изобары {А = 14), а 12С и 13N — изотопы {N=6).
Взаимосвязь между массой любого тела и его полной энергией описывается формулой.

где с = 2,998 -1010 см/с — скорость света в вакууме; т = т0
= и; т — релятивистская масса; v — скорость движе;
ш ния тела; т0 — его масса покоя.
Переход от массы к энергии проводят по соотношению:
1 а.е.м. = 1,66 054 -10 24 г = 1,492 -1010 Дж = 931,494 МэВ/с2.
Пример. Рассчитаем энергетический эквивалент единицы атомной массы. Согласно формуле Эйнштейна:
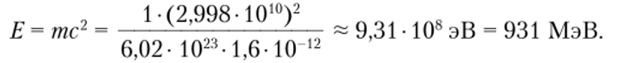
Масса покоя протона тр = 1,0073 а.е.м. = 1,6726−10~24 г = = 938,2 МэВ; масса покоя нейтрона тп = 1,0087 а.е.м. = = 1,6749−10 24 г = 939,5 МэВ; масса покоя электрона те = = 5,4859 -10 4 а.с.м. = 9,1096 -10 28 г = 0,511 МэВ.
Отношение тр/те = 1836.
Электронвольт (эВ) является внесистемной единицей энергии. 1 эВ равен кинетической энергии, которую приобретает электрон при прохождении между двумя точками с разностью потенциалов 1 В. 1 эВ = 1,602 176 487−10~19 Дж; 1 ГэВ (1 гигаэлектронвольт) = 1 • 109 эВ. 1 ГэВ/с2 ~ 1,73 544 а.е.м.
Ядро представляет систему связанных между собой нуклонов. Возникновение связанного состояния возможно только под действием ядерных сил притяжения, удерживающих нуклоны в ограниченном объеме. Устойчивость связанного состояния обеспечивается тем, что ядро как система из взаимодействующих между собой нуклонов должна иметь минимум полной энергии.
Полная энергия связи ядра составляет:

где т{ — массы нуклонов, из которых образовано ядро; тр — масса протона; тп — масса нейтрона; Мяд — масса ядра.
Для устойчивого ядра полная энергия связи положительна и равна той энергии, которую надо затратить, чтобы разделить ядро на все составляющие его нуклоны. Если Есв > 0, то ядро устойчиво, если Есв < 0 — нуклоны ядра будут разлетаться подобно свободным частицам.
Экспериментально полученные массы всегда меньше значений, вычисленных как сумма масс частиц, составляющих ядро. Эта разность масс {дефект массы) равна:
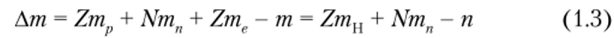
и эквивалентна энергии связи: 
Энергия связи — разность между энергией связанной системы частиц и суммарной энергией этих частиц, находящихся в свободном состоянии.
Для устойчивых систем энергия связи отрицательна и тем больше, чем прочнее система. Энергия связи с обратным знаком равна минимальной работе, которую нужно затратить, чтобы разделить систему на ее элементарные составные части.
Энергия связи ядра — мера его прочности:

Энергия связи па один нуклон определяется:

Дефект массы — разность ДМ между массой М системы взаимодействующих тел (частиц) и суммой их масс Ym в свободном состоянии и определяется полной энергией их взаимодействия, т. е. энергией их связи Есв: ДМ = Ес‘/с2.
Значение дефекта массы позволяет определить величину энергии, выделяющуюся в ядерных реакциях.
Дефект массы, являясь мерой энергии связи, определяет степень устойчивости системы.
Избыток массы (или дефект массы) для атома — выраженная в единицах энергии разность массы нейтрального атома и произведения числа нуклонов (суммарного числа протонов и нейтронов) в ядре этого атома на атомную единицу массы.
Стандартная формула для расчета энергии связи ядра:

где Z — заряд ядра (в единицах е) Л — массовое число; тн, тп и М — массы атома водорода, нейтрона и атома, соответствующего данному ядру.
Однако в таблицах изотопов обычно приводятся нс массы элементарных частиц, а массы атомов (например, не масса протона, а масса атома водорода), что заставляет при расчетах учитывать массы электронов. Более удобной считается формула.

где Д", Ап и Д — избыток массы атома водорода, нейтрона и атома, соответствующего данному ядру.
Пример 1. Вычислим энергию связи ядра sBe (Z = 4, Л = 8). Известно, что избыток массы атома 8Ве равен 0,531. 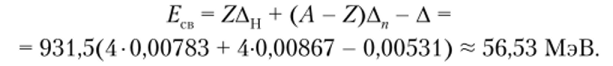
Пример 2. Вычислим в а.е.м. массу атома 8Ве (Z = 4, А = 4),.
энергия связи ядра которого 56,53 МэВ.

В настоящее время известны нуклиды со всеми значениями Z от 0 (нейтрон) до 118. Для существующих в природе ядер Z меняется от 1 (водород) до 92 (уран). Остальные нуклиды получают искусственно. Не существует стабильных нуклидов с Z = 0,43 (технеций), 61 (прометий) и Z > 84. Известны нуклиды с числом нуклонов А от 1 до 263 включительно. Не существует стабильных нуклидов с числом нуклонов А = = 5, 8 и при А > 210. В легких ядрах число нейтронов равно числу протонов, т. е. Z/А ~ 0,5. Например, дляНе, и так до 2оСа. Только в водороде, ядро которого состоит из одного протона, Z/A = 1. С ростом Z число нейтронов обгоняет число протонов, величина Z/А немонотонно уменьшается, испытывая от элемента к элементу незначительные колебания вокруг среднего, и достигает значения Z/A = 0,39 для урана. Такое соотношение числа нейтронов и протонов соответствует стабильным ядрам. Если соотношение числа нейтронов и протонов отличается от значения, характерного для устойчивого состояния, ядра испытывают радиоактивный распад.
Устойчивость (стабильность) ядер характеризуется параметром Бора Z2/A. Если он больше 33, то ядро неустойчиво (радиоактивно). Последним в периодической таблице элементом, у которого еще имеется устойчивый изотоп, является висмут 28зВг Элементы с Z от 84 до 92 не имеют ни одного устойчивого изотопа — все они радиоактивны. Радиоактивны также все изотопы элементов с Z от 93 до 104. Нет ни одного устойчивого изотопа у двух относительно легких элементов — технеция 43Тс и прометия б1Рт. У других элементов радиоактивность присуща только некоторым изотопам.
Атомные ядра с четным числом протонов и четным числом нейтронов называют четно-четными ядрами, ядра с нечетным числом протонов и нечетным числом нейтронов — нечетно-нечетными ядрами. Четно-нечетными ядрами называются ядра с нечетным (четным) числом протонов и четным (нечетным) числом нейтронов.
Ядра с четным числом протонов и четным числом нейтронов устойчивы, в то время как комбинация из нечетного числа протонов и нечетного числа нейтронов, наоборот, крайне неустойчива. Здесь действует правило Маттауха: нет двух стабильных изобаров, порядковые номера которых различались бы на единицу. Исключение из этого правила имеет место при числе нуклонов А = 50, 113 и 180. Правило Маттауха важно для обнаружения существующих в природе радионуклидов. Так, например, в триадах природных изобаров:

средний член является радиоактивным нуклидом.
Легкие стабильные нуклиды (до Z < 20) содержат в составе ядра примерно равное число протонов и нейтронов. При увеличении А относительная доля нейтронов возрастает. Например, у легкого нуклида соотношение N/Z = 1; у среднего нуклида SjgFe N/Z = 1,15; у тяжелого нуклида 2j^U N/Z = 1,59. Опережающий рост числа нейтронов при больших А вызван действием дальнодействующих кулоновских сил отталкивания протонов в ядре. Большинство химических элементов имеет по нескольку стабильных и р-активных нуклидов. Некоторые элементы имеют всего по одному стабильному нуклиду (9Ве, 19F, 23Na), остальные — по 2—3 стабильных нуклида. Олово (Sn) имеет 10 стабильных нуклидов. Выше дорожки стабильности располагаются реактивные нуклиды, ниже — рактивные нуклиды. Свойства ядер существенно зависят от четности чисел Z и N. Наибольшее число стабильных нуклидов (155 из 265) имеют четно-четные ядра (Z — четно, N — четно), поровну стабильных нуклидов (по 53) с четно-нечетным и нечетно-четным количеством нуклонов в составе ядер. Имеется всего четыре стабильных нуклида (2Н, 6Li, 10В и 14N) с нечетно-нечетным составом ядер.
Ход кривой зависимости удельной энергии связи ядра от атомного веса (рис. 1.1):
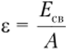
демонстрирует, что удельная энергия связи? сначала быстро возрастает при малых Л, и уже для ядер с А > 12 имеет примерно постоянное значение, близкое к 8 МэВ/нуклон, т. е. Есв" еЛ. Затем зависимость ?(Л) достигает максимума. Для нуклидов с Л > 11 (Z > 5) среднее значение энергии связи на один нуклон составляет от 7,4 до 8,8 МэВ.
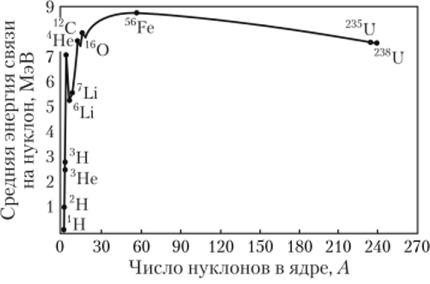
Рис. 1.1. Зависимость средней энергии связи в расчете на один нуклон от массового числа Встречающиеся в природе стабильные нуклиды распределены по четным и нечетным значениям Z и N. Все ядра с четными значениями этих величин являются ядрами легких нуклидовН, |Li, !gB, l?N — все они стабильны. Если среди изобар с нечетными А обычно стабилен лишь один, то в случае четных А встречаются по два, три и более стабильных изобар. Наиболее стабильны четно-четные, наименее — нечетно-нечетные ядра. Как нейтроны, так и протоны проявляют тенденцию группироваться парами с партнерами с антипараллельными спинами, что приводит к нарушению плавности зависимости энергии связи от А.
Для нуклидов с Л ~ 60, т. е. для группы элементов Fe—Со—Ni, энергия связи на нуклон имеет максимальное значение — данные элементы являются наиболее устойчивыми. После максимума величина в при росте Л плавно уменьшается, достигая для урана значений, приблизительно равных 7,5 МэВ/нуклон. Значение энергии связи на нуклон для ядер с четным числом нуклонов всегда выше среднеарифметического значения этой величины для соседних нуклидов с нечетным числом нуклонов. У легких ядер энергия связи существенно меньше (1 МэВ у дейтерия), а у тяжелых ядер она уменьшается с ростом числа нуклонов в ядре и достигает 7,6 МэВ для урана. Поэтому энергетически выгодны реакции синтеза легких ядер и деления тяжелых ядер. Так, в реакции синтеза ядер гелия из дейтерия и трития выделяется энергия 17,6 МэВ (3,5 МэВ на 1 нуклон). Деление ядер урана сопровождается выделением энергии порядка 214 МэВ, или 1 МэВ на нуклон.
Пример. Пусть ядро урана 2j^U делится на два одинаковых ядра с массовыми числами 119. У этих ядер, как видно из рис. 1.1, удельная энергия связи порядка 8,5 МэВ/нуклон. Удельная энергия связи ядра урана 7,6 МэВ/нуклон. Следовательно, при делении ядра урана выделяется энергия, равная 0,9 МэВ/нуклон или порядка 214 МэВ на один атом урана.
Рассмотрим теперь другой пример. Пусть при некоторых условиях два ядра дейтерия JH сливаются в одно ядро гелия gHe. Удельная энергия связи ядер дейтерия равна 1,1 МэВ/нуклон, а удельная энергия связи ядра гелия равна 7,1 МэВ/нуклон. При синтезе одного ядра гелия из двух ядер дейтерия выделится энергия, равная 6 МэВ/нуклон или 24 МэВ на 1 атом гелия.
Таким образом, синтез легких ядер сопровождается в б раз большим выделением энергии на один нуклон по сравнению с делением тяжелых ядер.
Удельная энергия связи нуклонов в ядре значительно (в сотни тысяч раз) превышает энергию связи валентных электронов в атоме, приблизительно равную 10 эВ для большинства атомов. Поэтому энергия, выделяющаяся в ядерных реакциях, соответственно (в сотни тысяч и более раз) выше энергии химических реакций.
Устойчивость ядер зависит от параметра N/Z — отношения чисел нейтронов и протонов. Ядра легких нуклидов наиболее устойчивы при N/Z < 1. С ростом массового числа более заметным становится электростатическое отталкивание между протонами, и область устойчивости сдвигается к значениям N/Z > 1. Для наиболее тяжелых ядер N/Z ~ 1,5.
Энергия связи одного присоединяемого или отделяемого от ядра нуклона зависит от четности числа имеющихся в составе ядра протонов и нейтронов. Анализ удельной энергии связи как функции А и Z демонстрирует наибольшую устойчивость ядер с четным числом протонов и нейтронов (четночетные ядра). Эти ядра имеют удельную энергию связи, примерно на 1 МэВ большую, чем соседние ядра, у которых либо N, либо Z — нечетные (Ч-Н и Н-Ч ядра) и широко распространены в природе. Объединение внутри ядра одноименных нуклонов в пары (эффект спаривания) обусловлен действием между ними добавочным ядерных сил и является энергетически выгодным процессом, увеличивающим удельную энергию связи на 1 МэВ. Промежуточное положение по величине удельной энергии связи и распространенности в природе занимают четно-нечетные и нечетно-четные ядра. Наименьшие значение удельной энергии связи и количества стабильных нуклидов (четыре) имеют нечетно-нечетные ядра.
Заслуживают внимания особо высокие значения удельной энергии связи в ядрах с содержанием нейтронов и (или) протонов, равным 2, 8, 20, 50, 82, 126 (только для нейтронов), заметно отличающиеся даже на фоне четно-четных ядер. Эти числа (и соответствующие ядра) получили название магических. Элементы с магическими ядрами являются наиболее устойчивыми и имеют большую распространенность в природе. Например, олово, атомный номер которого Z= 50, имеет 10 стабильных изотопов. Наблюдается наибольшее число стабильных изотопов для N= 82. Особенно устойчивыми являются дважды магические ядра, у которых и число нейтронов, и число протонов равно одному из магических чисел, например, зНе, ‘gO, 2оСа, 2ЦРЪ.
Магические ядра — атомные ядра, содержащие магическое число (2, 8, 20, 28, 50, 82, 126) протонов или нейтронов.
Отличаются повышенной устойчивостью и большей распространенностью в природе по сравнению с соседними ядрами в периодической системе элементов.
Не всегда магические ядра являются стабильными: дважды магические ядра 280 (Z= 8, N= 20) и 10<)Sn (Z=N= 50, Г½ = 1,1 с) радиоактивны.
Существование магических ядер приводит к следующим явлениям: более широкое распространение тех элементов, у которых Z или Лг являются магическими числами; стабильные элементы в конце природных радиоактивных рядов все имеют магическое число нейтронов или протонов; поперечные сечения поглощения нейтронов у изотопов с магическим числом намного ниже, чем у ближайших к ним изотопов; энергия связи для последнего в оболочке нейтрона максимальна при магическом нейтронном числе, но резко понижается для следующего добавленного нейтрона; электрические квадрупольные моменты близки к нулю для магического ядерного числа; энергия возбуждения, передаваемая от основного ядерного состояния к первому возбужденному состоянию, больше для заполненных оболочек.
У сверхтяжелых ядер магические числа нейтронов не совпадают с магическими числами протонов. Для протонов, начиная с Z = 82, предсказаны магические числа 114, 126, 164 и 228, в то время как магическими числами для нейтронов после N = 126 являются 184, 196, 228 и 272. Различие в магических числах — 126 (для нейтронов) и 114 (для прогонов) — обусловлено кулоновским взаимодействием. Полагают, что нуклидом с двумя магическими числами должен быть некий нуклид fj83 и он будет долгоживущим или даже стабильным. Его до сих пор ищут в земных минералах. Пока — безуспешно.