Агрегатные состояния вещества.
Когезия

В газообразном состоянии вещество самопроизвольно расширяется, занимая весь предоставленный ему объем, при повышении давления легко изменяет свой объем. Молекулярно-кинетическая теория газов была заложена еще в работах М. В. Ломоносова (1744−1748 гг.). В XIX—XX вв. она получила развитие в работах европейских и русских ученых (Р. Клаузиус, Д. Максвелл, Л. Больцман, Я. И. Френкель). Упрощенная… Читать ещё >
Агрегатные состояния вещества. Когезия (реферат, курсовая, диплом, контрольная)
Большинство веществ в зависимости от температуры и давления могут находиться в трех агрегатных состояниях: газообразном (г), жидком (ж) или твердом (т). Агрегатное состояние обусловлено действием сил межмолекулярного взаимодействия (силы Ван-дер-Ваальса) между однородными молекулами — это явление носит название «когезия» (силы когезии). Когезионное взаимодействие зависит от расстояния, на котором находятся друг от друга молекулы данного вещества — оно практически отсутствует за пределами ICh9 м (нанометр) от центра молекулы, что характерно для газов.
В газообразном состоянии вещество самопроизвольно расширяется, занимая весь предоставленный ему объем, при повышении давления легко изменяет свой объем. Молекулярно-кинетическая теория газов была заложена еще в работах М. В. Ломоносова (1744−1748 гг.). В XIX—XX вв. она получила развитие в работах европейских и русских ученых (Р. Клаузиус, Д. Максвелл, Л. Больцман, Я. И. Френкель). Упрощенная физическая модель поведения газов рассматривает так называемый идеальный газ и исходит из следующих постулатов.
- 1. Молекулы газа можно рассматривать как однородные упругие шарики — отдельные материальные точки.
- 2. Столкновение молекул газа между собой подчиняется законам упругих шаров.
- 3. Взаимодействие между молекулами газа возможно лишь при их столкновении.
- 4. Движение молекул в газе хаотично и непрерывно поступательно.
Эти положения объясняют многие свойства газов: стремление занять возможно больший объем, возникновение давления на стенки сосуда, рост давления с повышением температуры и др. Состояние газа характеризуется температурой, давлением и объемом — при нормальных условиях (температура 273,15 К (0°С) и давление 1,1 325 • 105 Па) 1 моль идеального газа или пара занимает объем 22,41 383 • 10-3 м3 • моль-1 (22,41 л/моль). При малых давлениях и высоких температурах все типичные газы ведут себя практически одинаково.
В жидком состоянии вещество принимает форму заключающего ее сосуда, но сохраняет постоянным свой объем — в этом состоянии вещества практически несжимаемы. Жидкое состояние является промежуточным положением между твердыми телами и газами.
При низких температурах некоторые свойства жидкостей сходны с газами: они текучи, не имеют определенной формы, изотропны — свойства одинаковы по всем направлениям. Однако молекулы жидкости находятся значительно ближе друг к другу, чем в газах (примерно в 3.5 раза), поэтому тепловые движения молекул в жидкости при обычной температуре не выходят за пределы действия когезионных сил (—30 нм). Движение молекул в жидком веществе представляет собой редкие перемещения из одних временных положений равновесия в другие и тепловые колебания в промежутках между ними — этим объясняется текучесть жидкости. В отличие от газов, жидкости обладают объемной упругостью, как и твердые тела, они противодействуют всестороннему сжатию и растяжению. По мере приближения к температуре кипения в жидкости усиливается беспорядок во взаимном расположении частиц. Переход вещества из жидкого состояния в газообразное называется парообразованием.
Твердое состояние вещества характеризуется значительными силами межмолекулярного взаимодействия — силы притяжения между молекулами уравновешиваются силами отталкивания, что обусловливает упорядоченное расположение частиц вещества. Твердые вещества можно получить в аморфном или кристаллическом состояниях. Различия между этими состояниями твердого тела определяются степенью упорядоченности во взаимном расположении атомов или молекул в них. Упорядоченность ближнего порядка проявляется на расстояниях, сравнимых с межатомными (10~9 м), упорядоченность дальнего порядка повторяется на неограниченно больших расстояниях. В газах порядок отсутствует, в жидкостях и аморфных телах существует ближний порядок, но отсутствует дальний. Кристаллические вещества имеют четкую внутреннюю структуру, обусловленную правильным расположением частиц в строго определенном повторяющемся порядке. Наименьший объем кристаллической решетки, отражающий химический состав и особенности внутренней структуры кристалла, называют элементарной ячейкой. Кристаллическим веществам свойственна анизотропия — кристалл в различных направлениях обладает неодинаковыми свойствами. Для аморфного состояния характерна изотропность — свойства одинаковы по всем направлениям. Аморфные вещества не имеют постоянной температуры плавления — при нагревании они размягчаются, постепенно переходя в жидкотекучее состояние. Многие вещества можно получить как в аморфном, так и в кристаллическом состояниях. Например, в природе кварц Si02 существует в кристаллической форме (горный хрусталь) и в аморфном состоянии (опал). В аморфной форме вещества обладают большим запасом энергии, поэтому энергетически менее устойчивы — возникает стремление к переходу в кристаллическое состояние, сопровождающееся выделением теплоты. Этот процесс протекает медленно, например, для перехода стекла в кристаллическое состояние требуются десятки лет, стекло при этом мутнеет и может разрушиться без внешнего воздействия — за счет нарастания внутреннего напряжения. Переход из аморфного состояния веществ в кристаллическое наблюдается и при твердении цемента — прочность увеличивается в течение нескольких лет. Для твердых веществ характерно явление деформации — изменения размеров и форм под действием внешних сил или физико-химических процессов, протекающих в твердом теле (фазовые превращения, усадка и др.). По способности к деформации их подразделяют на три группы: упругие, пластичные и хрупкие.
Упругость — способность твердого материала восстанавливать прежнюю форму и размер после прекращения действия сил, вызвавших деформацию.
Пластичные материалы не восстанавливают первоначальную форму и размер после деформации.
Некоторые твердые вещества могут существовать в нескольких кристаллических формах — модификациях (а, Р, у, …) — буквой, а обозначают форму, устойчивую при обычной температуре и более низких; Р, у, … — повышение температур устойчивого состояния модификаций. Переход из низкотемпературной модификации в высокотемпературную сопровождается поглощением тепла, обратный процесс — выделением.
(экзотермический). Тепловые эффекты превращений модификаций называют теплотой полиморфного превращения, а явление существования твердого вещества в нескольких кристаллических формах получило название полиморфизма. Например, карбонат кальция СаС03 образует в природе минералы кальцит и арагонит, имеющие одинаковый химический состав, но различное внутреннее кристаллическое строение. Строительный гипс CaSO4-0,5H2O получают в модификациях аи рв зависимости от температуры обжига природного гипса.
Изменение внешних условий (температуры, давления) вызывает переход вещества из одного агрегатного состояния в другое. Такие преобразования можно сгруппировать попарно:
- — жидкость —" газ — парообразование;
- — газ —" жидкость — конденсация;
- — твердое —" газ — возгонка;
- — газ —" твердое — десублимация;
- — твердое —" жидкость — плавление;
- — жидкость —> твердое — кристаллизация.
Вода при давлении 4,579 мм. рт. ст. и температуре 0,0075°С находится в трех агрегатных состояниях: лед (т) — жидкость (ж) — пар (г). Для некоторых веществ возможны лишь одно или два агрегатных состояния. Например, карбонат кальция СаС03 практически невозможно получить ни в жидком, ни в газообразном состоянии, так как он разлагается при нагревании:
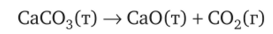
В XX в. было открыто четвертое состояние вещества — плазменное, возникающее при действии на газы сверхвысоких температур (миллионы градусов) или мощных электрических разрядов, при этом молекулы и атомы, теряя электроны, превращаются в заряженные частицы (электронно-ядерный газ). В земных условиях это состояние возникает в молниях, северном сиянии, неоновых и аргоновых лампах — это примеры «холодной» плазмы. Солнце — сгусток «горячей» плазмы, как и основная масса космического вещества (звезды, туманности и др.).