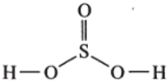
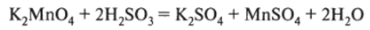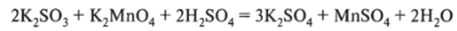Эмпирическая формула сернистой кислоты H2S03, графическая.
В кислоте между атомами водорода и кислорода реализуется полярная ковалентная связь; она сигма, s—p, образована по обменному механизму; электроны смещены к атому кислорода. Между атомами серы и кислорода связь ковалентная полярная, образована по обменному механизму; связей — четыре, из них три связи сигма, одна — пи. В ионе SO^" реализуется .^-гибридизация; сигма-связь, q—р. В пространстве сульфит-ион имеет форму плоского равностороннего треугольника. Общие электронные пары смещены к атому кислорода.
Сернистая кислота — слабая, легколетучая, так как при больших концентрациях легко разлагается на воду и оксид. Ей характерны все свойства неокислительных кислот (охарактеризуйте их самостоятельно). Она — электролит средней силы. Помимо этих свойств сернистая кислота по сульфит-иону способна проявлять как окислительные, так и восстановительные свойства. Как окислитель сернистая кислота реагирует с сероводородом.
Как восстановитель взаимодействует с окислителями:
Реакция протекает в кислой среде.
Сернистую кислоту получают взаимодействием диоксида серы с водой.
Соли сернистой кислоты — сульфиты. Они легко вступают в реакцию с окислителями, проявляя свойства восстановителей, например:
Сернистая кислота и ее соли применяются как реактивы в химической лаборатории и в фотографии.
- ? Задания для самостоятельной работы
- 1. Напишите эмпирическую, структурную и электронную формулы сернистой кислоты.
- 2. Охарактеризуйте особенности химической связи в молекулах сернистой кислоты.
- 3. Напишите уравнения реакций, характеризующих химические свойства сернистой кислоты.
- 4. Поясните, почему сернистая кислота проявляет и окислительные, и восстановительные свойства; ответ обоснуйте уравнениями реакций.