Содержание периодического закона

Соответственно элементы, принадлежащие одной и той же группе, являются аналогами. Как правило, в одной группе все элементы — и главной и дополнительной подгрупп — имеют одинаковую форму высшего солеобразующего оксида, определяемую номером группы. Однако сходство между элементами разных подгрупп одной и той же группы обычно невелико. Зачастую оно ограничено лишь формами соединений в высшем… Читать ещё >
Содержание периодического закона (реферат, курсовая, диплом, контрольная)
На пути к этой простой формулировке в процессе работы по систематизации элементов Менделеев должен был найти исчерпывающие ответы на три вопроса: что, от чего и как зависит.
Что зависит — было понятно. Это вся совокупность химических свойств того или иного элемента, причем именно совокупность, а не какое-то конкретное свойство.
Свойства элементов Менделеев делит на качественные и количественные. К числу качественных он в первую очередь относит способность элемента образовывать кислоты или основания, отмечая, что все элементы «суть более или менее кислотные или основные, с явными переходами от первых ко вторым». Также к качественным свойствам относится принадлежность элементов к металлам и неметаллам.
Среди количественных свойств элементов Менделеев придает особое значение формам соединений, в частности формам высших оксидов и гидридов (они приведены непосредственно в периодической таблице, которую автор демонстрировал на докладе в Русском химическом обществе в 1870 г.). Кроме того, Менделеев рассматривал и многие другие качественные и количественные свойства элементов, главнейшие из которых — атомные объемы, плотность, теплоемкость, температура плавления или кипения простых веществ, способность простых веществ реагировать с кислородом, водой, галогенами, теплоты образования соединений, способность к образованию кристаллических соединений и формы кристаллогидратов и многое другое.
Хорошей иллюстрацией к пониманию Менделеевым предмета периодичности-набора свойств элементов, простых и сложных веществмогут служить его предсказания свойств новых элементов, о которых рассказано ниже (см. разд. 2.3).
Основой систематики свойств элементов у Менделеева, как и у большинства его предшественников, была атомная масса — то, от чего зависят свойства. Однако, несмотря на это единство в выборе аргументов Менделеев превзошел своих предшественников в том, что, опираясь на периодический закон, он критически подошел к выбору значений атомных масс в тех случаях, когда имелось несколько несовпадающих значений, определенных разными авторами; более того, Менделеев уверенно исправил некоторые атомные массы и предсказал их для неизвестных элементов.
Вот отрывок из стенограммы лекции Менделеева, прочитанной студентам Петербургского университета в 1889/90 учебном году: «…самые величины атомных весов элементов могли быть исправлены и в самом деле исправлялись этим периодическим законом. Например, возьмем титан, у которого много летучих соединений. Это, несомненно, элемент четырехатомный, т. е. должен стать в 4-й группе. А представьте теперь, что его атомный вес был определен некоторыми наблюдателями равным 53, т. е. между хромом и марганцем, а то место было пусто и были к тому же наблюдения такого рода, которые давали гораздо меньший атомный вес. Периодическая законность прямо показала, что он должен быть больше, чем у кальция и экабора (скандия), и меньше, чем у ванадия; и, в самом деле, исследования профессора Торпе, который нашел для титана атомный вес 48,01 (сейчас принято значение 47,90. — Авт.) оправдали это. Точно так же атомные веса золота, платины и других элементов были исправлены при помощи периодического закона «.
Основываясь на положении урана в VI группе и на количественном составе его соединений, Менделеев исправил атомную массу урана со 120, как считали ранее, на 240.
Говоря об удивительно точных и смелых предсказаниях атомных масс Менделеевым, трудно не вспомнить известное высказывание Мейера, неудачно претендовавшего на приоритет в открытии периодического закона. Подводя итоги своего рассмотрения зависимости свойств элементов от их атомных масс, он пришел к заключению: «было бы преждевременно на основании таких шатких опорных точек предпринять изменение общераспространенных сейчас атомных весов».
И, наконец, ответ на третий важный вопрос — как зависят свойства элементов от их атомной массы — составляет основное содержание периодического закона. Менделеев отмечает, что все свойства элементов находятся в периодической функциональной зависимости от их атомных масс, хотя не всегда можно просто и наглядно эти зависимости проследить. Важно подчеркнуть, что периодический закон проявляется при анализе любых зависимостей свойств элементов от их атомных масс и поэтому не может быть выражен какой-то одной таблицей, графической или аналитической (формульной) зависимостью. И все же обсуждение изменения свойств химических элементов удобно вести, расположив элементы в виде определенной таблицы. Такая периодическая таблица, или периодическая система, иллюстрирующая периодический закон, и была предложена Менделеевым. При этом он хорошо понимал, что «вид или форма расположения элементов по периодической законности может быть изменяема до чрезвычайности, располагая элементы по поверхности цилиндра, по спирали, по ломаной или зубчатой линии и т. п.»; таким образом, может быть предложено множество форм периодической системы, и все они есть варианты табличного выражения единого периодического закона, его иллюстрации, но ни одна таблица, конечно, не исчерпывает периодического закона.
Рассмотрим структуру таблицы, ориентируясь как на авторский вариант 1870 г. (рис. 2.1), так и на ее современный вид. В первоначальном варианте таблицы восемь столбцов-групп. Первые семь групп делятся на две подгруппы. Следующие за водородом восемь элементов образуют период или ряд. Менделеев различает четные и нечетные ряды и малые и большие периоды. Водород им выделен особо, он единственный элемент в первом ряду и отнесен при этом к первой группе.
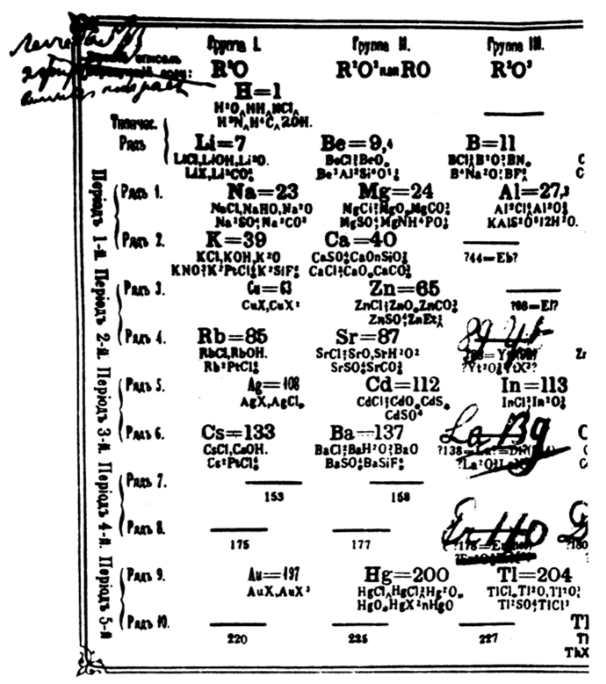
Рис. 2.1. Вариант периодической таблицы 1870 г. (фрагмент).
Второй ряд начинается с лития и заканчивается фтором. Слева направо закономерно меняются формы высших оксидов и гидридов, постепенно ослабляются металлические (основные) свойства и нарастают неметаллические (кислотные). В третьем ряду — для элементов от натрия до хлора — наблюдаются те же закономерности.
Элементы первых рядов от водорода до натрия Менделеев назвал типическими — «распространеннейшие в природе простые тела имеют малый атомный вес, а все элементы с малым атомным весом характеризуются резкостью свойств. Они поэтому суть типические элементы. Водород, как легчайший элемент, по справедливости избирается как самый типический». Менделеев неоднократно подчеркивал, что сходство элементов, их аналогия вовсе не означает полную идентичность. Например, щелочные металлы литий и натрий имеют одинаковые формы оксидов, но различаются по атомным объемам, плотности, температурам плавления, т. е. проявляют свою индивидуальность. Таким образом, в типических элементах «выражены, как в образцах и в наиболее ясной форме, все виды и свойства, но и со своими особенностями».
Следующий четвертый период — большой, он включает элементы от калия до брома, которые Менделеев расположил в два ряда, оставив в нем три свободных места — одно между кальцием и титаном и два — между цинком и мышьяком, основываясь на атомных массах и совокупности свойств, которые заставили его поместить кальций и цинк во вторую группу, титан — в четвертую, а мышьяк — в пятую.
В четвертом периоде за марганцем, которым заканчивается начальный четный ряд периода, следуют три элемента — железо, кобальт и никель, которые Менделеев поместил в новую — восьмую группу, после которой следует нечетный ряд, завершающий период. Аналогичную особенность имеют следующие большие периоды — пятый, в котором восьмой группе принадлежит рутений, родий и палладий, и шестой, явно незаконченный в семидесятые годы прошлого века, с элементами восьмой группы: осмием, иридием и платиной. Менделеев специально отметил ряд особенностей элементов восьмой группы — способность образовывать соединения с оксидом углерода и цианогруппой, а также то, что лишь для двух элементов этой группы — рутения и осмия — известны оксиды обшей формулы R04 -Ru04 и 0s04. Менделеев долгое время не решал окончательно вопрос о том, в какую группу — восьмую четного ряда или первую нечетного — поместить медь и ее аналоги — серебро и золото. В 8-е издание «Основ химии» (1906 г.) он включил длиннопериодную форму, в которой эти элементы отнесены к первой группе, и короткопериодную, в которой большие периоды, начиная с четвертого, разбиты на два ряда, где они также помешены в первую группу, но в скобках приведены также и в восьмой. В более поздних вариантах короткопериодной формы таблицы (в которой лантаноиды и актиноиды вынесены отдельно в нижнюю «есть таблицы) принято в длинных периодах выделять элементы главных подгрупп, по свойствам наиболее близкие к типическим, и элементы дополнительных подгрупп — от скандия до цинка в четвертом периоде и их более тяжелые аналоги.
Анализируя зависимости удельных и атомных объемов от атомной массы, Менделеев отметил, что максимумы соответствуют щелочным металлам, а минимумы — элементам дополнительных подгрупп, причем они более растянуты, чем в случае коротких периодов. Аналогично, и по другим свойствам элементы дополнительных подгрупп являются переходными от щелочных и щелочноземельных металлов с их ярковыраженными основными свойствами к характерным неметаллам, таким, как халькогены, обладающие определенно кислотными свойствами.
Положение элемента в периодической системе определяет весь набор его свойств, как качественных, так и количественных — измеряемых или вычисляемых. Каждый элемент связан множеством закономерных связей с другими элементами.
Как пишет Менделеев, «сопоставление элементов по величине их атомного веса раскрывает или показывает главнейшие их взаимные качественные отношения и аналогии, и в то же время отвечает изменению в них способности к соединениям, что видно не только по правильности в составе окислов, но и во множестве других случаев. Например, по отношению к водороду только в типических элементах второго ряда и только в последних группах нечетных рядов (т. е. в главных подгруппах — Авт.) существует способность образовывать летучие и газообразные соединения, притом в порядке, совершенно отвечающем группам, как видно из примера:
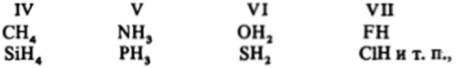
чем и обобщается вышеупомянутое уменьшение способности к соединению с водородом по мере возрастания способности к соединению с кислородом (например, О по отношению к Н одноатомен, а по О ссмиатоменУ'.
По ряду закономерно меняются формы высших оксидов и гидридов, высшая степень окисления и набор промежуточных степеней окисления, меняются атомные объемы и другие измеряемые характеристики простых веществ. У типических элементов и в целом у элементов главных подгрупп слева направо ослабляются основные (металлические) и нарастают кислотные (неметаллические) свойства.
Соответственно элементы, принадлежащие одной и той же группе, являются аналогами. Как правило, в одной группе все элементы — и главной и дополнительной подгрупп — имеют одинаковую форму высшего солеобразующего оксида, определяемую номером группы. Однако сходство между элементами разных подгрупп одной и той же группы обычно невелико. Зачастую оно ограничено лишь формами соединений в высшем состоянии окисления. Например, в седьмой группе галоген хлор-это типичный активный неметалл, в виде простого вещества представляет собой газ, состоящий из двухатомных молекул, а марганец, элемент дополнительной подгруппы, — тугоплавкий металл, хорошо проводящий электрический ток. Естественно, их химические свойства резко различны, но они образуют одинаковые по форме высшие оксиды R207 и соответствующие им соли с анионом RO4.
Наибольшее сходство обнаруживают элементы, относящиеся к одной и той же подгруппе одной и той же группы. Они не только образуют одинаковые по форме соединения, но и физические и химические свойства их простых веществ и соединений близки друг к другу. Далее Менделеев пишет: «На одном месте в периоде встречаются ближайшие, давно установленные аналоги, например: К; Rb и Cs; Са, Sr и Ва; Си, Ag и Аи; Р, As и Sb; S, Se и Те; С1, Вг и I. Следовательно, периодическая законность показывает связь, существующую между ближайшими аналогами, сближает их и вызывает признание не подмечавшихся аналогий…». Не менее важно, однако, то обстоятельство, что внутри подгрупп свойства элементов не идентичны друг другу, а закономерно изменяются от элемента к элементу. Это обстоятельство постоянно подчеркивал Менделеев: «Величина атомного веса определяет характер элемента, как величина частицы определяет свойства сложного тела, а поэтому при изучении соединений должно обращать внимание не только на свойства и количество элементов, не только на их взаимодействие, но и на вес их атома. Оттого, например, соединения S и Те, С1 и I и т. п. при сходстве представляют и различия весьма ясные».
Так, у элементов главных подгрупп закономерно нарастают вниз по группе металлические свойства и ослабляются неметаллические. Например, бор представляет собой типичный неметалл, алюминий — амфотерный элемент, а таллий — типичный активный металл, способный образовывать сильное основание ТЮН. Кислород — один из самых активных неметаллов, а последний элемент шестой группы-полоний в виде простого вещества обладает металлической электропроводимостью.
Таким образом, у элементов главных подгрупп металлические свойства наиболее выражены в левом нижнем углу периодической таблицы, а неметаллические — в правом верхнем. Черты же сходства по кислотноосновному характеру и ряду других свойств проявляют не только элементы одной группы, но и соседи по диагонали, идущей из левого верхнего в правый нижний угол таблицы, поскольку движения по ряду вправо и по группе вниз в определенной мере компенсируют друг друга. Так называемое диагональное сходство ярко проявляется, например, в близости свойств бериллия и алюминия — двух легких металлов, проявляющих амфотерные свойства, или бора и кремния, образующих исключительно многочисленные сходные по структуре кислородсодержащие соединения — бораты и силикаты.
Отметим, что свойства элементов внутри группы меняются немонотонно: наибольший скачок в свойствах наблюдается при переходе от второго периода к третьему (азот и кислород — газы, фоофор и сера-твердые вещества), и вообще четные периоды имеют ряд специфических отличий от нечетных. Это явление, получившее название вторичной периодичности, более подробно рассмотрено в разд. 29.2 и в последующих разделах, посвященных свойствам элементов главных подгрупп.