Яйцеводы и их роль в поддержании доимплантационных стадий беременности

В настоящее время подобную остановку развития связывают с неправильной или несвоевременной активацией эмбрионального генома (АЭГ) у развивающихся в синтетических средах зародышей. Известно, что эмбриональное развитие млекопитающих находится под контролем двух различных механизмов, последовательно сменяющих друг друга в течение доимплантационного периода эмбриогенеза. До определенного момента… Читать ещё >
Яйцеводы и их роль в поддержании доимплантационных стадий беременности (реферат, курсовая, диплом, контрольная)
Первое анатомическое описание яйцеводов млекопитающих было дано Фаллопиусом (Fallopius) в 1561 г. Долгое время считалось, что яйцеводы выполняют единственную функцию — пассивного транспорта гамет и оплодотворенной яйцеклетки. Однако последние исследования показали, что яйцеводы принимают непосредственное активное участие в транспорте гамет, капацитации сперматозоидов, оплодотворении и раннем эмбриональном развитии. Огромную роль в процессах доимплантационного развития играет эпителий яйцеводов, благодаря секреторной активности которого создаются оптимальные условия для процессов раннего развития.
Анатомия яйцеводов может существенно различаться у разных видов, однако у всех млекопитающих в нем можно выделить четыре анатомических отдела (рис. 20):
Рис. 20.
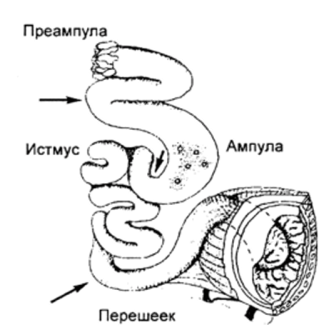
Схема организации яйцевода мыши (по Ле’т’шз, 1969).
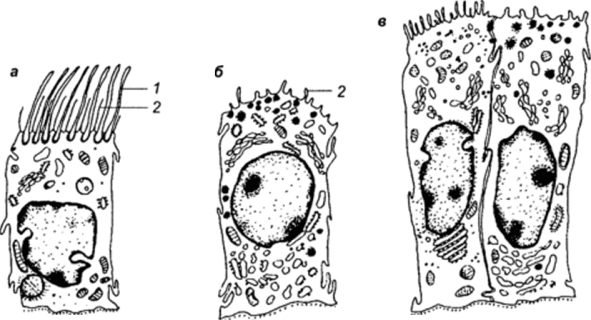
Рис. 21.
Клеточный состав эпителия яйцеводов млекопитающих (по ЛеШиз 8., 1969):
а — ресничная клетка ампулы; б — нересничная клетка ампулы; в — нересничные клетки истмуса. 1 — реснички; 2 — микроворсинки.
- 1. Инфундибулум (или воронка яйцевода) содержит большое число секреторных клеток, открывается в перитонеальную полость.
- 2. Ампула — основной секреторный регион яйцевода.
- 3. Истмус (или перешеек) в составе своей стенки имеет преимущественно мышечные клетки, секреторная активность эпителия здесь ниже.
- 4. Яйцеводно-маточное соединение.
Кровеносные сосуды, снабжающие яйцеводы кровью, тесно связаны с сосудами яичников и матки посредством многочисленных анастомозов, что облегчает обмен метаболитами и биологически активными веществами между этими органами. В стенке яйцеводов представлены лимфатические сосуды, а также симпатические и парасимпатические нервные волокна.
Эпителиальный пласт содержит секреторные и ресничные клетки (рис. 21). Секреторные клетки претерпевают цикличные изменения (гипертрофию и атрофию) в ходе полового цикла.
Реснички обычно не выражены в яйцеводах плодов и появляются ко времени рождения плода или непосредственно перед началом половой зрелости.
Сперматозоиды после коитуса попадают в область яйцеводно-маточного контакта и находятся там до момента овуляции. Процесс оплодотворения происходит в ампуле яйцевода.
Как было сказано выше, одной из основных функций эпителия яйцеводов является секреторная функция. Объем секретируемой жидкости является гормонально зависимым — он увеличивается под действием эстрадиола и уменьшается под действием прогестерона. Некоторые фармакологические препараты (парасимпатомиметики, симпатомиметики и симпатолитики) могут также изменять активность секреции.
Биохимический анализ показал, что жидкость яйцеводов образуется как за счет транссудации некоторых веществ из сыворотки крови, так и за счет активного синтеза некоторых компонентов клетками эпителия.
Осмолярность жидкости яйцеводов сходна с осмолярностью сыворотки крови. Онкотическое давление ниже, чем у сыворотки, из-за низкого содержания белков. Присутствие бикарбонат-СОг-ангидразной системы обусловливает щелочную реакцию среды. Напряжение кислорода составляет около 60 мм рт. ст, т. е. меньше чем половина атмосферного.
Эпителий яйцеводов обладает избирательной проницаемостью. В результате концентрация некоторых веществ в жидкости яйцеводов значительно отличается от таковой в сыворотке крови. Так, уровень калия и бикарбонатов в 2- 5 раз выше, чем в сыворотке. Концентрация натрия, кальция, магния и хлора одинакова в обоих компартментах. Концентрация глюкозы в жидкости яйцеводов ниже (1−3 мМ), чем в сыворотке крови (5−6 мМ). Концентрация лактата выше, чем в сыворотке крови, вследствие метаболизма глюкозы клетками эпителия яйцеводов.
Содержание липидов в жидкости яйцеводов невысокое, но в ней присутствуют все классы липидов: фосфолипиды, триглицериды, свободный и этерифицированный холестерин.
В качестве переносчиков липидов выступают липопротеины высокой плотности и альбумины, которые также могут связываться со стероидами.
Состав свободных аминокислот в жидкости яйцеводов сильно отличается от сыворотки крови. Концентрация большинства свободных аминокислот в жидкости яйцеводов выше (в частности, концентрация метионина, лейцина, фенилаланина, лизина, глицина, аланина, тирозина, таурина, гипотаурина). Глицин и аланин содержатся в наибольшем количестве в жидкости яйцеводов большинства видов. Концентрация аланина, и особенно глицина, здесь значительно выше, чем в крови: так, концентрация глицина может достигать 5 мМ. Глицин и аланин участвуют в регуляции pH внутри клеток, а также в механизмах защиты эмбрионов от осмотического стресса. Также в жидкости яйцеводов отмечается высокая концентрация таурина и гипотаурина. Они продуцируются эпителиальными клетками благодаря наличию специфического энзима — цистеинсульфинат декарбоксилазы. Таурин и гипотаурин вовлечены в процессы активации спермиев; гипотаурин также участвует в инактивации свободных радикалов. Таурин обладает антиоксидантным и мембранопротективным эффектами. Небольшое количество аминокислот слабо представлены в жидкости яйцеводов (треонин, серин).
Концентрация белков в жидкости яйцеводов в десять раз меньше, чем в сыворотке крови. Большинство белков попадают в полость яйцевода из крови, и их количество не зависит от стадии полового цикла и концентрации гормонов в крови. От 60% до 80% белков в жидкости яйцеводов представлены альбуминами. Кроме того, эпителиальные клетки яйцевода синтезируют специфические гликопротеины. Эти молекулы описаны в жидкости яйцеводов кроликов, мышей, коров, обезьян, женщин. Их синтез находится под контролем женских половых гормонов, соответственно интенсивность их синтеза зависит от стадии полового цикла. Их концентрация выше всего в преовуляторный период, а затем уменьшается. Показано, что эти гликопротеины демонстрируют высокую степень гомологии у разных видов млекопитающих. Эти специфичные для яйцевода гликопротеины связываются с блестящей оболочкой ооцитов и эмбрионов.
Существует точка зрения, что подобное связывание способствует успешному оплодотворению. Кроме того, эти гликопротеины ускоряют капацитацию спермиев и их связывание с блестящей оболочкой.
Ведущую роль эпителиальных клеток половых путей самки в процессах раннего эмбриогенеза подтверждает и тот факт, что зародыши млекопитающих, извлеченные из организма матери на начальных стадиях их развития, не всегда способны к полному доимплантационному развитию в культуре и при определенных условиях прекращают свое дробление.
В настоящее время подобную остановку развития связывают с неправильной или несвоевременной активацией эмбрионального генома (АЭГ) у развивающихся в синтетических средах зародышей. Известно, что эмбриональное развитие млекопитающих находится под контролем двух различных механизмов, последовательно сменяющих друг друга в течение доимплантационного периода эмбриогенеза. До определенного момента реализация генетической программы развития определяется действием цитоплазматических факторов, имеющих материнское происхождение, т. е. накопленных еще в оогенезе. Однако, уже на ранних стадиях дробления происходит АЭГ, т. е. проявляется транскрипционная активность хромосом эмбриона. До этого момента ядра эмбрионов являются транскрипционно неактивными. В период, соответствующий АЭГ, в бластомерах происходит резкое изменение профиля синтезируемых белков, поскольку в это время интенсивно разрушаются мРНК материнского происхождения и образуются разнообразные мРНК эмбрионального происхождения. Эти изменения в значительной степени дестабилизируют метаболизм зародыша, вследствии чего стадия АЭГ считается одной из критических стадий доимплантационного развития. Время начала АЭГ определяется особой системой биологических ритмов (так называемыми «зиготическими часами*), которая определяет биологический возраст эмбриона как время, прошедшее с момента оплодотворения. У разных видов млекопитающих АЭГ проходит в период от 2−4 до 8−16-клеточной стадии развития.
Как говорилось выше, если эмбрионы некоторых млекопитающих эксплантируются из организма матери до этих сроков, то их дробление останавливается. Так, развитие зародышей некоторых инбредных линий мышей, эксплантированные in vitro на одноклеточной или ранней двуклеточной стадиях и культивируемые в стандартных средах, останавливается на дву клеточной стадии. Подобная остановка дробления мышиных зародышей получила название «двуклеточного блока in vitro*. (Аналогичное явление наблюдается и в случае зародышей других млекопитающих и человека, но на других сроках.) Наблюдение за блокированными зародышами при их длительном культивировании показало, что в течение 2 суток после остановки деления они сохраняют свою морфологическую целостность. Блокирование развития происходит на границе стадий G2 и М второго клеточного цикла, в ядрах эмбрионов проходит один раунд репликации ДНК с последующим ингибированием синтеза ДНК и кариокинеза. Осуществлению митоза препятствует также и то, что белок p34cdc2, хотя и содержится в клетках в достаточном для индукции митоза количестве, находится в фосфорилированной форме, и, по неизвестной причине, не активируется. В блокированных зародышах происходит частичная реализация программы индивидуального развития, что выражается в принципиальном изменении качественного состава синтезируемых белков и некоторых изменениях морфологии эмбрионов. По совокупности данных принято считать, что блок не тождествен гибели зародышей, а скорее является приостановкой развития.
В ряде экспериментальных работ было показано, что совместное культивирование эмбрионов с клетками эпителия яйцеводов предотвращает такую остановку развития. Сходный эффект оказывает обогащение культуральных сред рядом биологически активных веществ, секретируемых эпителиальными клетками половых путей. В последнее время положительный эффект совместного культивирования доимплантационных эмбрионов млекопитающих и эпителиальных клеток яйцеводов связывают с уменьшением в таких системах уровня свободных радикалов. К настоящему моменту показано, что в эпителии яйцеводов синтезируется целый ряд ферментов, обладающих антиоксидантным действием и, кроме того, уровень этих ферментов меняется в течение эстрального цикла.